Et si manipuler le microbiote améliorait la réponse à l’immunothérapie ?
Le microbiote intestinal pourrait moduler les réponses à l'immunothérapie. S’il est trop tôt pour proposer un cocktail de probiotiques scientifiquement validé, l’usage des antibiotiques doit être raisonné pendant la thérapie.
en_sources_title
en_sources_text_start en_sources_text_end
A propos de cet article
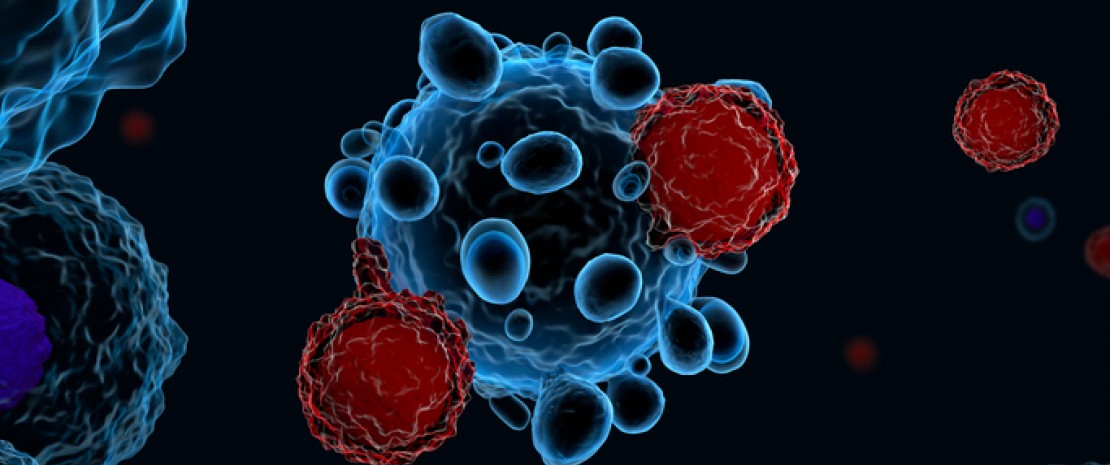
Plus efficace et moins toxique que la chimiothérapie, l’immunothérapie exploitant des cellules CAR-T fait l’objet d’essais cliniques de plus en plus nombreux. Elle recourt à des lymphocytes T génétiquement modifiés pour les doter d’un récepteur antigénique chimérique (Chimeric Antigen Receptor ou CAR) leur permettant de reconnaître spécifiquement les cellules tumorales et de les tuer. Malgré des résultats impressionnants chez certains patients, la réponse clinique aux lymphocytes CAR-T reste très hétérogène.
L’hypothèse des auteurs
Dans cette revue, les auteurs émettent l'hypothèse qu’une manipulation du microbiote intestinal pourrait améliorer les réponses aux lymphocytes CAR-T. Et ce bien qu’il n’y ait, pour l’heure, aucun résultat publié démontrant cet effet. La seule étude disponible (étude d'observation unicentrique), qui porte sur 25 patients recevant des cellules CAR-T, montre que les répondeurs ont une composition microbienne différente des non-répondeurs, laissant entrevoir une possible association entre les taxons intestinaux et la réponse aux lymphocytes CAR-T. Néanmoins, pour formuler leur hypothèse, les auteurs s’appuient sur un faisceau d’arguments : des preuves précliniques et cliniques croissantes élucidant les mécanismes d'échappement chez les non-répondeurs aux cellules CAR-T ; des preuves cliniques d'amélioration, via la manipulation du microbiote intestinal (diversité et composition), des réponses aux traitements par inhibition des points de contrôle immunitaire (ICI*) ; enfin, sur des caractéristiques immunologiques communes entre les cellules CAR-T et ICI.
Quelles recommandations pratiques ?
Si l’implication du microbiote dans la réponse au traitement par lymphocytes CAR-T se vérifie, les antibiotiques à large spectre durant l'immunothérapie pourraient donc entraîner une dysbiose, de moindres réponses au traitement et une baisse de la survie. Côté probiotiques, bien que certains genres bactériens pourraient avoir un effet positif sur les réponses à l'immunothérapie, les résultats des études cliniques ne sont pas toujours uniformes pour stratifier clairement les taxons "favorables" vs ceux "défavorables". Aussi, un « cocktail » rationnellement conçu de bactéries vivantes reste à définir. Dans cette attente, l’équipe recommande de ne pas utiliser les probiotiques disponibles sur le marché pendant le traitement du cancer, car ils pourraient diluer la flore intestinale native et la rendre potentiellement moins diversifiée. De même, l’équipe conseille de ne pas utiliser de façon imprudente les antibiotiques à large spectre au moment de l'immunothérapie et de traitement par cellules CAR-T.
* : points utilisés par les tumeurs pour se protéger contre les attaques du système immunitaire et que la thérapie par ICI peut bloquer afin de rétablir la fonction du système immunitaire