Microbiote buccal et maladies chroniques
Par le Dr Jay Patel
Institut Usher des sciences de la santé de la population et de l’informatique, Université d’Édimbourg, Royaume-Uni
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Même si le rôle co-évolutif du microbiote humain dans la santé est de plus en plus reconnu dans la médecine moderne, la contribution du microbiote buccal à l’état de santé et au bien-être est encore largement mise de côté. En conditions normales, le microbiote buccal maintient un équilibre symbiotique délicat avec l’hôte, les bactéries néfastes restant à des niveaux cliniquement négligeables. Cependant, les pressions environnementales extérieures entraînent facilement une dysbiose, traduisant la colonisation de la bouche par des micro-organismes dont la diversité et les proportions sont anormales. Ces pressions environnementales sont souvent des facteurs de risque tout à fait modifiables. De plus en plus d’éléments suggèrent qu’il ne s’agit pas ici simplement d’une activité pathologique locale, mais plutôt d’un profil de risque étendu à d’autres maladies chroniques majeures, dans un contexte de forte prévalence mondiale de maladies comme le diabète, les maladies cardiovasculaires athérosclérotiques et la polyarthrite rhumatoïde.
En conditions normales, le microbiote buccal constitue une communauté diversifiée et équilibrée qui protège la bouche contre les maladies. Mais le mode de vie moderne peut facilement perturber cet équilibre, rendant cette communauté moins protectrice et de plus en plus nocive.
Mécanisme
La chaleur et l’humidité régnant dans la bouche ainsi que sa morphologie confèrent un habitat propice à la colonisation et à la croissance de bactéries très diverses. À la naissance, les enfants acquièrent un microbiote buccal simple, et avec l’âge, la poussée des dents et l’aide de facteurs extérieurs, cette communauté devient de plus en plus complexe. Des facteurs liés à l’hôte et aux micro-organismes maintiennent l’équilibre homéostatique du microbiote buccal nécessaire à la santé.
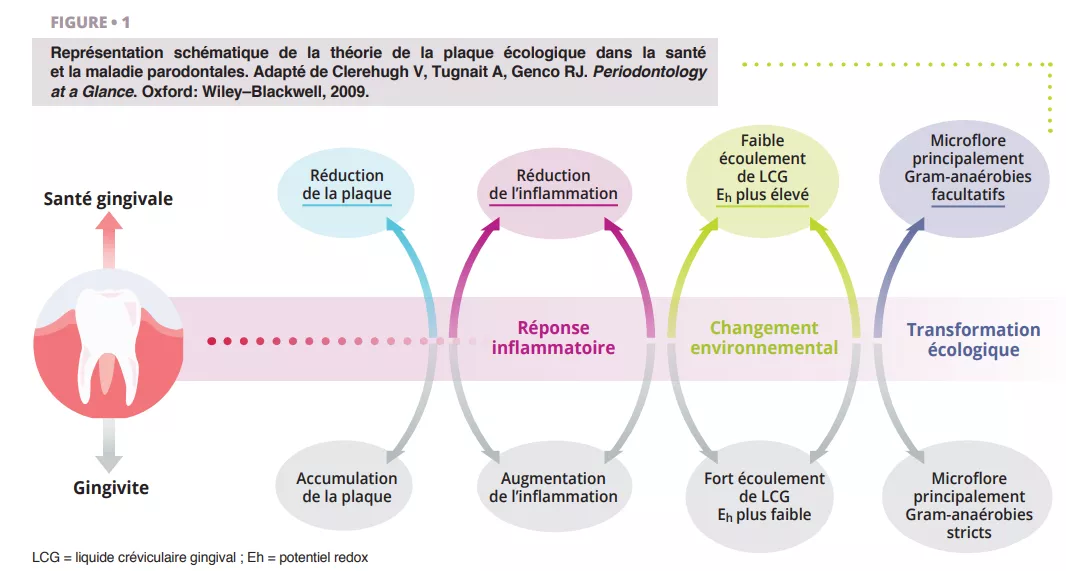
Une mauvaise hygiène bucco-dentaire peut constituer une pression écologique importante conduisant à une dysbiose des communautés microbiennes complexes de la bouche [1].
Les transformations écologiques intervenant dans un écosystème dysbiotique favorisent la colonisation et la prolifération de bactéries buccales pathogènes (figure 1). Quand la quantité de ces espèces augmente, le risque de maladie buccale augmente significativement. La maladie parodontale est un processus inflammatoire chronique non résolutif entraînant la destruction des tissus de soutien des dents, qui peut provoquer une perte de dents en l’absence de traitement. Les activités courantes, comme la mastication, l’utilisation de fil dentaire et le brossage des dents, peuvent induire une bactériémie, qui facilite la dissémination hématogène des bactéries buccales et des médiateurs inflammatoires, induisant une inflammation systémique chez certains patients [2]. Les patients atteints de maladie parodontale –– la 6e maladie la plus fréquente chez l’être humain [3] –– montrent des micro-ulcérations au niveau de l’épithélium sulculaire et un endommagement des tissus parodontaux, et semblent davantage sensibles à la bactériémie. Par conséquent, l’état inflammatoire induit par la maladie parodontale métastase vers d’autres parties du corps, à des niveaux pouvant être cliniquement significatifs. Une bonne hygiène bucco-dentaire est donc essentielle pour contrôler la charge bactérienne totale de la bouche, maintenir ou rétablir l’équilibre symbiotique buccal et empêcher la dissémination des bactéries buccales vers d’autres parties du corps.
Les caractéristiques du microbiote buccal ne se limitent pas à des modifications pathologiques buccales, mais peuvent influencer l’état de santé général et parfois, cette influence est mesurable en termes positifs et négatifs.
Diabète
Des preuves robustes montrent un rôle bidirectionnel entre la santé buccale et la santé systémique, avec une relation « dose-dépendante » entre la sévérité de la parodontite et les complications du diabète.
Le diabète de type II est une maladie métabolique caractérisée par une production insuffisante d’insuline et l’incapacité résultante de l’organisme à métaboliser le glucose, se traduisant par des taux élevés de glucose dans le sang (hyperglycémie chronique). La parodontite sévère influence fortement l’hémoglobine glyquée (HbA1c) et la glycémie à jeun chez les personnes diabétiques et non diabétiques [4]. La parodontite est donc reconnue comme la 6e complication du diabète, le risque de parodontite étant multiplié par 2 à 3 chez les personnes diabétiques [5].
19–33% Comparativement aux personnes sans maladie parodontale, les patients atteints de parodontite sévère ont un risque accru de 19 à 33 % de développer un diabète [6].
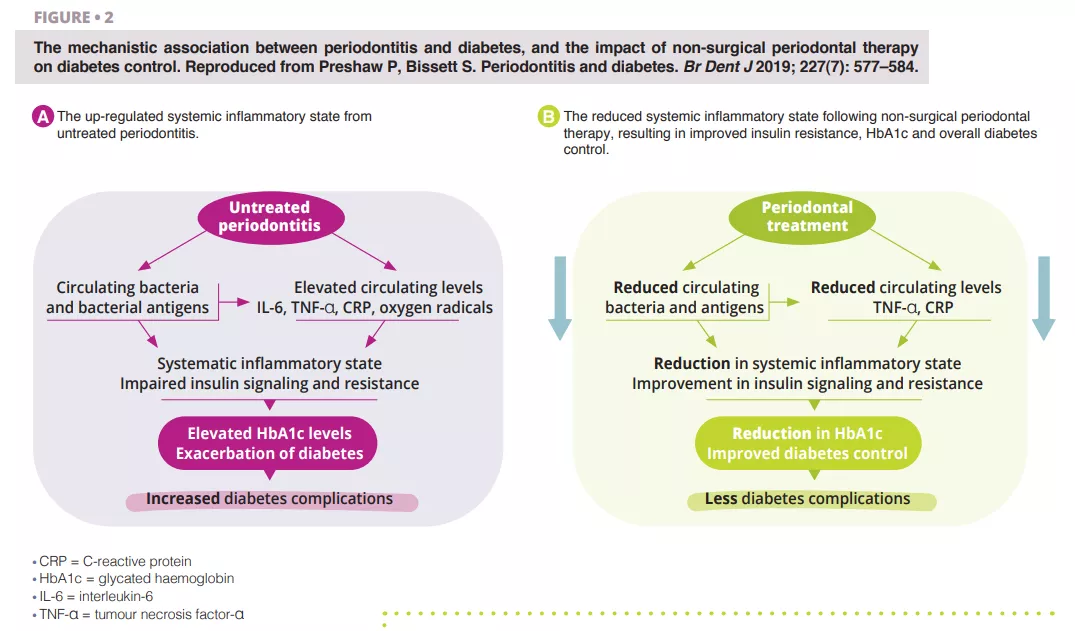
Une parodontite sévère non traitée est associée à une augmentation des taux circulants de bactéries et d’antigènes bactériens, de médiateurs et de cytokines pro-inflammatoires, et à une augmentation des taux d’interleukine 6, de facteur de nécrose tumorale alpha, de protéine C-réactive et de radicaux libres de l’oxygène. Cet effet combiné créé les conditions d’une inflammation systémique, altérant la signalisation insulinique et la résistance à l’insuline [6]. Sur le plan clinique, ce phénomène est reconnu par l’augmentation de l’HbA1c et la progression du diabète, avec un risque accru de complications diabétiques. Le traitement parodontal réduit la charge bactérienne buccale et fait donc baisser les taux circulants de médiateurs inflammatoires, réduisant ainsi le degré de l’état inflammatoire systémique (figure 2). Par conséquent, la prise en charge dentaire de la parodontite peut permettre d’obtenir une amélioration cliniquement significative du contrôle glycémique, les patients diabétiques connaissant des réductions de l’HbA1c de 0,3 à 0,4 % jusqu’à 4 mois après le traitement.
Maladies cardiovasculaires athérosclérotiques
L’athérosclérose décrit une accumulation de lipides, de cholestérol et de cellules sanguines formant des dépôts de plaque durcis à l’intérieur des parois artérielles, faisant obstruction au flux sanguin dans les vaisseaux et augmentant le risque de complications cardiovasculaires.
Les bactéries buccales sont des agents infectieux qui contribuent à la pathogenèse de l’athérosclérose par l’envahissement des cellules cardiovasculaires de l’hôte, à savoir les cellules endothéliales [7].
Une maladie parodontale chronique peut entraîner un dysfonctionnement endothélial par le biais d’un état inflammatoire systémique élevé, qui peut être mis en évidence par une augmentation des taux d’IL-6, de fibrinogènes et de produits bactériens parodontopathiques, tels que vésicules de la membrane externe et gingipaïnes [8]. La pathologie athérosclérotique semble en grande partie imputable à Porphyromonas gingivalis. Cependant, Aggregatibacter actinomycetemcomitans, Prevotella intermedia, Tannerella forsythia et Fusobacterium nucleatum ont toutes été étudiées dans le cadre de cette association. Les principales implications microbiennes sont le dysfonctionnement endothélial et la promotion de l’athérosclérose dans les cellules cardiovasculaires. P. gingivalis a la capacité de se fixer aux cellules endothéliales cibles, et des facteurs extérieurs permettent son entrée dans les cellules, où elle induit des effets pro-coagulants. Un essai contrôlé, randomisé, en simple aveugle et en groupes parallèles a montré que même si un traitement parodontal intensif entraînait dans un premier temps une inflammation systémique et un dysfonctionnement endothélial, 6 mois après le traitement, on observait des améliorations de la fonction endothéliale tant sur le plan clinique que biochimique [9]. Cette étude vient conforter la théorie selon laquelle un contrôle parodontal pourrait moduler les processus cardiovasculaires athérosclérotiques
Polyarthrite rhumatoïde
La polyarthrite rhumatoïde est une maladie inflammatoire auto-immune chronique qui touche le liquide synovial des articulations de manière symétrique et qui, en l’absence de traitement, peut atteindre d’autres organes. Porphyromonas gingivalis est impliquée dans la physiopathologie de la polyarthrite rhumatoïde, dans laquelle les bactéries produisent des enzymes ayant la capacité de citrulliner des protéines, augmentant la probabilité de réductions de la tolérance immunitaire de l’hôte et favorisant la libération d’auto-anticorps caractéristiques de cette maladie [10]. Plusieurs études ont montré que la parodontite causée par des biofilms buccaux dysbiotiques pouvait déclencher une polyarthrite rhumatoïde avec une inflammation systémique et une érosion osseuse accrue. Une relation bidirectionnelle entre les deux maladies inflammatoires a été avancée, mais d’autres preuves sont nécessaires pour vérifier cette hypothèse [11].
82% Des données transversales provenant des États-Unis ont montré une augmentation de 82 % de la polyarthrite rhumatoïde associée à la parodontite, identifiée par un accroissement de la perte de fixation parodontale [12].
Les cliniciens impliqués dans la prise en charge rhumatologique des patients arthritiques doivent être conscients du rôle de la parodontite dans l’efficacité des traitements de fond biologiques, car le maintien de l’inflammation systémique pourrait affecter la réponse au traitement.
Le traitement parodontal non chirurgical semble améliorer l’expression biochimique de la polyarthrite rhumatoïde, mais son rôle dans l’amélioration des résultats cliniques reste à préciser.
Chez les patients présentant des biofilms buccaux dysbiotiques, où les proportions de bactéries parodontopathiques capables de citrulliner des protéines sont supérieures à la normale, il serait prudent d’inclure dans le plan de prise en charge rhumatologique un traitement préventif et curatif visant à stabiliser le microbiote buccal et l’inflammation parodontale.
Prévention
Les avancées scientifiques réalisées dans le domaine de la compréhension du microbiote buccal démontrent que celui-ci contribue à la santé et au bien-être tant au niveau buccal que général. La théorie de la plaque écologique est l’hypothèse actuellement acceptée qui implique des modifications microbiologiques à l’intérieur de la bouche, où les transformations intervenant dans l’écologie du microbiote buccal entraînent une dysharmonie, induisant une augmentation du nombre d’agents pathogènes nocifs clés [13]. La dissémination des bactéries buccales dans l’ensemble du corps est sensiblement réduite par l’amélioration du contrôle de la charge microbienne buccale. Une élimination mécanique quotidienne de la plaque, grâce à une technique de brossage et de nettoyage interdentaire systématique et complète, réduit le volume de cette charge et empêche la colonisation d’espèces pathogènes. Un bon contrôle de la plaque permet aussi de prévenir le risque de maladies parodontales, caractérisées par une micro-ulcération de l’architecture gingivale, produisant des canaux permettant la fuite de bactéries et de médiateurs inflammatoires.
Avec des interventions professionnelles réalisées par des praticiens dentaires (instructions concernant l’hygiène bucco-dentaire, contrôle des facteurs de risque et élimination mécanique de la plaque), les processus pathologiques parodontaux peuvent être stabilisés voire même inversés s’ils sont légers.
Quand l’équilibre microbien a été perturbé par la maladie, l’équilibre symbiotique du microbiote buccal peut être rétabli et stabilisé grâce à des interventions personnelles et professionnelles relativement simples.
Conclusion
Les recherches concernant les associations entre les modifications du microbiote buccal et les maladies chroniques systémiques se poursuivent. Il existe de nombreuses raisons plausibles justifiant la bidirectionnalité de ces liens supposés. La dysbiose du microbiote buccal, le principal facteur contribuant à l’apparition et à la progression des maladies locales et générales, est médiée par des facteurs de risque tout à fait modifiables, ce qui renforce l’intérêt de la prévention et la nécessité pour les systèmes de santé de réorienter leur mode de prise en charge pour donner davantage de place aux soins bucco-dentaires préventifs.
1. Kilian M, Chapple IL, Hannig M, et al.. The oral microbiome - an update for oral healthcare professionals. Br Dent J 2016; 221: 657–66.
2. Patel J, Sampson V. The role of oral bacteria in COVID-19. Lancet Microbe 2020; 1: e105.
3. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet 2020; 396: 1204–22.
4. Preshaw PM, Alba AL, Herrera D, et al. Periodontitis and diabetes: a two-way relationship. Diabetologia 2012; 55: 21–31.
5. Teeuw WJ, Kosho MX, Poland DC, Gerdes VE, Loos BG. Periodontitis as a possible early sign of diabetes mellitus. BMJ Open Diabetes Res Care 2017; 5: e000326.
6. Preshaw P, Bissett S. Periodontitis and diabetes. Br Dent J 2019; 227: 577–84.
7. Tonetti MS, Van Dyke TE; working group 1 of the joint EFP/AAP workshop. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Periodontol 2013; 84(Suppl 4): S24–S29.
8. Reyes L, Herrera D, Kozarov E, Roldán S, Progulske-Fox A. Periodontal bacterial invasion and infection: contribution to atherosclerotic pathology. J Clin Periodontol 2013; 40 (Suppl 14): S30-S50.
9. Tonetti MS, D’Aiuto F, Nibali L, et al. Treatment of periodontitis and endothelial function. N Engl J Med 2007; 356: 911–20.
10. Quirke AM, Lugli EB, Wegner N, et al. Heightened immune response to autocitrullinated Porphyromonas gingivalis peptidylarginine deiminase: a potential mechanism for breaching immunologic tolerance in rheumatoid arthritis. Ann Rheum Dis 2014; 73: 263–9.
11. González-Febles J, Sanz M. Periodontitis and rheumatoid arthritis: What have we learned about their connection and their treatment? Periodontol 2000 2021; 87: 181–203.
12. de Pablo P, Dietrich T, McAlindon TE. Association of periodontal disease and tooth loss with rheumatoid arthritis in the US population. J Rheumatol 2008; 35: 70–6.
13. Marsh PD. Microbial ecology of dental plaque and its significance in health and disease. Adv Dent Res 1994; 8: 263–71.

