Helicobacter pylori e microbiota gastrointestinal
Pelo Prof. Juozas Kupcinskas
Departamento de Gastroenterologia e Instituto de Investigação Digestiva, Universidade Lituana de Ciências da Saúde, Kaunas, Lituânia
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Sobre este artigo
A Helicobacter pylori (H. pylori) afeta cerca de 50% da população mundial e é a infeção bacteriana mais comum em todo o mundo. De acordo com a Organização Mundial de Saúde (OMS), a H. pylori está classificada como um agente cancerígeno do Grupo 1, que pode causar doenças précancerosas e cancerosas no estômago, incluindo o adenocarcinoma gástrico. Anteriormente, acreditava-se que a H. pylori era o único microrganismo que vivia no estômago humano, mas os recentes avanços nas tecnologias de investigação permitiram uma melhor compreensão do microbioma gástrico. A H. pylori desempenha um papel fundamental na formação do ambiente microbiano do estômago. No entanto, o microbioma “não-Helicobacter” do estômago também foi descrito e é um tema quente na investigação atual. É evidente que a H. pylori é um dos principais modificadores do microbioma gástrico, mas outras espécies podem também contribuir para as vias carcinogénicas. Os efeitos dos inibidores da bomba de protões (IBP) e das terapias de erradicação da H. pylori nas alterações do microbioma também têm sido estudados. Neste artigo de revisão, pretendemos resumir as descobertas recentes sobre o microbioma gástrico e o papel da H. pylori na sua formação, bem como o impacto da erradicação da H. pylori e dos IBP no microbioma humano
A H. pylori é a principal bactéria que molda a composição do microbioma gástrico
O microbioma gástrico está a receber cada vez mais atenção, com um interesse crescente nos seus fatores determinantes. Vilchez-Vargas et al. investigaram a composição microbiana em vários compartimentos gastrointestinais (GI). O seu estudo envolveu uma coorte de 108 pares de gémeos, tendo sido analisadas biópsias do microbioma gástrico da mucosa do estômago. A diversidade do microbioma foi avaliada utilizando as regiões V1-V2 do gene 16S rRNA através de amplificação e sequenciação. Os resultados alinham-se com achados anteriores, destacando o H. pylori como um fator chave na composição da microbiota do estômago 1.
Hua et al. realizaram um estudo com uma coorte de 193 pacientes para examinar o impacto da H. pylori na riqueza e diversidade do microbiota gástrico em indivíduos com gastrite crónica. Traçaram o perfil da região V3-V4 do gene 16S rRNA e encontraram alterações significativas no microbiota gástrico devido à infeção por H. pylori. Especificamente, a H. pylori suprimiu a microbiota gástrica dominante ao nível do género, incluindo Aliidiomarina, Reyranella, Halomonas, Pseudomonas e Acidovorax. As suas descobertas indicaram que estirpes virulentas de H. pylori estavam significativamente associadas à gastrite atrófica crónica e à diminuição da riqueza do microbiota gástrico 2.
Schulz et al. analisaram as diferenças na composição da microbiota entre pacientes infetados por H. pylori e pacientes negativos para H. pylori. Observaram uma diferença significativa na abundância relativa de Proteobactérias, que eram mais prevalentes nos aspirados de pacientes infetados com H. pylori. Outros filos apresentaram uma abundância relativa mais baixa (figura 1) 3
Miftahussurur et al. investigaram a variabilidade do microbiota gástrico entre pacientes H. pylori positivos e H. pylori negativos numa coorte de 137 indivíduos da população indonésia. Verificaram que a β-diversidade e a riqueza microbianas eram significativamente mais elevadas nas amostras positivas para H. pylori em comparação com as amostras negativas para H. pylori. Além disso, os seus resultados sugeriram que o H. pylori desempenha um papel principal na formação da comunidade microbiana gástrica neste grupo étnico 4.
Estes estudos destacam coletivamente a H. pylori como um fator crucial para influenciar a diversidade e a riqueza do microbioma gástrico no ambiente estomacal agressivo.
O que é umverdadeiro microbioma gástrico?
O estômago apresenta condições extremas para os microrganismos vivos. Há algumas décadas, a H. pylori foi identificada como uma bactéria capaz de resistir a estas condições estomacais adversas. Esta descoberta despertou a curiosidade e levou a mais investigação sobre o microbioma gástrico. Continua a ser incerto se as bactérias não-Helicobacter no estômago representam contaminantes transitórios ou parte de uma microbiota persistente. Spiegelhauer et al. efetuaram um estudo que envolveu 22 doentes com dispepsia e 12 com adenocarcinoma gástrico 5. Foram realizadas biópsias da mucosa gástrica e analisada a região V3- V4 do gene 16S rRNA, além da cultura de microrganismos. Os autores levantaram a hipótese de que a H. pylori é a única bactéria verdadeiramente residente no estômago e que persistiria em biópsias lavadas. Os seus resultados indicaram que a carga bacteriana diminuiu nas biópsias lavadas, sugerindo uma contaminação transitória a partir da cavidade oral. No entanto, a diversidade de microrganismos não diferiu entre as biópsias não lavadas e as lavadas.
Ainda não é claro se os microrganismos não-H. pylori no estômago são contaminantes transitórios ou verdadeiros residentes.
É possível que a saliva engolida continuamente, contendo organismos vivos, possa sobreviver às condições ácidas durante algum tempo. A contaminação da região orofaríngea superior durante a gastroscopia e a colheita de amostras também deve ser considerada 6. Estes resultados realçam a necessidade de mais investigação sobre o verdadeiro microbioma gástrico.
Efeito da erradicação da H. pylori no microbioma gástrico e intestinal
A H. pylori é uma das infeções mais disseminadas a nível mundial, afetando mais de metade da população humana. A maioria dos regimes de tratamento da H. pylori envolve dois ou mais antibióticos, o que pode afetar o microbioma gastrointestinal. Liou et al. investigaram alterações a longo prazo na microbiota intestinal após a erradicação da H. pylori. O seu estudo multicêntrico e aleatório incluiu 1620 participantes que foram distribuídos aleatoriamente por três grupos de tratamento. Os autores avaliaram a diversidade bacteriana em vários momentos após a erradicação através da análise de amostras fecais. Os resultados mostraram que tanto a diversidade alfa como a diversidade beta diminuíram nas duas semanas após a erradicação, mas voltaram aos níveis de base na oitava semana e um ano depois. Estes resultados indicam apenas uma perturbação a curto prazo do microbioma gastrointestinal e sugerem que a terapia de erradicação da H. pylori é geralmente segura a longo prazo 7.
He et al. relataram alterações no microbioma gastrointestinal após a erradicação da H. pylori, utilizando a análise do gene 16S rRNA de amostras da mucosa gástrica e fecais. Verificaram que a diversidade alfa do microbioma gástrico aumentou e que a diversidade beta do microbioma intestinal diferia significativamente dos níveis pré-tratamento, mas assemelhava-se à dos controlos saudáveis 24 semanas após a erradicação 8.
Guo et al. resumiram os resultados sobre as alterações no microbioma gástrico após um tratamento bem-sucedido da H. pylori. A sua revisão sistemática e meta-análise incluíram nove estudos com 546 pacientes. Esta meta-análise é a primeira a detalhar as alterações na diversidade alfa após a erradicação da H. pylori. Os resultados não indicaram diferenças significativas na diversidade da microbiota entre as opções de tratamento, quer fosse utilizada terapia quádrupla ou tripla. Os autores observaram um aumento da diversidade alfa a curto prazo, que persistiu no seguimento a longo prazo, com uma depleção de taxa relacionados com a H. pylori e enriquecimento de comensais gástricos comuns 9. Para avaliar o efeito da erradicação da H. pylori no microbioma intestinal, Yap et al. realizaram um estudo com 17 jovens adultos. Sequenciaram a região V3-V4 do gene 16S rRNA e analisaram o microbioma intestinal antes e 18 meses após a erradicação da H. pylori utilizando claritromicina e metronidazol. Não foram observadas alterações significativas na diversidade microbiana entre a linha de base e 18 meses após a erradicação 10.
Os IBP são importantes modificadores do microbioma intestinal
O consumo global de inibidores da bomba de protões (IBP) está a aumentar, tornando-os um dos 10 medicamentos mais utilizados no mundo 11. São um tratamento de primeira linha para doenças como a doença do refluxo gastroesofágico, a úlcera péptica, a dispepsia e, quando combinados com antibióticos, para o tratamento da H. pylori 12. Os IBP são frequentemente utilizados sem indicações baseadas em provas ou por períodos mais longos do que o prescrito, e a sua utilização tem sido associada a um risco acrescido de infeções como Clostridium difficile, Salmonella spp.
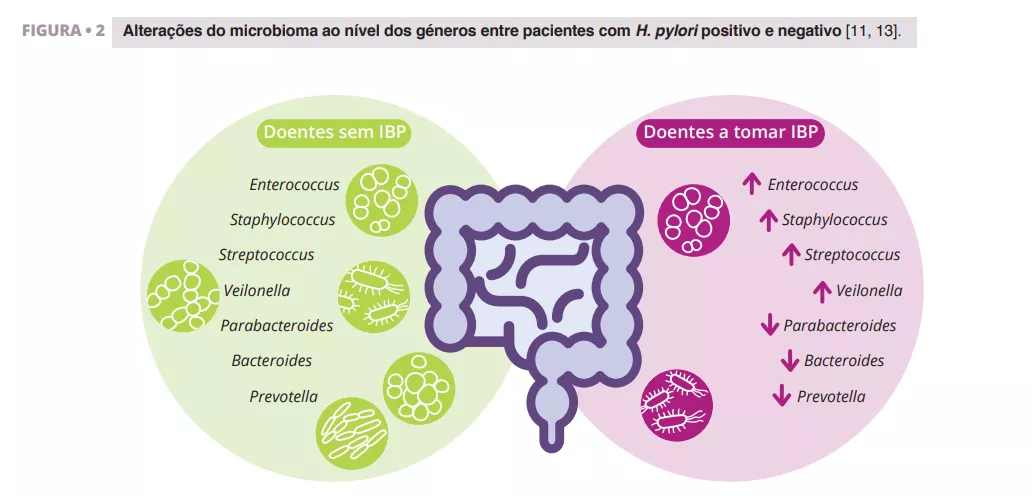
Imhann et al. analisaram o microbioma de 211 indivíduos que utilizavam IBP através da sequenciação da região V4 do gene 16S rRNA. Observaram uma diminuição significativa da diversidade alfa entre os utilizadores de IBP e um aumento da abundância de bactérias dos géneros Enterococcus, Streptococcus, Staphylococcus e Veillonella (figura 2). Os géneros Enterococcus e Veillonella têm sido associados a uma maior suscetibilidade a infeções por Clostridium difficile 11. . Embora os IBP sejam geralmente considerados seguros, com efeitos secundários relativamente raros, as provas sugerem que têm um impacto negativo no microbioma intestinal.
Zhang et al. efetuaram uma meta-análise dos efeitos dos IBP na microbiota intestinal humana, analisando dados de quatro estudos com sequenciação de amplicões do gene 16S rRNA. Os seus resultados demonstraram um impacto significativo da utilização de IBP na diversidade microbiana, com uma menor diversidade alfa observada nos utilizadores de IBP em comparação com os controlos. Encontraram reduções nos géneros Parabacteroides, Veillonella, Bacteroides e Prevotella, bem como nas famílias Ruminococcaceae e Lachnospiraceae (figura 2) 13.
Weitsman et al. realizaram um estudo com 177 indivíduos, combinando utilizadores de IBP 1:2 com controlos. Analisaram amostras de fezes e, pela primeira vez, microbiomas duodenais. Não foram encontradas diferenças significativas na diversidade alfa ou beta entre os utilizadores de IBP e os controlos. No entanto, ao nível das famílias, observaram uma maior abundância relativa de Campylobacteraceae (filo Proteobacteria) e uma menor abundância relativa de Clostridiaceae (filo Firmicutes) nos utilizadores de IBP. A análise das fezes revelou de forma semelhante uma redução em Clostridiaceae e um aumento em Streptococcaceae 14.
Em geral, estes estudos indicam que os IBP afetam o microbioma humano. O significado clínico destes resultados justifica uma investigação mais aprofundada em estudos futuros.

Conclusão
O estômago humano apresenta um ambiente hostil para os microrganismos vivos, e a investigação recente continua a explorar se a microbiota do estômago é persistente ou se reflete apenas microrganismos transitórios. Apesar da sua importância clínica, a H. pylori desempenha um papel notável na formação do microbioma do estômago. A erradicação da H. pylori parece ter apenas um impacto temporário e reversível na composição dos microbiomas gástrico e intestinal. Os inibidores da bomba de protões (IBP) estão entre os medicamentos mais frequentemente consumidos. Estudos científicos indicam que os IBP alteram a estrutura do microbioma intestinal; no entanto, o significado clínico destas alterações requer uma investigação mais aprofundada.

