Helicobacter pylori и желудочно-кишечная микробиота
Проф. Юозас Купчинскас (Juozas Kupcinskas)
Кафедра гастроэнтерологии и Институт исследований пищеварения, Литовский университет медицинских наук, Каунас, Литва
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Helicobacter pylori (H. pylori) поражает около 50% населения земного шара, это самая распространенная бактериальная инфекция в мире. Согласно данным ВОЗ, H. pylori является канцерогеном группы 1, способным вызывать предраковые состояния и рак желудка, включая аденокарциному. Несмотря на прежние представления об H. pylori как единственном обитателе желудка, современные методы исследования расширили понимание желудочного микробиома.
H. pylori играет ключевую роль в формировании микробной среды желудка. Тем не менее, активно исследуется и не-хеликобактерный микробиом желудка. H. pylori — основной модулятор микробиома желудка, но другие виды также могут участвовать в канцерогенезе. Также изучается влияние ингибиторов протонной помпы (ИПП) и эрадикации H. pylori на микробиом. В данном обзоре обобщены современные данные о микробиоме желудка, роли H. pylori в его формировании и влиянии эрадикации H. pylori и ингибиторов протонной помпы (ИПП) на микробиом человека.
H. pylori — главная бактерия, формирующая микробиом желудка
Микробиом желудка привлекает все боль-ше внимания, а факторы, определяющие его состав, вызывают растущий интерес. Vilchez-Vargas и соавт. исследовали микробный состав различных отделов же-лудочно-кишечного тракта (ЖКТ). В иссле-довании проанализировали биоптаты мик-робиома желудка слизистой оболочки 108 пар близнецов. Разнообразие микробиома оценили путем амплификации и секвени-рования областей V1-V2 гена 16S рРНК. Результаты подтвердили ключевую роль H. pylori в составе микробиоты желудка, согласуясь с предыдущими данными. 1
Hua и соавт. изучили влияние H. pylori на богатство и разнообразие микробиоты же-лудка у 193 пациентов с хроническим гаст-ритом. Анализ V3-V4 области гена 16S рРНК выявил значительные изменения в микробиоте желудка, вызванные инфек-цией H. pylori. В частности, H. pylori подавляла доминирующую микробиоту желудка на уровне рода, включая Aliidio-marina, Reyranella, Halomonas, Pseudomo-nas и Acidovorax. Результаты показали сильную связь между вирулентными штам-мами H. pylori, хроническим атрофическим гастритом и снижением разнообразия микробиоты желудка. 2
Schulz и соавт. проанализировали различия в микробиоте у пациентов с и без H. pylori. Относительная численность Proteobacteria была значимо выше в аспиратах пациентов, инфицированных H. pylori. Другие типы имели меньшую относительную численность (рисунок 1). 3
Miftahussurur и соавт. изучили различия в микробиоте желудка между H. pylori-положительными и H. pylori-отрицательными пациентами в индонезийской когорте из 137 человек. Микробное β-разнообразие и богатство были значимо выше в H. pylori-положительных образцах, чем в H. pylori-отрицательных. Результаты также показали ведущую роль H. pylori в формировании микробного сообщества желудка у данной этнической группы. 4
В совокупности эти исследования подчеркивают ключевую роль H. pylori в формировании разнообразия и богатства микробиома желудка, несмотря на его агрессивную среду.
Каков собственный микробиом желудка?
В желудке крайне неблагоприятная среда для микроорганизмов. Несколько десяти-летий назад было установлено, что H. pylori — бактерия, способная выживать в этой агрессивной среде. Это открытие вызвало интерес и стиму-лировало дальнейшее изучение микро-биома желудка. Неясно, являются ли не-Helicobacter бактерии желудка транзитор-ными контаминантами или частью рези-дентной микробиоты. Spiegelhauer и со-авт. исследовали 22 пациентов с диспеп-сией и 12 пациентов с аденокарциномой желудка. 5
Их биоптаты слизистой же-лудка были исследованы путем культиви-рования микроорганизмов и анализа V3-V4 области гена 16S рРНК. Авторы пред-положили, что H. pylori, как истинный ре-зидент желудка, сохранится в промытых биоптатах. Результаты показали снижение бактериальной нагрузки в промытых биоп-татах, что указывает на транзиторное заг-рязнение из ротовой полости. Однако, раз-нообразие микроорганизмов не отлича-лось между промытыми и непромытыми биоптатами.
Неясно, являются ли микроорганизмы, отличные от H. pylori, в желудке транзиторными или постоянными обитателями.
Вероятно, слюна с микроорганизмами спо-собна некоторое время выживать в кислой среде желудка. При гастроскопии и взятии проб следует учитывать контаминацию из ротоглотки 6. Эти результаты указывают на необходимость дальнейших исследо-ваний собственного микробиома желудка.
Влияние эрадикации H. pylori на микробиом желудка и кишечника
H. pylori — одна из наиболее распростра-ненных инфекций в мире, поражающая более половины населения. Большинство схем лечения H. pylori, включающих два и более антибиотика, могут негативно вли-ять на микробиом желудочно-кишечного тракта. Liou и соавт. исследовали долго-срочные изменения кишечной микробиоты после эрадикации H. pylori. Их много-центровое рандомизированное исследова-ние включало 1620 участников, случайным образом распределенных по трем группам лечения. Бактериальное разнообразие оценивали в динамике после эрадикации по анализу образцов кала. Результаты показали сни-жение альфа- и бета-разнообразия в те-чение двух недель после эрадикации, с последующим возвратом к исходному уровню к 8-й неделе и через год. Эти данные свидетельствуют о кратковремен-ных нарушениях микробиома желудочно-кишечного тракта после эрадикации H. pylori и предполагают ее общую безо-пасность в долгосрочной перспективе. 7
Не и соавт. изучили изменения микро-биома желудочно-кишечного тракта после эрадикации H. pylori, проанализировав ген 16S рРНК в образцах слизистой желудка и кала. После эрадикации, через 24 недели, альфа-разнообразие микробиома желудка увеличилось, а бета-разнообразие кишеч-ного микробиома значимо изменилось, приближаясь к показателям здоровых контрольных субъектов. 8
Guo и соавт. обобщили данные об изме-нениях микробиома желудка после эради-кации H. pylori. Их систематический обзор и метаанализ включал девять исследова-ний с участием 546 пациентов. Этот мета-анализ впервые детально описывает из-менения альфа-разнообразия после эра-дикации H. pylori. Результаты не выявили значимых различий в разнообразии микро-биоты между четырех- и трехкомпонен-тной терапией. Авторы выявили увели-чение альфа-разнообразия, сохраняюще-еся в долгосрочной перспективе, с умень-шением таксонов, связанных с H. pylori, и увеличением комменсалов желудка 9. Для оценки влияния эрадикации H. pylori на кишечный микробиом, Yap и соавт. про-вели исследование на 17 молодых людях. Они секвенировали область V3-V4 гена 16S рРНК и проанализировали ки-шечный микробиом до и через 18 месяцев после эрадикации H. pylori с использо-ванием кларитромицина и метронидазола. Микробное разнообразие существенно не изменилось за 18 месяцев после эради-кации по сравнению с исходным уровнеm10.
ИПП — основные модификаторы кишечного микробиома
Глобальное потребление ингибиторов протонной помпы (ИПП) растет, выводя их в число 10 самых назначаемых лекарст-венных препаратов в мире 11. Это пре-параты первой линии при гастроэзофаге-альной рефлюксной болезни, язвенной бо-лезни, диспепсии и, в сочетании с антиби-отиками, для эрадикации H. pylori 12. Необоснованное или длительное при-менение ИПП связано с повышенным рис-ком кишечных инфекций, включая Clostridium difficile, Salmonella spp., Shigella spp., Campylobacter spp. и другие кишечные патогены 11.
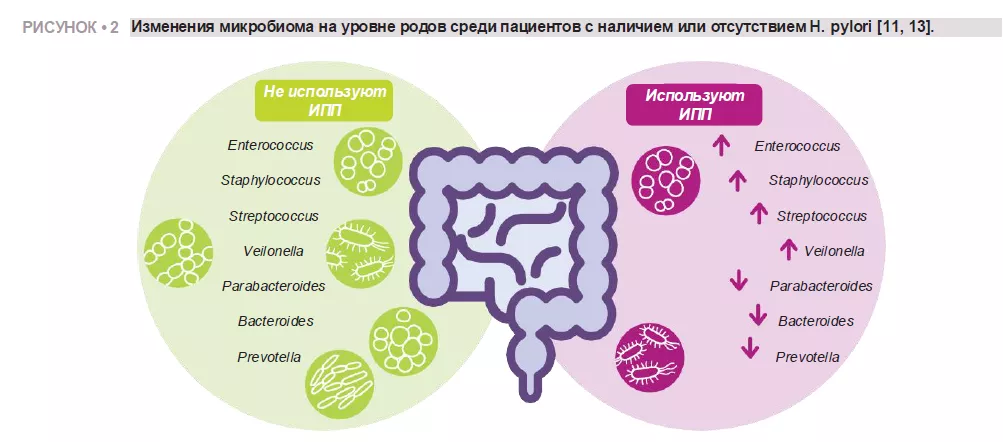
Imhann и соавт. проанализировали мик-робиом 211 пациентов, принимающих ИПП, секвенируя V4-область гена 16S рРНК. Применение ИПП было связано со значимым снижением альфа-разнообра-зия и увеличением численности бактерий родов Enterococcus, Streptococcus, Staphy-lococcus и Veillonella. (рисунок 2). Роды Enterococcus и Veillonella были связаны с повышенной восприимчивостью к инфек-циям Clostridium difficile 11. Несмотря на общепризнанную безопасность ИПП и редкие побочные эффекты, данные указы-вают на их негативное воздействие на ки-шечный микробиом.
Zhang и соавт. провели метаанализ вли-яния ИПП на кишечную микробиоту чело-века, проанализировав данные четырех исследований с секвенированием ампли-конов гена 16S рРНК. Их результаты продемонстрировали зна-чимое влияние использования ИПП на микробное разнообразие, при этом у пользователей ИПП наблюдалось более низкое альфа-разнообразие по сравнению с контрольной группой. Они обнаружили снижение численности родов Parabacteroides, Veillonella, Bacteroides и Prevotella, а также семейств Ruminococcaceae и Lachnospiraceae (рисунок 2) 13.
В исследовании Weitsman и соавт. 177 участников были разделены на группу пользователей ИПП и контрольную группу в соотношении 1:2. Они проанализи-ровали образцы стула и, впервые, мик-робиом двенадцатиперстной кишки. Зна-чимых различий в альфа- или бета-разнообразии между пользователями ИПП и контрольной группой обнаружено не было. Тем не менее, у принимающих ИПП наблюдалось увеличение относительной численности Campylobacteraceae (филум Proteobacteria) и снижение Clostridiaceae (филум Firmicutes) на уровне семейства. Анализ стула также выявил снижение Clostridiaceae и увеличение Streptococcaceae14.
В целом, эти исследования показывают, что ИПП влияют на микробиом человека. Клиническая значимость этих результатов требует дальнейшего изучения в будущих исследованиях.

Заключение
Желудок — агрессивная среда для микроорганизмов, продолжающиеся исследования изучают, является ли его микробиота постоянной или транзиторной. Несмотря на клиническую значимость, H. pylori играет заметную роль в формировании микробиома желудка. Эрадикация H. pylori оказывает временное и обратимое влияние на микробиом желудка и кишечника. Ингибиторы протонной помпы (ИПП) — одни из самых часто используемых лекарственных средств. Научные исследования показывают, что ИПП изменяют структуру кишечного микробиома; однако клиническая значимость этих изменений требует дальнейшего изучения.

