Plausibilidade de um papel fisiopatológico para a microbiota intestinal alt erada na doença inflamatória intestinal
Síntese
Pelo Pr. Jan Tack
TARGID, Universidade de Leuven Divisão de Gastroenterologia e Hepatologia, Hospitais Universitários de Leuven, Bélgica
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Sobre este artigo
Autor
52% Apenas 1 em cada 2 pessoas que sofreram de uma patologia digestiva envolvendo a microbiota, associa os dois
A doença inflamatória intestinal (DII) é um distúrbio intestinal funcional comum caracterizado por dor abdominal, que está associada a alterações na frequência e/ou consistência das fezes. Embora ainda não estabelecidos, a patogénese e uma multitude de mecanismos fisiopatológicos putativos foram propostos, incluindo: motilidade desordenada, hipersensibilidade visceral, inflamação de baixo grau, microbiota alterada, ativação imunitária, reações adversas a alimentos e disfunção do sistema nervoso central, etc. Em 2017, foram publicados 5 critérios putativos para mecanismos em distúrbios gastrointestinais funcionais em Gut. Aqui discutimos em que medida a microbiota intestinal alterada cumpre estes critérios de plausibilidade no contexto da DII e revemos a literatura disponível sobre o assunto.
Introdução
O distúrbio intestinal funcional mais comum, a doença inflamatória intestinal (DII), caracteriza- se por dor ou desconforto abdominal e está associado a alterações na frequência e/ou consistência das fezes, sem anomalias estruturais ou bioquímicas identificáveis que indiquem doença orgânica durante os exames complementares de diagnóstico de rotina [1, 2]. Para além da dor abdominal, os pacientes relatam também outros sintomas gastrointestinais como inchaço, distensão abdominal e flatulência. A DII pode ser dividida em diferentes subtipos, com base na consistência mais dominante das fezes: DII-C (obstipação predominante), DII-D (diarreia predominante), e DII-M (DII com hábitos intestinais mistos). Em termos de fisiopatologia, a DII é considerada um distúrbio heterogéneo e têm sido envolvidos diferentes mecanismos, incluindo dismotilidade gastrointestinal, hipersensibilidade visceral, disfunção do eixo cérebro-intestino e, mais recentemente, alterações na composição e manipulação do sal biliar, inflamação de baixo grau, ativação imunitária da mucosa e microbiota intestinal alterada [3].
A última década assistiu a um grande aumento do interesse pelo papel da microbiota intestinal na DII. A comunidade microbiana do intestino exerce uma série de funções, incluindo o metabolismo dos polissacáridos indigestíveis, a absorção de determinados nutrientes e iões, a absorção e deposição de lípidos alimentares, a regulação do metabolismo dos ácidos biliares e a produção de vitaminas como o folato, biotina e vitamina K [3, 4]. Ao competir com agentes patogénicos microbianos, reforça a proteção da barreira gastrointestinal. Ao interagir intensamente com a mucosa, a microbiota intestinal também afeta o sistema imunitário e a sinalização do intestino- cérebro do hospedeiro [5]. Estas diversas propriedades identificam a microbiota intestinal como um potencial contribuinte importante para a fisiopatologia e como um alvo apelativo para a terapia na DII.
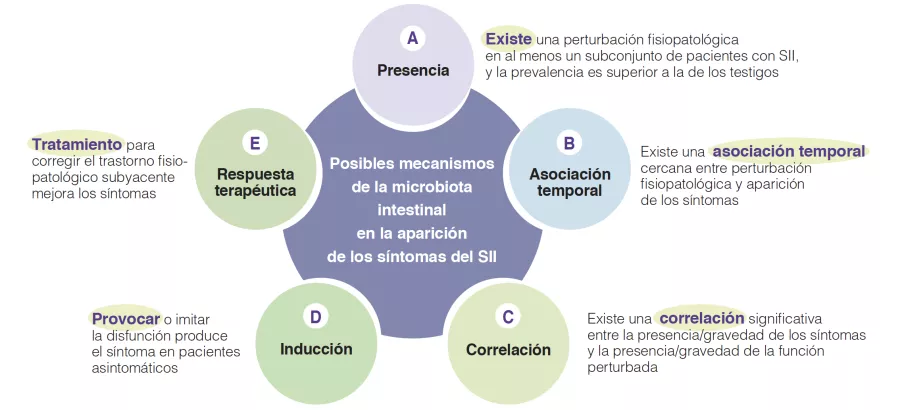
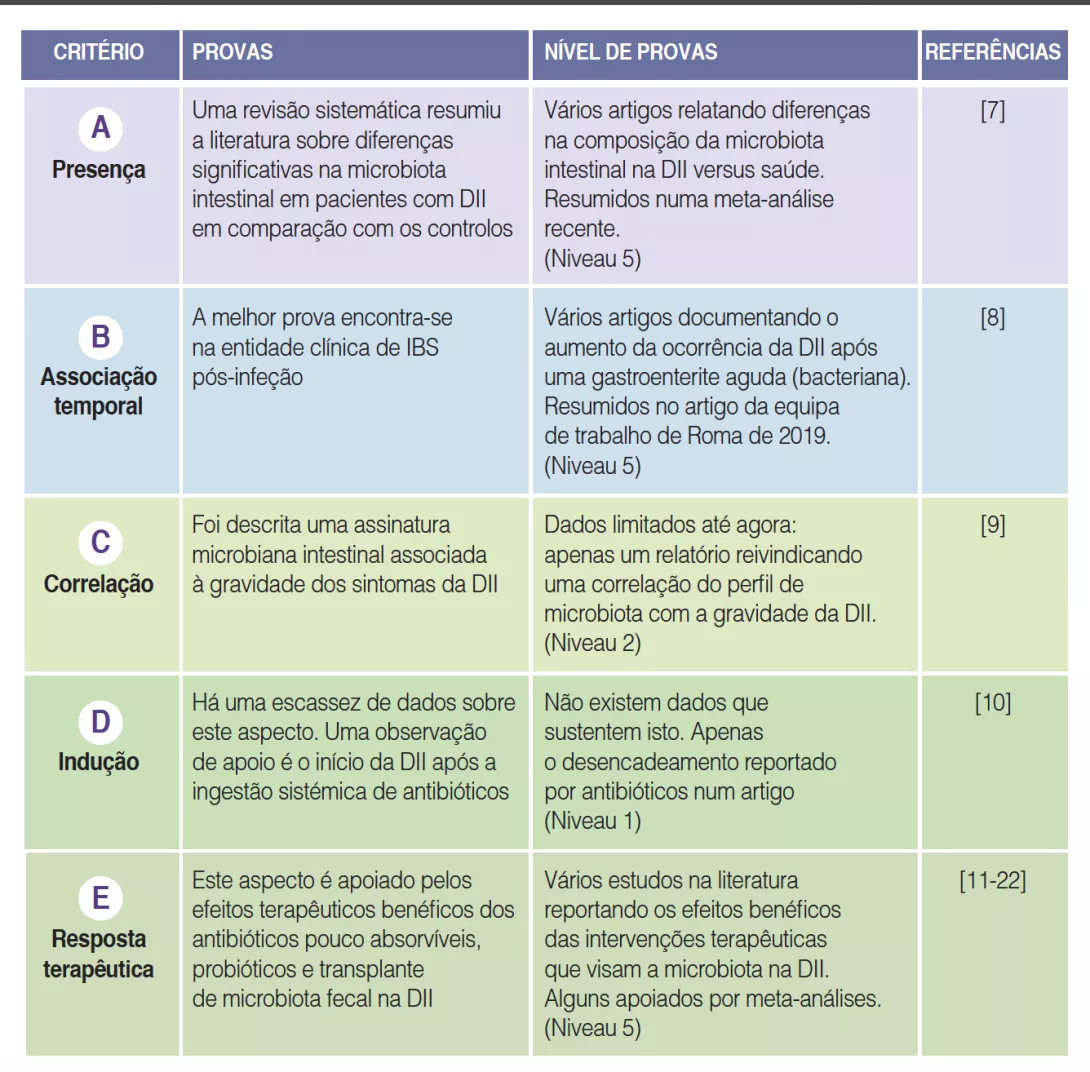
De facto, múltiplos mecanismos associados ao ecossistema microbiano intestinal foram identificados em estudos fisiopatológicos da DII. Estes levaram a argumentos e observações variáveis para apoiar a relevância destes mecanismos candidatos individuais. Para avançar no terreno é necessário identificar o nível de relevância de tais putativos processos fisiopatológicos, uma vez que tal aumentaria o conhecimento e poderia dar prioridade ao alvo para a inovação ou otimização terapêutica. Há alguns anos, um grupo de peritos internacionais desenvolveu cinco critérios de plausibilidade para mecanismos em distúrbios gastrointestinais funcionais, tais como a DII [6]. Estes baseiam-se em aspetos tais como presença, associação temporal, correlação entre nível de deficiência e gravidade dos sintomas, indução em indivíduos saudáveis e resposta ao tratamento (ou história natural congruente se não for possível qualquer tratamento) (Figura 1). As secções seguintes avaliarão a hipótese putativa que envolve uma mudança na microbiota intestinal como mecanismo na geração e apresentação dos sintomas da DII (Caixa). O conhecimento atual sobre a microbiota intestinal na DII é resumido e são identificadas áreas para investigação adicional.
Figura 1
Critérios de plausibilidade dos mecanismos fisiopatológicos nos distúrbios da DII baseados numa publicação consensual [6], como pode ser aplicado para o papel dos mecanismos microbianos intestinais na patogénese dos sintomas da DII.
Plausibilidade de um papel fisiopatológico para a microbiota intestinal na DII
Presença de microbiota intestinal alterada na DII (A)
O primeiro critério de plausibilidade é que as alterações na microbiota intestinal são encontradas em pelo menos um subconjunto de pacientes com DII [6]. Vários estudos têm investigado a presença e o tipo de alterações da microbiota intestinal na DII em comparação com os controlos saudáveis. Pittayanon e colegas publicaram em 2019 uma revisão sistemática de 24 estudos de 22 publicações comparando a microbiota intestinal de pacientes com DII (principalmente adultos) com a microbiota de indivíduos saudáveis [7]. Concluíram que a família Enterobacteriaceae, a família Lactobacillaceae e o género Bacteroides aumentaram, ao passo que Clostridiales I, o género Faecalibacterium e o género Bifidobacterium diminuíram em pacientes com DII em comparação com os controlos [7]. Embora estas observações justifiquem a alteração da microbiota na DII, existe uma grande heterogeneidade nos resultados entre os diferentes estudos, o tamanho das amostras é geralmente pequeno e a maioria dos estudos ocorreu em cuidados especializados. Além disso, muitos estudos não corrigiram estatísticas para testes múltiplos e não consideraram fatores dietéticos e uso prévio pró- ou antibiótico. Além disso, não foram encontradas diferenças consistentes entre os subtipos de fezes da DII [7]. A proporção de pacientes com DII em que se pode identificar uma composição alterada de microbiota intestinal permanece pouco clara.
Associa ção temporal, de microbiota intestinal alterada com sintomas da DII (B)
A melhor prova para uma associação temporal entre alterações nos sintomas da microbiota intestinal e da DII pode ser derivada da entidade clínica de (PI-)DII pós-infeção [8]. Aproximadamente 10% dos pacientes com enterite infeciosa desenvolvem PI-DII com sexo feminino, idade mais jovem, sofrimento psicológico na altura da gastroenterite, e gravidade da infeção aguda como fatores de risco. O desenvolvimento de PI-DII está associado a alterações no microbioma intestinal, bem como a alterações da mucosa (inflamação de baixo grau, hiperplasia de células entero- endócrinas) [8]. Contudo, as alterações da microbiota na PI-DII parecem ser diferentes das descritas nos pacientes com DII em geral.
Correlação entre o nível de alteração da microbiota intestinal e a gravidade dos sintomas da DII (C)
Muito poucos estudos tentaram correlacionar a gravidade dos sintomas da DII com o grau de mudança na composição da microbiota intestinal, também referida como «disbiose». A maioria deles não conseguiu identificar correlações significativas entre as diferenças na abundância ou composição da microbiota fecal e a gravidade dos sintomas da DII [7, 9]. Num grande conjunto de dados de pacientes com DII, o grupo de Gothenburg utilizou a aprendizagem automática para identificar uma assinatura microbiana intestinal capaz de prever a gravidade dos sintomas da DII [9], sugerindo uma relação quantitativa entre as alterações da microbiota intestinal e a gravidade da DII. Contudo, é necessária a confirmação de outros estudos, e talvez estes devam incluir amostras de pacientes que não sejam de cuidados terciários, onde a variação da gravidade dos sintomas pode ser maior.
Indução de sintomas da DII em indivíduos saudáveis através de alterações na microbiota intestinal (D)
O quarto critério de plausibilidade, tal como descrito no manuscrito inicial [6], é um dos mais difíceis de cumprir. Existem muito poucos dados adequados para os diferentes mecanismos fisiopatológicos candidatos, e isto também se aplica às alterações da microbiota intestinal como mecanismo. A observação mais favorável deriva provavelmente do desenvolvimento da DII após o tratamento de uma infeção não gastrointestinal com antibióticos sistémicos [10]. A natureza da perturbação da microbiota intestinal após os antibióticos e o grau de semelhança com a microbiota intestinal na DII ainda são desconhecidos.
Resposta ao tratamento que visa a composição da microbiota intestinal (E)
Esta secção é a mais estudada quando se consideram critérios de plausibilidade para a composição alterada da microbiota intestinal como um mecanismo fisiopatológico na DII . Uma linha de prova é o efeito terapêutico benéfico dos antibióticos pouco absorvíveis, visando claramente a microbiota intestinal [11, 12]. Dois estudos com neomicina e cinco ensaios com rifaximina mostraram a eficácia destes de largo espectro pouco absorvíveis em pacientes com DII não-contaminados [11-14]. Além disso, um ensaio que avaliou a segurança e eficácia da repetição do tratamento com rifaximina confirmou também a viabilidade desta terapia na recidiva dos sintomas [15].
Os probióticos são definidos como preparações com microrganismos vivos que conferem um benefício para a saúde do hospedeiro quando administrados em quantidades adequadas. Várias meta-análises confirmaram a eficácia dos probióticos, como grupo, para melhorar os sintomas da DII [11, 16]. Contudo, a heterogeneidade dos desenhos e dos pontos finais dos estudos, e a relativa escassez de estudos com tipos probióticos específicos impedem que se chegue a uma conclusão forte ao nível das preparações individuais. Em contraste, os prebióticos, substratos que são seletivamente utilizados pelos microrganismos hospedeiros conferindo um benefício para a saúde do hospedeiro, não mostraram eficácia na melhoria dos sintomas da DII com base em meta-análises recentes [11, 17].
O transplante da microbiota fecal é provavelmente a forma mais direta de visar a microbiota intestinal para o controlo dos sintomas na DII [18]. Os estudos realizados até à data produziram resultados altamente variáveis, desde nenhum efeito até ao benefício sintomático, mas também agravamento dos sintomas, gerando conclusões contraditórias nas meta-análises [19, 20]. Contudo, estudos recentes mostraram alterações induzidas pelo FMT na composição da microbiota intestinal associadas ao benefício sintomático (transitório) e envolveram a seleção de dadores como uma questão crítica [21, 22].
TABELA 1
Caixa de destaque: Resumo do cumprimento dos critérios de plausibilidade para a microbiota intestinal alterada na DII.
Questões não resolvidas e estudos futuros
No seu conjunto, as alterações na composição da microbiota intestinal parecem preencher os critérios de plausibilidade para a relevância fisiopatológica na doença inflamatória intestinal [6]. Os resultados estão resumidos na Figura 2. No entanto, há uma clara necessidade de conhecimento e investigação adicionais. São necessários mais estudos quantitativos e melhor controlados que caracterizem a microbiota intestinal na DII e controlos, e estes devem de preferência incluir grandes coortes de pacientes também dos cuidados primários. Isto permitirá uma melhor compreensão das mudanças na microbiota intestinal na DII a todos os níveis de cuidados, e tem o potencial de confirmar uma correlação entre a magnitude das mudanças na composição da microbiota intestinal e a gravidade dos sintomas da DII. Além disso, serão necessários estudos longitudinais na DII para estabelecer ainda mais a relação temporal entre as alterações da microbiota intestinal e o padrão e gravidade dos sintomas ao longo do tempo, dentro ou fora do quadro de um ensaio de tratamento.
Existe uma necessidade contínua de ensaios probióticos de maior qualidade na DII, utilizando durações de tratamento adequadas e parâmetros validados, semelhantes aos dos agentes farmacológicos. Por último, são esperados muitos novos dados sobre a utilização de FMT na DII, com potencial para clarificar as melhores modalidades e a eficácia desta opção de tratamento.
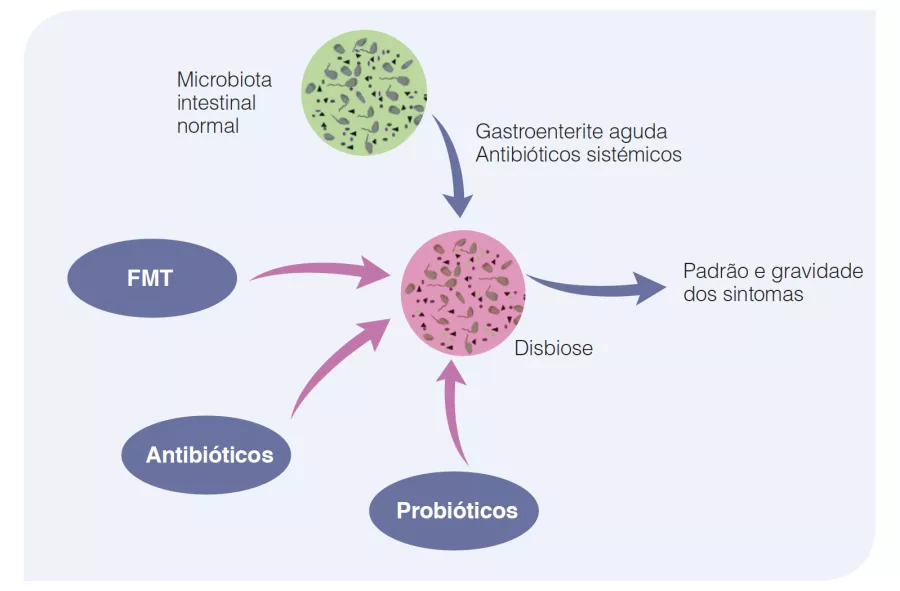
Figure 2
Relevância fisiopatológica das alterações na microbiota intestinal na doença inflamatória intestinal.
La composición normal de la microbiota intestinal refleja el estado de salud, sin síntomas de SII. Los acontecimientos agudos, como una gastroenteritis aguda o la ingesta de antibióticos sistémicos pueden alterar la composición de la microbiota intestinal, dando lugar a los síntomas del SII. síntomas del SII. Esto puede corregirse terapéuticamente mediante el uso de antibióticos no absorbibles, probióticos o transferencia de microbiota fecal. Traducción realizada con la versión gratuita del traductor www.DeepL.com/Translator.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016; 150: 1393-407.e5.
2 Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroenterology 2006; 130:1480-91.
3 Bonfrate L, Tack J, Grattagliano I, et al. Microbiota in health and irritable bowel syndrome: current knowledge, perspectives and therapeutic options. Scand J Gastroenterol 2013; 48: 995-1009.
4 Bajaj JS, Barbara G, DuPont HL, et al. New concepts on intestinal microbiota and the role of the non-absorbable antibiotics with special reference to rifaximin in digestive diseases. Dig Liver Dis 2018; 50: 741-9.
5 Margolis KG, Cryan JF, Mayer EA. The microbiota-gut-brain axis: from motility to mood. Gastroenterology 2021; 160: 1486-501.
6 Tack J, Corsetti M, Camilleri M, et al. Plausibility criteria for putative pathophysiological mechanisms in functional gastrointestinal disorders: a consensus of experts. Gut 2018; 67: 1425-33.
7 Pittayanon R, Lau JT, Yuan Y, et al. Microbiota in patients with irritable bowel syndrome-a systematic review. Gastroenterology 2019; 157: 97-108.
8 Barbara G, Grover M, Bercik P, et al. Rome Foundation Working Team Report on post-infection irritable bowel syndrome. Gastroenterology 2019; 156:46-58.e7.
9 Tap J, Derrien M, Törnblom H, et al. Identification of an intestinal microbiota signature associated with severity of irritable bowel syndrome. Gastroenterology 2017; 152: 111-123 e8.
10 Paula H, Grover M, Halder SL, et al. Non-enteric infections, antibiotic use, and risk of development of functional gastrointestinal disorders. Neurogastroenterol Motil 2015; 27: 1580-6.
11 Ford AC, Harris LA, Lacy BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
12 Fodor AA, Pimentel M, Chey WD, et al. Rifaximin is associated with modest, transient decreases in multiple taxa in the gut microbiota of patients with diarrhoea-predominant irritable bowel syndrome. Gut Microbes 2019;10: 22-33.
13 Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol 2000; 95: 3503-6.
14 Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. a double-blind, randomized, placebo-controlled study. Am J Gastroenterol 2003; 98, 412-9.
15 Lembo A, Pimentel M, Rao SS, et al. Repeat treatment with rifaximin is safe and effective in patients with diarrhea-predominant irritable bowel syndrome. Gastroenterology 2016; 151: 1113-21.
16 Li B, Liang L, Deng H, et al. Efficacy and safety of probiotics in irritable bowel syndrome: a systematic review and meta-analysis. Front Pharmacol 2020; 11: 332.
17 Wilson B, Rossi M, Dimidi E, et al. Prebiotics in irritable bowel syndrome and other functional bowel disorders in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2019; 109: 1098-111.
18 Goll R, Johnsen PH, Hjerde E, Diab J, Valle PC, Hilpusch F, Cavanagh JP. Effects of fecal microbiota transplantation in subjects with irritable bowel syndrome are mirrored by changes in gut microbiome. Gut Microbes 2020; 12: 1794263.
19 Myneedu K, Deoker A, Schmulson MJ, Bashashati M. Fecal microbiota transplantation in irritable bowel syndrome: A systematic review and meta-analysis. United European Gastroenterol J 2019; 7: 1033-41.
20 Ianiro G, Eusebi LH, Black CJ, Gasbarrini A, Cammarota G, Ford AC. Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2019; 50: 240-8.
21 El-Salhy M, Hatlebakk JG, Gilja OH, et al. Efficacy of faecal microbiota transplantation for patients with irritable bowel syndrome in a randomised, double-blind, placebo-controlled study. Gut 2020; 69: 859-67.
22 Holvoet T, Joossens M, Vázquez-Castellanos JF, et al. Fecal Microbiota transplantation reduces symptoms in some patients with irritable bowel syndrome with predominant abdominal bloating: short- and long-term results from a placebo-controlled randomized trial. Gastroenterology 2021; 160: 145-57.e8.