Plausibilité d'un rôle physiopathologique du microbiote intestinal altéré dans le Syndrome de l'Intestin Irritable
Synthèse
Par le Pr. Jan Tack
Université de Louvain, TARGID, Service de gastro-entérologie et d’hépatologie, Hôpitaux universitaires de Louvain, Belgique
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
52% Seule 1 personne sur 2 ayant souffert d’une pathologie digestive impliquant le microbiote fait le lien
Le syndrome de l’intestin irritable (SII) est une affection intestinale fonctionnelle fréquente caractérisée par une douleur abdominale, qui est associée à des modifications de la fréquence et/ou de l a consistance des selles. Bien qu’elle ne soit pas encore établie, la pathogenèse et une multitude de mécanismes physiopathologiques supposés ont été proposées, notamment : motilité perturbée, hypersensibilité viscérale, inflammation de bas grade, microbiote altéré, activation immunitaire, réactions indésirables aux aliments et dysfonction du système nerveux central, etc. En 2017, 5 critères supposés pour les mécanismes responsables des affections gastro-intestinales fonctionnelles ont été publiés dans Gut. Nous discutons ici de la mesure dans laquelle le microbiote intestinal altéré remplit ces critères de plausibilité dans le contexte du SII et nous passons en revue la littérature disponible sur le sujet.
INTRODUCTION
L’affection intestinale fonctionnelle la plus fréquente, le syndrome de l’intestin irritable (SII), est caractérisée par une douleur ou une gêne abdominale et elle est associée à des modifications de la fréquence et/ou de la consistance des selles, sans anomalies structurelles ou biochimiques identifiables indiquant une maladie organique lors des examens de routine [1, 2]. Mis à part la douleur abdominale, les patients indiquent également d’autres symptômes gastro-intestinaux comme des ballonnements, une distension abdominale et une flatulence. Le SII peut être divisé en différents soustypes, sur la base de la consistance dominante des selles : SII -C (constipation prédominante), SII-D (diarrhée prédominante) et SII-M (mixte avec alternance de diarrhée et de constipation). Du point de vue physiopathologique, le SII est considéré comme une affection hétérogène et différents mécanismes ont été impliqués, notamment une dysmotilité gastro-intestinale, une hypersensibilité viscérale, une dysfonction de l’axe cerveau-intestin et, plus récemment, des modifications de la composition et de la gestion des sels biliaires, une inflammation de bas grade, une activation immunitaire de la muqueuse et une altération du microbiote intestinal [3].
Au cours de la dernière décennie, l’intérêt pour le rôle du microbiote intestinal dans le SII a connu une hausse majeure. La communauté microbienne de l’intestin accomplit un certain nombre de fonctions, intervenant notamment dans le métabolisme des polysaccharides non digestibles, l’absorption de certains nutriments et ions, la capture et le dépôt des lipides alimentaires, la régulation du métabolisme de l’acide biliaire et la production de vitamines tels que les folates, la biotine et la vitamine K [3, 4]. En compétition avec les agents pathogènes microbiens, elle renforce la protection de la barrière gastro-intestinale. Tout en interagissant intensément avec la muqueuse, le microbiote intestinal affecte également le système immunitaire et la signalisation intestin-cerveau de l’hôte [5]. Ces propriétés variées identifient le microbiote intestinal comme un facteur contributif majeur potentiel à la physiopathologie et comme une cible intéressante pour le traitement du SII.
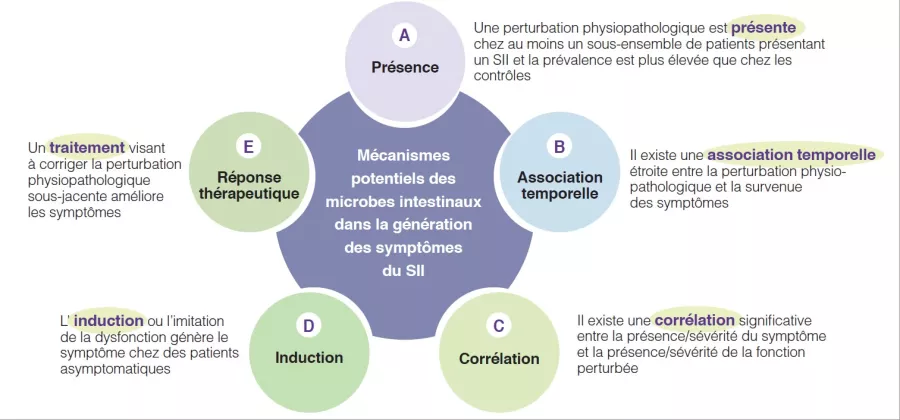
En effet, de nombreux mécanismes associés à l’écosystème microbien intestinal ont été identifiés dans les études sur la physiopathologie du SII. Ils ont conduit à des arguments et des observations variables pour soutenir la pertinence de ces candidats mécanismes individuels. Afin de progresser dans ce secteur, il est nécessaire d’identifier le niveau de pertinence de ces processus physiopathologiques supposés, car cela améliorerait les connaissances et pourrait permettre d’établir la priorité des cibles pour l’innovation ou l’optimisation thérapeutique. Il y a quelques années, un groupe d’experts internationaux a développé cinq critères de plausibilité pour les mécanismes dans les affections gastro-intestinales fonctionnelles comme le SSI [6]. Ils reposent sur des aspects tels que la présence, l’association temporelle, la corrélation entre le niveau d’altération et la sévérité des symptômes, l’induction chez les sujets sains et la réponse au traitement (ou antécédents naturels congruents, si aucun traitement n’est possible) (Figure 1). Les sections qui suivent évalueront l’hypothèse avancée impliquant une modification du microbiote intestinal en tant que mécanisme dans la génération et la présentation des symptômes de SSI (Tableau 1). Les connaissances actuelles concernant le microbiote intestinal dans le SII sont résumées et des domaines de recherche pour l’avenir sont identifiés.
Figure 1
Critères de plausibilité pour les mécanismes physiopathologiques dans les troubles associés au SSI sur la base d’une publication consensus [6], pouvant être appliqués pour le rôle des mécanismes microbiens intestinaux dans la pathogenèse des symptômes du SII.
Plausibilité d'un rôle physiopathologique du microbiote intestinal dans le SII
Présence d'un microbiote intestinal altéré dans le SII (A)
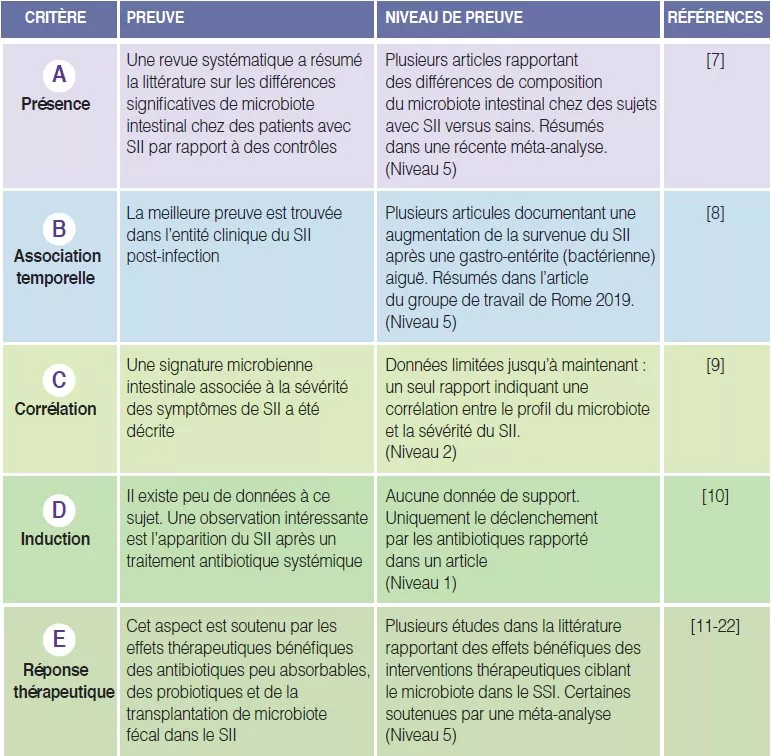
Le premier critère de plausibilité est que des modifications du microbiote intestinal sont trouvées dans au moins un sous-ensemble de patients présentant un SII [6]. Plusieurs études ont évalué la présence et le type des altérations du microbiote intestinal dans le SII par rapport à des contrôles sains. Pittayanon et ses collègues ont publié en 2019 une revue systématique de 24 études tirées de 22 publications comparant le microbiote intestinal de patients avec SII (principalement adultes) avec le microbiote d’individus sains [7]. Ils ont conclu que la famille Enterobacteriaceae, la famille Lactobacillaceae et le genre Bacteroides teroides étaient augmentés, tandis que Clostridiales I, le genre Faecalibacterium et le genre Bifidobacterium étaient diminués chez les patients avec SII par rapport aux contrôles [7]. Si ces observations plaident en faveur d’un microbiote altéré dans le SII, les observations présentent une hétérogénéité majeure entre les différentes études, les tailles d’échantillon sont généralement petites et la plupart des études ont eu lieu dans des services de soins spécialisés. En outre, dans un grand nombre d’études, les statistiques ne comportaient pas de correction pour les multiples et ne tenaient pas compte des facteurs alimentaires et de la précédente utilisation de probiotiques ou d’antibiotiques. En outre, il n’a pas été observé de différences constantes entre les sous-types de selles dans le SII [7]. La proportion de patients atteints de SSI chez qui une composition altérée du microbiote intestinal peut être identifiée n’est pas claire.
Association temporelle du microbiote intestinal altéré avec les symptômes de SSI (B)
La meilleure preuve d’une association temporelle entre les modifications du microbiote intestinal et les symptômes de SSI peut être dérivée de l’entité clinique de SII post-infection (PI) [8]. Environ 10 % of des patients présentant une entérite infectieuse développent un SSI-PI, avec pour facteurs de risque le sexe féminin, un jeune âge, une détresse psychologique au moment de la gastro-entérite et la sévérité de l’infection aiguë. Le développement d’un SII-PI est associé à des modifications du microbiome intestinal, ainsi qu’à des altérations de la muqueuse (inflammation de bas grade, hyperplasie cellulaire entéro-endocrine) [8]. Toutefois, les modifications du microbiote dans le SII-PI semblent différer de celles décrites chez les patients présentant un SII en général.
Corrélation entre le niveau de modification du microbiote intestinal et la sévérité des symptômes de SSI (C)
Très peu d’études ont essayé de corréler la sévérité des symptômes de SSI avec le degré de modification de la composition du microbiote intestinal, également désignée par « dysbiose ». La plupart d’entre elles n’ont pas réussi à identifier de corrélations significatives entre les différences d’abondance ou de composition du microbiote fécal et la sévérité des symptômes de SSI [7, 9]. Dans un large ensemble de données de patients présentant un SSI, le groupe Gothenburg a utilisé l’apprentissage machine pour identifier une signature microbienne intestinale capable de prédire la sévérité des symptômes de SSI [9], suggérant une relation quantitative entre les altérations du microbiote intestinal et la sévérité du SSI. Toutefois, une confirmation est nécessaire à travers d’autres études, qui devraient peut-être inclure des échantillons de patients de soins non tertiaires, où la variation de la sévérité des symptômes pourrait être supérieure.
Induction de symptômes de SII chez des sujets sains à travers des modifications du microbiote intestinal (D)
Le quatrième critère de plausibilité, tel que décrit dans le manuscrit initial [6], est l’un des plus difficiles à remplir. Il existe très peu de données adaptées pour les différents candidats mécanismes physiopathologiques, et cela s’applique également aux altérations du microbiote intestinal en tant que mécanisme. L’observation soutenant le plus ce critère est probablement dérivée du développement du SSI après traitement d’une infection non gastro-intestinale par des antibiotiques systémiques [10]. La nature de la perturbation du microbiote intestinal après l’administration d’antibiotiques, et le degré de similarité avec le microbiote intestinal dans le SSI, sont toujours inconnus.
Réponse au traitement ciblant la composition du microbiote intestinal (E)
Cette section est la plus largement étudiée en ce qui concerne les critères de plausibilité de la composition altérée du microbiote intestinal en tant que mécanisme physiopathologique dans le SSI. Un élément de preuve est l’effet thérapeutique bénéfique des antibiotiques peu absorbables, ciblant clairement le microbiote intestinal [11, 12]. Deux études menées avec la néomycine et cinq essais avec la rifaximine ont montré l’efficacité de ces antibiotiques à large spectre peu absorbables chez des patients atteints de SII non constipés [11-14]. En outre, un essai évaluant la sécurité et l’efficacité du traitement répété par rifaximine a confirmé également la faisabilité de ce traitement en cas de récidive des symptômes [15].
Les probiotiques sont définis comme des préparations de microorganismes vivants conférant un bénéfice à l’hôte en termes de santé lorsqu’ils sont administrés en quantités adéquates. Plusieurs méta-analyses ont confirmé l’efficacité des probiotiques, en tant que groupe, pour améliorer les symptômes de SII [11, 16]. Toutefois, l’hétérogénéité des plans d’étude et des critères d’évaluation, et la rareté relative des études utilisant des types de probiotiques spécifiques, empêchent de tirer des conclusions robustes au niveau des préparations individuelles. En revanche, les prébiotiques, des substrats qui sont utilisés de manière sélective par les micro-organismes de l’hôte et lui confèrent bénéfice sanitaire, n’ont pas montré d’efficacité pour améliorer les symptômes de SII sur la base des récentes méta-analyses [11, 17].
La transplantation de microbiote fécal est probablement le moyen le plus direct de cibler le microbiote intestinal pour le contrôle des symptômes dans le SII [18]. Les études menées jusqu’à maintenant ont conduit à des résultats très variables, d’une absence d’effet à un bénéfice symptomatique, mais aussi à une aggravation des symptômes, générant des conclusions contradictoires dans les méta-analyses [19, 20]. Toutefois, les études récentes ont montré des modifications induites par la TMF de la composition du microbiote intestinal associées avec un bénéfice symptomatique (transitoire) et ont impliqué la sélection du donneur en tant qu’aspect critique [21, 22].
TABLEAU 1
Résumé du respect des critères de plausibilité pour le microbiote intestinal altéré dans le SSI.
Problèmes non résolus et futures études
Ensemble, les modifications de la composition du microbiote intestinal semblent remplir les critères de plausibilité en termes de pertinence physiopathologique dans le syndrome de l’intestin irritable [6]. Les observations sont résumées dans la Figure 2. Toutefois, il existe un besoin clair de connaissances et de recherches supplémentaires. D’autres études quantitatives et mieux contrôlées caractérisant le microbiote intestinal dans le SII, incluant de préférence de larges cohortes de patients issus également de soins primaires. Cela permettra une meilleure compréhension des modifications du microbiote intestinal dans le SII à tous les niveaux de soins et potentiellement de confirmer une corrélation entre l’ampleur des modifications de la composition du microbiote intestinal et la sévérité des symptômes de SSI. En outre, des études longitudinales sur le SII devront établir la relation temporelle entre les modifications du microbiote intestinal et les caractéristiques et la sévérité des symptômes avec le temps, dans le cadre d’un essai thérapeutique ou en dehors.
Il existe un besoin continu d’essais de qualité supérieure sur les probiotiques dans le SSI, utilisant des durées de traitement appropriées et des critères d’évaluation validés, similaires à ceux conduits pour les agents pharmacologiques. Enfin, de nombreuses données nouvelles sur l’utilisation de la TMF dans le SSI sont attendues, avec le potentiel de clarifier les meilleurs modalités et l’efficacité de cette option de traitement.
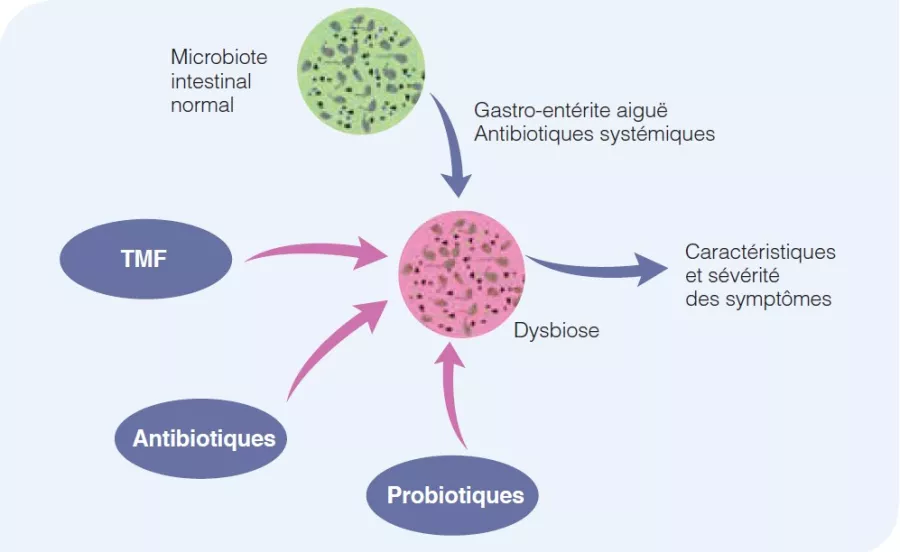
Figure 2
Importance physiopathologique des modifications du microbiote intestinal dans le syndrome de l’intestin irritable.
La composition normale du microbiote intestinal reflète l’état de santé, sans symptômes du SII. Des événements aigus, tels qu’une gastro-entérite aiguë ou la prise d’antibiotiques systémiques, peuvent altérer la composition du microbiote intestinal, entraînant des symptômes de SII les symptômes du SII. Ce phénomène peut être corrigé par l’utilisation d’antibiotiques non absorbables, de probiotiques ou par une transplantation de microbiote fécal.
1 Lacy BE, Mearin F, Chang L, et al. Bowel disorders. Gastroenterology 2016; 150: 1393-407.e5.
2 Longstreth GF, Thompson WG, Chey WD, et al. Functional bowel disorders. Gastroenterology 2006; 130:1480-91.
3 Bonfrate L, Tack J, Grattagliano I, et al. Microbiota in health and irritable bowel syndrome: current knowledge, perspectives and therapeutic options. Scand J Gastroenterol 2013; 48: 995-1009.
4 Bajaj JS, Barbara G, DuPont HL, et al. New concepts on intestinal microbiota and the role of the non-absorbable antibiotics with special reference to rifaximin in digestive diseases. Dig Liver Dis 2018; 50: 741-9.
5 Margolis KG, Cryan JF, Mayer EA. The microbiota-gut-brain axis: from motility to mood. Gastroenterology 2021; 160: 1486-501.
6 Tack J, Corsetti M, Camilleri M, et al. Plausibility criteria for putative pathophysiological mechanisms in functional gastrointestinal disorders: a consensus of experts. Gut 2018; 67: 1425-33.
7 Pittayanon R, Lau JT, Yuan Y, et al. Microbiota in patients with irritable bowel syndrome-a systematic review. Gastroenterology 2019; 157: 97-108.
8 Barbara G, Grover M, Bercik P, et al. Rome Foundation Working Team Report on post-infection irritable bowel syndrome. Gastroenterology 2019; 156:46-58.e7.
9 Tap J, Derrien M, Törnblom H, et al. Identification of an intestinal microbiota signature associated with severity of irritable bowel syndrome. Gastroenterology 2017; 152: 111-123 e8.
10 Paula H, Grover M, Halder SL, et al. Non-enteric infections, antibiotic use, and risk of development of functional gastrointestinal disorders. Neurogastroenterol Motil 2015; 27: 1580-6.
11 Ford AC, Harris LA, Lacy BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther 2018; 48: 1044-60.
12 Fodor AA, Pimentel M, Chey WD, et al. Rifaximin is associated with modest, transient decreases in multiple taxa in the gut microbiota of patients with diarrhoea-predominant irritable bowel syndrome. Gut Microbes 2019;10: 22-33.
13 Pimentel M, Chow EJ, Lin HC. Eradication of small intestinal bacterial overgrowth reduces symptoms of irritable bowel syndrome. Am J Gastroenterol 2000; 95: 3503-6.
14 Pimentel M, Chow EJ, Lin HC. Normalization of lactulose breath testing correlates with symptom improvement in irritable bowel syndrome. a double-blind, randomized, placebo-controlled study. Am J Gastroenterol 2003; 98, 412-9.
15 Lembo A, Pimentel M, Rao SS, et al. Repeat treatment with rifaximin is safe and effective in patients with diarrhea-predominant irritable bowel syndrome. Gastroenterology 2016; 151: 1113-21.
16 Li B, Liang L, Deng H, et al. Efficacy and safety of probiotics in irritable bowel syndrome: a systematic review and meta-analysis. Front Pharmacol 2020; 11: 332.
17 Wilson B, Rossi M, Dimidi E, et al. Prebiotics in irritable bowel syndrome and other functional bowel disorders in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2019; 109: 1098-111.
18 Goll R, Johnsen PH, Hjerde E, Diab J, Valle PC, Hilpusch F, Cavanagh JP. Effects of fecal microbiota transplantation in subjects with irritable bowel syndrome are mirrored by changes in gut microbiome. Gut Microbes 2020; 12: 1794263.
19 Myneedu K, Deoker A, Schmulson MJ, Bashashati M. Fecal microbiota transplantation in irritable bowel syndrome: A systematic review and meta-analysis. United European Gastroenterol J 2019; 7: 1033-41.
20 Ianiro G, Eusebi LH, Black CJ, Gasbarrini A, Cammarota G, Ford AC. Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2019; 50: 240-8.
21 El-Salhy M, Hatlebakk JG, Gilja OH, et al. Efficacy of faecal microbiota transplantation for patients with irritable bowel syndrome in a randomised, double-blind, placebo-controlled study. Gut 2020; 69: 859-67.
22 Holvoet T, Joossens M, Vázquez-Castellanos JF, et al. Fecal Microbiota transplantation reduces symptoms in some patients with irritable bowel syndrome with predominant abdominal bloating: short- and long-term results from a placebo-controlled randomized trial. Gastroenterology 2021; 160: 145-57.e8.