Maladie cœliaque : le revers de la médaille du sans gluten
L’éviction du gluten est impérative en cas de maladie cœliaque. Mais quelles sont les conséquences d’un an de ce régime sur le microbiote et son fonctionnement ? Le point avec cette étude anglaise. 1
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
A propos de cet article
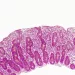
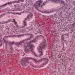
Lorsque le diagnostic d’une (sidenote: Maladie cœliaque trouble auto-immun qui affecte principalement l’intestin grêle et qui est déclenché par l’ingestion de gluten chez des personnes génétiquement prédisposées. ) tombe, les patients se voient contraints de suivre un régime sans (sidenote: Gluten (du latin glue qui signifie colle) : substance azotée visqueuse qui se forme après hydratation de la farine, à partir de certaines protéines (gluténines et gliadines) des céréales, principalement du blé. ) à vie. Et pourtant, on en connaît mal les conséquences sur le fonctionnement de l’intestin et le microbiote qu’il abrite. D’où l’intérêt de cette étude observationnelle qui évalue la fonction intestinale et le microbiote de 36 patients cœliaques avant et après un an de régime sans gluten, comparés à 36 témoins sains suivant une alimentation standard.
2 ou 3 Comme pour les autres maladies auto-immunes, la maladie cœliaque est plus fréquente chez les femmes, qui sont 2 à 3 fois plus touchées que les hommes. ²
Avant le sans gluten
Les patients nouvellement diagnostiqués – qui n’ont pas encore démarré leur régime sans gluten-, se distinguent de volontaires sains : davantage de somatisation, de dépression, d’anxiété, de symptômes gastro-intestinaux, des selles moins riches en eau (-5 %). L’équipe rapporte également :
- Une teneur en eau du contenu de l’intestin grêle significativement plus élevée (+ 57 %) qui pourrait être liée à l’effet combiné d’une absorption altérée (atrophie des villosités), de sécrétions accrues (hyperplasie des cryptes) et d’un trouble de la motricité intestinale ;
- Et un transit plus lent (+ 83 %) qui pourrait s’expliquer par des lésions des muqueuses, une inflammation affectant la motilité, une malabsorption et un déséquilibre des hormones intestinales.
A défaut d’identifier une signature spécifique du microbiote intestinal dans la maladie cœliaque, l’équipe montre des différences au niveau de certains taxons bactériens, dont certaines pourraient s’expliquer par l’altération de la fonction intestinale : la moindre abondance de l'espèce Blautia pourrait par exemple être liée au transit lent et aux volumes coliques élevés.
95%
La prédisposition génétique joue un rôle clé dans la maladie cœliaque qui est fortement associée à des gènes spécifiques du système HLA (système de reconnaissance du soi en immunologie). La majorité des patients atteints de la maladie cœliaque (environ 95 %) expriment des gènes codant pour la protéine du complexe majeur d'histocompatibilité (CMH) de classe II, HLA-DQ2. 3
20%
L’origine auto-immune de la maladie coeliaque est confirmée par la présence d’auto-anticorps sériques et par l’association fréquente à d’autres maladies auto-immunes retrouvées chez 20 % des patients (dermatite herpétiforme, thyroïdite, diabète de type 1, cirrhose biliaire primitive…). 4
Un régime qui pèse sur le microbiote
Après 12 mois d’éviction du gluten, le bien-être des patients semble amélioré (moindre somatisation, moindre anxiété, petite amélioration du transit, moindres symptômes…), sans néanmoins leur permettre de retrouver des niveaux comparables à ceux des témoins non atteint de la maladie coeliaque. Ce constat suggère que l’éviction du gluten, bien qu’important, n’est pas un traitement suffisant à lui seul.
Un an de régime, qui élimine le blé mais aussi ses fibres (amidon résistant et arabinoxylane), a en revanche un impact plutôt négatif sur le microbiote et les voies métaboliques : moindre abondance des bifidobactéries et donc des enzymes impliquées dans la dégradation de l’amidon et des arabinoxylanes ; présence accrue de E. coli, Enterobacter et Peptostreptococcus induisant une hausse des fonctions protéolytiques associées.
Ces déséquilibres persistent malgré une bonne adhésion au régime, attestée chez la majorité des patients par la normalisation des anticorps anti-transglutaminase. Ce constat est établi alors même que la plupart des patients présentaient une adhésion stricte au régime, confirmée par la normalisation des anticorps anti-transglutaminase, signe d’une réponse immunitaire efficace.
30%
30 % des patients ont présenté des symptômes persistants ou aggravés après l’adoption d’un régime sans gluten. 1
14%
Les « céréales contenant du gluten » (blé, seigle, orge, avoine, épeautre, kamut ou leurs souches hybridées) et produits à base de ces céréales font partie de la liste des 14 allergènes considérés comme majeurs au sens de la réglementation européenne pour l’étiquetage des aliments. ⁵
Persistance des symptômes
Mais surtout, 1 patient sur 3 rapporte des symptômes gastro-intestinaux persistants voire aggravés par le régime sans gluten.
Ces symptômes persistants pourraient être liés à des altérations spécifiques du microbiote intestinal, indépendantes de la réponse immunitaire au gluten.
Les (sidenote: Acides gras à chaîne ramifiée Acides gras généralement saturés présentant une (ou plusieurs) branche méthyle sur la chaîne carbonée. Composants majeurs des membranes bactériennes de nombreux genres et espèces, ces acides gras ramifiés sont rares dans les tissus humains internes mais sont présents à des concentrations élevées dans la peau et le vernix (substance blanche cireuse) des nouveau-nés. Aux États-Unis, le régime alimentaire, et notamment le fromage et les produits à base de viande bovine, induiraient des apports d'environ 500 mg/jour. ) semblent corrélés aux symptômes, et la composition du microbiote (notamment les genres Bifidobacterium, Alistipes et Ruminococcus) avec leur persistance.
Bien qu’il s’agisse du seul traitement actuellement existant en cas de maladie cœliaque, le régime sans gluten altère le microbiote et ne corrige pas tous les symptômes. Aussi, les auteurs envisagent de l’associer à des prébiotiques et/ou symbiotiques ciblés, afin d’en contrer les effets négatifs.
2. Malamut G, Cellier C. Place et bilan de la maladie cœliaque. Hepatogastroenterology, 2012;19:597-606.
5. EU Regulation No. 1169/2011 on the provision of food information to consumers (“INCO” Regulation)