Ce micro-organisme intestinal pourrait améliorer l'efficacité des traitements anticancéreux
Un seul micro-organisme intestinal peut déterminer si un patient réagit ou non à une immunothérapie anticancéreuse. Cette étude révèle comment les signaux émis par l'intestin peuvent renforcer les défenses antitumorales de l'organisme comme jamais nous ne l'aurions imaginé.
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
A propos de cet article
L'immunothérapie transforme l'oncologie, mais dans la plupart des tumeurs solides, les (sidenote: Inhibiteurs de PD-1 Médicaments qui « libèrent » les lymphocytes T en bloquant le récepteur PD-1, ce qui permet au système immunitaire d'attaquer les tumeurs plus efficacement. ) échouent encore chez la majorité des patients. Notre histoire commence à un endroit dont tous les cliniciens connaissent l'importance, mais que peu savent encore « doser » : le microbiome intestinal. Les oncologues ont constaté que certains patients réagissaient durablement au traitement, tandis que d'autres, apparemment semblables sur le papier, ne réagissaient pratiquement pas. Une nouvelle étude publiée dans Nature 1 pose une question simple mais cruciale : un seul micro-organisme intestinal peut-il reprogrammer les cellules dendritiques, les faire voyager de l'intestin jusqu'à la tumeur et améliorer l'efficacité des inhibiteurs de points de contrôle ? Et la réponse semble être « oui ».
Un acteur caché dans la réponse à PD-1
Des chercheurs de l'Institut de recherche du Centre national de lutte contre le cancer de Tokyo ont suivi des patients atteints de cancers du poumon et de l'estomac qui recevaient un blocage de PD-1 et ont examiné le microbiome de leurs selles juste avant le traitement. Les répondeurs présentaient systématiquement une plus grande diversité bactérienne et, plus particulièrement, davantage de membres de la famille des (sidenote: Ruminococcaceae Famille de bactéries intestinales souvent associée à un microbiome plus sain et plus varié et à une meilleure activation immunitaire. ) . Dans ce groupe, les chercheurs ont isolé une bactérie anaérobie d'apparence banale, une souche de Hominenteromicrobium mulieris qu'ils ont appelée YB328.
Les patients présentant des niveaux plus élevés d'YB328 avaient une survie sans progression plus longue dans plusieurs cohortes et types de cancer. À l'inverse, ceux qui présentaient des niveaux plus élevés de Parabacteroides vulgatus, un membre commun des Bacteroidaceae, avaient tendance à avoir de moins bons résultats. Lorsque ces micro-organismes ont été transférés chez des souris, les observations se sont confirmées : YB328 a transformé la thérapie PD-1 en un outil antitumoral beaucoup plus puissant, tandis que P. vulgatus a laissé les tumeurs largement intactes.
Comment une bactérie reprogramme les cellules dendritiques
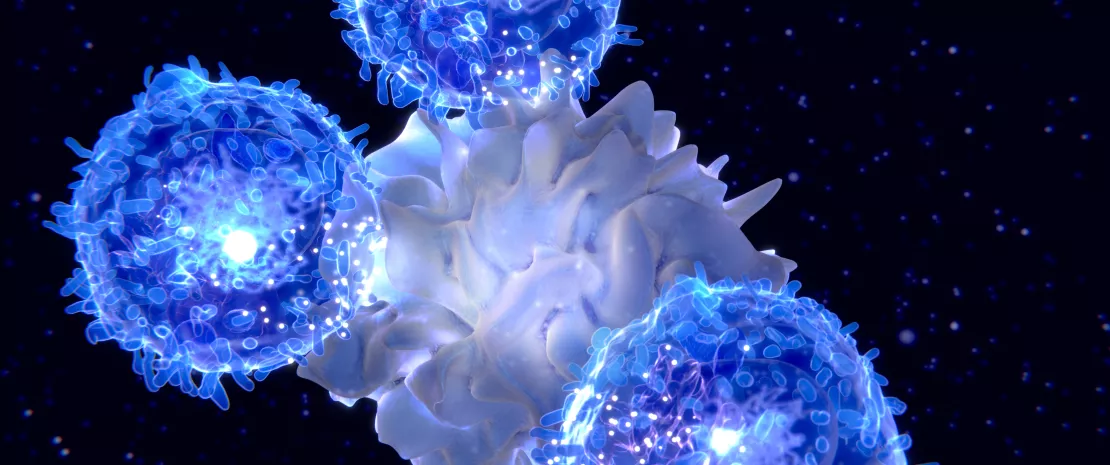
YB328 ne se contente pas de « stimuler le système immunitaire ». Elle modifie la façon dont les cellules immunitaires clés sont fabriquées. Dans des études menées en laboratoire et sur des animaux, cette bactérie amène les précurseurs immunitaires précoces à évoluer en un type spécifique de cellule dendritique, appelée (sidenote: Cellules dendritiques cDC1 Sous-ensemble spécialisé de cellules dendritiques capables de présenter des antigènes et d'activer de fortes réponses des lymphocytes T CD8 contre les tumeurs. ) , en activant les gènes qui favorisent cette évolution. Pour ce faire, elle utilise un ensemble de signaux de détection à l'intérieur de ces cellules.
Une fois formées, ces cellules cDC1 entraînées par l'intestin n'y restent pas. Elles se déplacent progressivement dans le système lymphatique et atteignent finalement la tumeur. En utilisant des modèles de souris spéciaux qui permettent aux chercheurs de suivre le déplacement des cellules, l'étude montre que ces cellules dendritiques dérivées de l'intestin pénètrent physiquement dans l'environnement tumoral.
À l'intérieur de la tumeur, elles présentent les antigènes tumoraux plus efficacement, activent davantage de lymphocytes T CD8 et aident ces lymphocytes T à reconnaître un plus large éventail de cibles tumorales, y compris des signaux plus faibles qui n'auraient normalement pas été détectés. Pour simplifier, YB328 aide le système immunitaire à « voir » une plus grande partie de la tumeur et à y répondre avec plus de force et d'ampleur.
Compétition microbienne et imitation thérapeutique
Ce qui est tout aussi frappant, c'est ce qui se passe lorsque l'écologie œuvre contre nous. Chez les souris colonisées avec un microbiome « non répondeur », l'ajout d'YB328 peut restaurer l'efficacité de PD-1, mais seulement si des souches concurrentes telles que P. vulgatus ne bloquent pas sa
(sidenote:
Prise de greffe
Établissement réussi d'une souche microbienne dans l'intestin et persistance de celle-ci après son introduction.
)
. Un micro-organisme peut annuler les bénéfices d'un autre, un rappel à la dure réalité pour toute future stratégie de biothérapie.
Enfin, les auteurs montrent qu'un cocktail défini d' (sidenote: Agonistes du TLR Molécules qui activent des récepteurs de type Toll, stimulent les voies immunitaires innées et renforcent l'activation des cellules immunitaires. ) peut imiter une grande partie de l'effet d'YB328 sur la programmation des cDC1 et la synergie PD-1. Ces travaux repositionnent l'intestin non seulement comme une source de biomarqueurs, mais aussi comme un régulateur amont ajustable de la biologie des cellules dendritiques et de la réponse aux points de contrôle. Ceci ouvre la voie à des adjuvants guidés par le microbiome ou basés sur les TLR qui pourraient transformer un plus grand nombre de nos « non répondeurs » en des répondeurs durables.