Colonisation microbienne : un facteur déterminant pour la santé pendant les 1 000 premiers jours de vie
Par le Pr Marie-Claire Arrieta
Départements de physiologie et de pharmacologie et pédiatrie, Faculté de médecine Cumming, Université de Calgary, Centre de recherche et d’innovation en santé, Calgary, Alberta, Canada
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
Des études épidémiologiques et mécanistiques réalisées au cours des 20 dernières années ont démontré que le microbiote, au début de la vie, jouait un rôle dans la pathogenèse de plusieurs maladies non transmissibles (MNT). Cette collection de milliers de milliards de micro-organismes, résidant principalement dans les intestins, s’engage dans un dialogue dynamique avec les cellules de l’hôte. C’est par ce dialogue que l’hôte intègre les métabolites et les structures microbiennes dans la programmation des mécanismes immunitaires, neurologiques, métaboliques et endocriniens qui vont lui permettre de se développer. Alors que ce dialogue se poursuit tout au long de la vie, il existe une période unique au début du développement, appelée « fenêtre d’opportunité », au cours de laquelle le dialogue entre les micro-organismes et l’hôte prépare le terrain pour l’homéostasie de l’hôte, ou les écarts par rapport à celle-ci. Cette période dure environ 1 000 jours, couvrant la croissance foetale et les deux premières années de la vie humaine, et fait l’objet de recherches intenses.
COMPOSITION ET FONCTION DU MICROBIOTE AU DÉBUT DE LA VIE
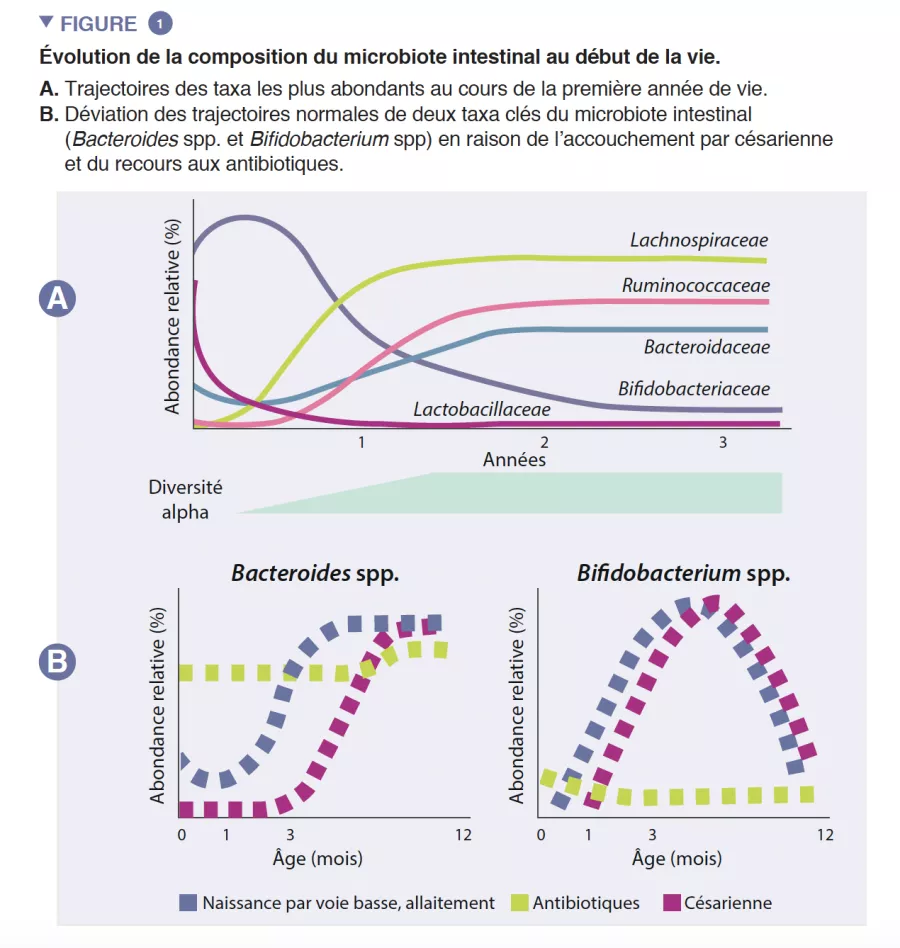
Le microbiote intestinal du nourrisson commence à se développer à la naissance avec un écosystème très simple, et voit la diversité de ses espèces augmenter pendant environ 2-3 ans (encadré). Ce processus se déroule en plusieurs étapes, avec des profils communs identifiés entre différentes populations humaines (Figure 1). La colonisation démarre avec les espèces pionnières provenant essentiellement du canal vaginal et des selles de la mère ou de sa peau, selon que l’enfant est né par voie basse ou par césarienne, respectivement. Les enfants nés par voie basse ont une abondance plus importante de Lactobacillus, Prevotella et Sneathia, alors que ceux nés par césarienne sont initialement colonisés par des Staphylococcus, Propionibacterium et Corynebacterium. Les enfants allaités présentent une abondance plus grande d’espèces des genres Bifidobacterium et Lactobacillus que les enfants nourris au lait infantile, qui présentent quant à eux une abondance plus importante de Bacteroides, Enterobacteriaceae et Clostridiaceae. Avec l’introduction des aliments solides, le microbiote intestinal se diversifie de plus en plus et passe à un état dominé par les Bacteroidaceae, Lachnospiraceae et Ruminococcaceae, qui persiste jusqu’à l’âge adulte (Figure 1) [1].
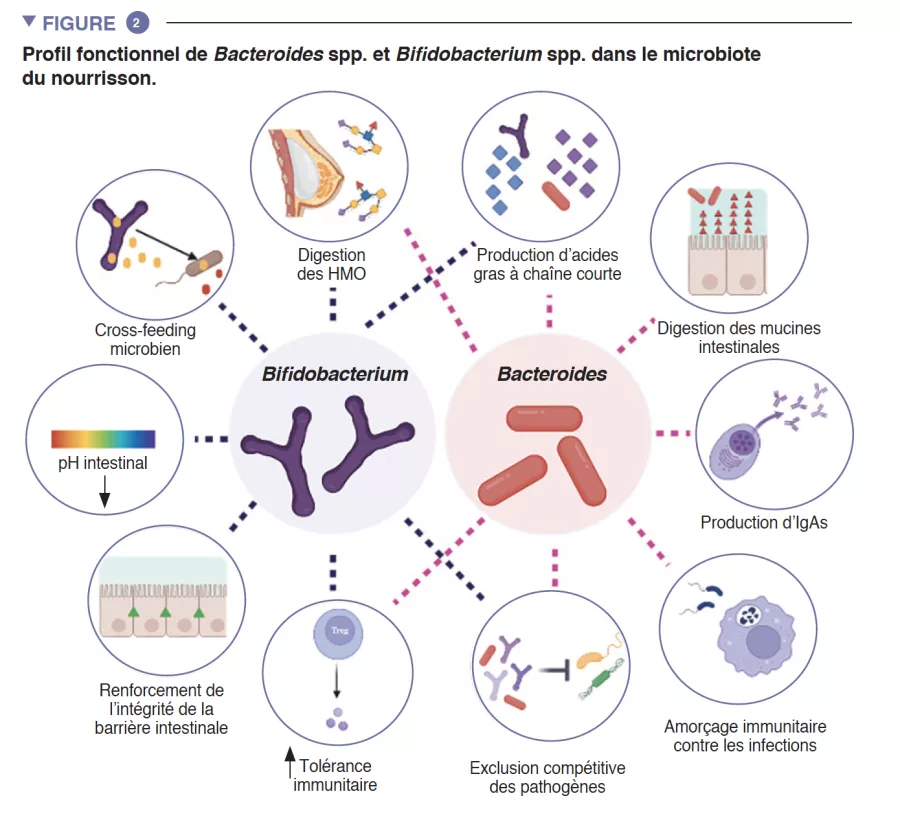
L’intestin du nourrisson est une étape de métabolisme important qui contribue à la digestion, au métabolisme énergétique et à l’éducation immunitaire. Par la digestion microbienne des composants du lait maternel, les espèces du genre Bifidobacterium font baisser le pH de la lumière intestinale par la production de lactate et d’acétate, ce qui est considéré comme une stratégie cruciale dans l’augmentation de l’absorption intestinale des nutriments. L’acétate représente la majorité des acide gras à chaîne courte (AGCC) produits dans l’intestin du nourrisson, et il est impliqué dans la prévention des infections par les entéropathogènes [2]. Les bifidobactéries sont également impliquées dans un processus connu sous le nom de « cross-feeding », ou alimentation croisée, dans lequel la production d’acétate et de lactate sert de substrat pour la croissance d’autres espèces, telles que Roseburia, Eubacterium, Faecalibacterium et Anaeroestipes, favorisant ainsi la diversité du microbiote. Les espèces du genre Bacteroides peuvent également fermenter le lait maternel et sont d’importants producteurs de propionate, un AGCC. Les espèces du genre Bacteroides ont une capacité unique à également métaboliser les oligosaccharides dérivés des mucines [3]. Cette plasticité métabolique améliore leur adaptabilité aux fluctuations des conditions intestinales entre les repas, ainsi qu’après le sevrage et l’introduction des aliments solides. Les espèces du genre Bacteroides sont également essentielles à l’éducation immunitaire, constituant une source importante du composant microbien lipopolysaccharide, et favorisant le développement de réponses immunitaires adaptatives tolérogènes dans l’intestin [4]. Compte tenu de leur adaptabilité particulière à l’environnement intestinal du nourrisson, de leur transmissibilité de la mère à l’enfant, de leur dominance dans l’intestin du nourrisson, de leur importance pour les autres membres de cet écosystème microbien et de leurs bénéfices pour l’hôte, les espèces des genres Bacteroides et Bifidobacterium sont probablement des espèces clés du microbiote du nourrisson humain (Figure 2).
LES FACTEURS QUI INFLUENCENT LE MICROBIOTE AU DÉBUT DE LA VIE
Les espèces pionnières peuvent avoir des conséquences durables sur la trajectoire du microbiote intestinal du nourrisson par des effets de priorité. Ce processus écologique implique qu’une arrivée précoce dans un nouvel écosystème joue un rôle fondamental dans l’assemblage de la communauté. Ce processus explique l’influence du mode d’accouchement sur la composition initiale du microbiote du nourrisson. De vastes études de cohorte ont identifié des différences de microbiote liées à l’accouchement par césarienne qui persistent pendant des mois après la naissance, et sont susceptibles d’impacter cette période critique dans le développement de l’hôte [5]. Il s’agit notamment d’une abondance plus faible d’espèces des genres Bacteroides et Bifidobacterium et d’une abondance plus forte d’espèces potentiellement pathogènes.
En plus du mode d’accouchement, la disponibilité et l’abondance de substrats nutritionnels ont un effet déterminant sur le microbiote au début de la vie. Le lait maternel contient plus de 10 g/L d’HMO (human milk oligosaccharides, oligosaccharides du lait maternel), le 2’fucosyl-lactose (2’FL) et le trifucosyllacto-N-hexaose (TF-LNH) étant les plus abondants [6]. La majorité des HMO sont digérés par les espèces des genres Bifidobacterium et Bacteroides en AGCC. Les bifidobactéries possèdent un vaste répertoire de gènes pour la digestion des HMO. Plusieurs sous-espèces de B. longum sont fréquemment retrouvées dans l’intestin du nourrisson, les sousespèces infantis (B. infantis), longum (B. longum) et breve (B. breve) étant souvent isolées dans les selles des enfants allaités en bonne santé, alors que les enfants nourris au lait infantile sont souvent colonisés par B. adolescentis. Parmi ces sous-espèces, B. infantis est celle qui a le plus vaste répertoire de gènes pour digérer l’ensemble des structures HMO dans le lait humain [7]. Le lait maternel influence également la composition du microbiote du nourrisson par le biais de facteurs immunitaires, tels que les composés antimicrobiens (lactoferrine et lysozyme) et les effecteurs immunitaires (IgAs, cellules immunitaires et cytokines), qui sont essentiels pour l’exclusion immunitaire des micro-organismes pathogènes [1]. À noter que comparativement aux bébés allaités, l’abondance plus faible de Bifidobacterium observée chez les bébés nourris au lait infantile est associée à une concentration plus faible de lactate et d’IgAs et à un pH plus élevé au niveau de la lumière intestinale.
En plus du mode d’accouchement et de l’alimentation des enfants, d’autres facteurs tels que le tabagisme de la mère, son indice de masse corporelle, le diabète gestationnel, l’asthme familial et le stress peuvent influencer le microbiote au début de la vie [8]. Les mécanismes sous-tendant les associations entre ces facteurs et le microbiote du nourrisson sont encore peu clairs mais ils impliquent probablement des modifications au niveau du microbiote maternel et une transmission verticale ultérieure à l’enfant, ainsi que le risque accru de césarienne et les taux plus faibles de réussite de l’allaitement liés à beaucoup de ces facteurs. En général, les effets individuels des facteurs tels que le mode d’accouchement, le recours aux antibiotiques et l’allaitement sont relativement bien caractérisés. Cependant, les effets combinés de ces expositions restent mal compris.
L’enfant est-il colonisé in utero?
- De l’ADN microbien a été détecté dans le placenta, le liquide amniotique et le méconium, faisant supposer l’existence d’une colonisation in utero.
- L’impossibilité de mettre en culture les micro-organismes détectés in utero, l’effet constant du mode d’accouchement sur le microbiote et la génération réussie d’animaux axéniques à partir d’embryons ont conduit au consensus actuel selon lequel la colonisation microbienne chez les nouveau-nés en bonne santé débute à la naissance [15].
DYSBIOSE AU DÉBUT DE LA VIE : UNE CAUSE DE MALADIES NON TRANSMISSIBLES
Le microbiote au début de la vie est un écosystème jeune et il est donc moins résilient par nature. La résilience écologique est la capacité d’un écosystème à retrouver son état d’origine après une perturbation. Le microbiote du nourrisson a donc un risque plus élevé de voir sa trajectoire altérée de manière permanente à un stade critique du développement. Le recours péri- et post-natal aux antibiotiques induit des modifications radicales au niveau de la composition et de la diversité du microbiote du nourrisson, connues sous le nom de « dysbiose », diminuant l’abondance des bifidobactéries et la diversité globale du microbiote et augmentant les espèces pathogènes. Cet effet s’observe même quand les antibiotiques ne sont administrés qu’aux mères lors d’une naissance par voie basse (pour prévenir les infections à streptocoques B) et il est augmenté lorsqu’ils sont administrés aux nourrissons pendant la première année de vie, suivant une relation dose-réponse [9]. À noter que même une seule cure d’amoxicilline administrée à des nourrissons a diminué l’abondance des bifidobactéries pendant plusieurs mois, ce qui montre la sensibilité de ce groupe important de bactéries à ces médicaments couramment utilisés [10].
Une exposition aux antibiotiques pendant la gestation ou avant le sevrage chez le rongeur peut aggraver les réponses immunitaires allergiques (IgE, lymphocytes Th2 et Th17), l’adiposité et l’obésité, les réponses auto-immunes et la colite chronique [1]. Ces réponses systémiques à la dysbiose au début de la vie concordent avec les données épidémiologiques constantes associant le recours aux antibiotiques au début de la vie et plusieurs MNT. Par exemple, une revue systématique et une méta-analyse de 13 études ont identifié une association dose-réponse entre le recours aux antibiotiques et l’obésité, avec un risque accru allant de 11 % pour les nourrissons ne recevant qu’une seule dose à 24 % lors de l’administration de plus d’un traitement [9]. Plus récemment, une revue systématique et une méta-analyse de 160 études, englobant plus de 22 millions d’enfants, ont mis en évidence des associations significatives entre le recours aux antibiotiques chez les enfants et la dermatite atopique, les allergies alimentaires, la rhinoconjonctivite allergique, l’asthme, l’arthrite juvénile, le psoriasis et les troubles du spectre de l’autisme [11].
La directionnalité et la causalité sont très difficiles à établir à partir des études épidémiologiques. Cependant, les résultats combinés des études précliniques et les associations dose-réponse établies entre le recours aux antibiotiques et l’asthme et l’obésité, en particulier, plaident en faveur de l’application de mesures plus strictes en matière de bon usage des antibiotiques. Une récente étude conduite chez des enfants canadiens a rapporté une diminution de l’incidence de l’asthme parallèle à la baisse des prescriptions d’antibiotiques à l’échelle de la population entre les années 2000 et 2014. Point important, la composition du microbiote à l’âge de 1 an a joué un rôle dans l’association entre l’exposition aux antibiotiques et le diagnostic d’asthme à 5 ans [12]. Cette étude importante apporte des preuves solides de l’existence d’une relation de causalité entre le recours aux antibiotiques et l’asthme chez l’être humain et montre la nécessité d’un usage prudent des antibiotiques pour réduire l’incidence de l’asthme.
CORRIGER LA DYSBIOSE : OÙ EN EST-ON ?
Les conséquences délétères de la dysbiose au début de la vie méritent davantage d’études mais également de l’action. La diminution du recours à la césarienne, au lait infantile et aux antibiotiques est un objectif louable mais son potentiel de succès est limité compte tenu des besoins sociétaux. Différentes stratégies de restauration du microbiote ont été tentées, avec des résultats mitigés. Deux méthodes de restauration de l’écosystème ont été testées dans les accouchements programmés par césarienne : l’ensemencement vaginal et la transplantation de microbiote fécal (TMF). L’ensemencement vaginal consiste à imprégner la peau et/ou la cavité buccale d’un nouveau-né avec les sécrétions vaginales de la mère. Les trois essais actuellement publiés sur l’ensemencement vaginal ont montré que cette méthode ne permet pas de restaurer le microbiote après césarienne pour le faire ressembler à un microbiote après naissance par voie basse [8]. Par contre, une TMF mère/enfant (administrée lors du premier biberon) a été suffisante pour corriger le microbiote après césarienne [13]. Cependant, même si les auteurs ont réalisé une recherche d’agents pathogènes dans les échantillons utilisés pour la TMF, cette pratique controversée comporte un risque infectieux significatif et inutile pour un nouveau-né par ailleurs en bonne santé, et ne deviendra probablement pas une option viable.
L’utilisation de pré- et de probiotiques pourrait constituer une approche plus pratique et faisable pour restaurer le microbiote, en particulier à la lumière des études résumées ci-dessus. Une récente étude a montré que la déplétion en bifidobactéries et en gènes utilisant les HMO pouvait être améliorée en combinant l’administration d’une souche de B. infantis et l’allaitement [14]. Cette stratégie a également atténué les réponses pro-inflammatoires induisant l’allergie à 1 an, montrant des mécanismes immunitaires bénéfiques à long terme. Cependant, il n’existe pas suffisamment de preuves montrant que les stratégies actuelles de restauration du microbiote permettront d’infléchir les taux alarmants de MNT pédiatriques.
Conclusion
Le microbiote au début de la vie fait partie intégrante de la s anté de l’enfant. Nos connaissances concernant les profils compositionnels et fonctionnels du début de la colonisation microbienne, ainsi que les facteurs qui soutiennent ou perturbent ces profils, se sont considérablement accrues. Cependant, les mécanismes qui expliquent en quoi la dysbiose contribue à la pathogenèse des maladies sont mal compris. Les mesures basées sur l’écologie visant à reconstituer les espèces clés du microbiote du nourrisson, perdues en raison du recours aux antibiotiques, de l’accouchement par césarienne ou de la consommation de lait infantile, ainsi que leurs substr ats nutritionnels, pourraient s’avérer efficaces. Cependant, les stratégies actuelles de restauration du microbiote sont insuffisantes et doivent encore montrer leur efficacité dans la réduction du risque de MNT. C’est la pro chaine étape cruciale pour faire évoluer les politiques et pratiques médicales.
1. Laforest-Lapointe I, Arrieta MC. Patterns of Early-Life Gut Microbial Colonization during Human Immune Development: An Ecological Perspective. Front Immunol 2017; 8: 788.
2. Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature 2011; 469: 543-7.
3. Sonnenburg JL, Xu J, Leip DD, et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont. Science 2005; 307: 1955-9.
4. Telesford KM, Yan W, Ochoa-Reparaz J, et al. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes 2015; 6: 234-42.
5. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118: 511-21.
6. Thurl S, Munzert M, Boehm G, et al. Systematic review of the concentrations of oligosaccharides in human milk. Nutr Rev 2017; 75: 920-33.
7. Underwood MA, German JB, Lebrilla CB, et al. Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res 2015; 77: 229-35.
8. Korpela K, de Vos WM. Infant gut microbiota restoration: state of the art. Gut Microbes 2022; 14: 2118811.
9. Mc- Donnell L, Gilkes A, Ashworth M, et al. Association between antibiotics and gut microbiome dysbiosis in children: systematic review and meta-analysis. Gut Microbes 2021; 13: 1-18.
10. Korpela K, Salonen A, Saxen H, et al. Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatr Res 2020; 88: 438-43.
11. Duong QA, Pittet LF, Curtis N, et al. Antibiotic exposure and adverse long-term health outcomes in children: A systematic review and meta-analysis. J Infect 2022; 85: 213-300.
12. Patrick DM, Sbihi H, Dai DLY, et al. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children: evidence from population-based and prospective cohort studies. Lancet Respir Med 2020; 8: 1094-105.
13. Korpela K, Helve O, Kolho KL, et al. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell 2020; 183: 324-34.e5.
14. Henrick BM, Rodriguez L, Lakshmikanth T, et al. Bifidobacteria-mediated immune system imprinting early in life. Cell 2021; 184: 3884-98.e11.
15. Perez-Muñoz ME, Arrieta MC, Ramer-Tait AE, et al. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome 2017; 5: 48.