La colonización microbiana es un factor determinante de la salud durante los primeros 1000 días de vida
SÍNTESIS
Por la Prof. Marie-Claire Arrieta
Departamentos de Fisiología y Farmacología y de Pediatría, Escuela de Medicina Cumming, Universidad de Calgary, Centro de Innovación en Investigación Sanitaria, Calgary, Alberta, Canadá
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Los estudios epidemiológicos y mecanísticos de los últimos 20 años han demostrado la función del microbioma de las primeras fases de vida en la patogénesis de numerosas enfermedades no transmisibles (ENT). Este conjunto de billones de microorganismos, que residen principalmente en los intestinos, participa en una interferencia dinámica con las células anfitrionas. A través de dicha interferencia, el anfitrión integra los metabolitos y estructuras microbianas en la programación temprana de los mecanismos inmunológicos, neurológicos, metabólicos y endocrinos que contribuyen a su desarrollo. Aunque esta interferencia se produce durante toda la vida, hay un período crucial en el desarrollo temprano que se conoce como “ventana de oportunidad”, durante el cual la interferencia microbio-anfitrión prepara el terreno para la homeostasis del anfitrión y posibles desviaciones de esta. Este período dura unos 1000 días, y abarca desde el crecimiento del feto hasta los dos primeros años de vida humana, y es el centro de interés de una intensa investigación.
COMPOSICIÓN Y FUNCIÓN DEL MICROBIOMA EN LOS PRIMEROS AÑOS DE VIDA
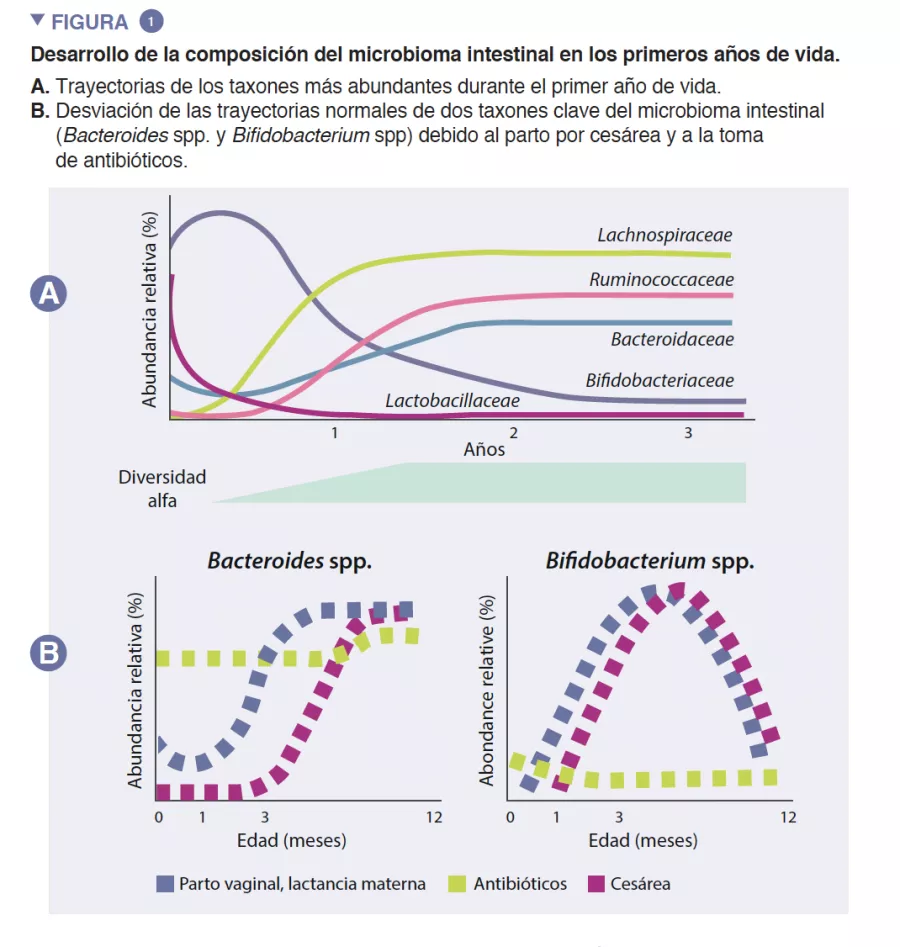
El microbioma intestinal de los lactantes empieza a desarrollarse al nacimiento como un ecosistema muy simple, cuya diversidad de especies aumenta durante unos 2 o 3 años (recuadro). Este proceso se produce de manera escalonada, con patrones comunes que se han identificado en varias poblaciones humanas (Figura 1). La colonización temprana comienza con especies precursoras que provienen principalmente del canal vaginal y de las heces maternas o de la piel, en función de si el bebé nace por vía vaginal o por cesárea, respectivamente. Los bebés nacidos por vía vaginal presentan una mayor abundancia de Lactobacillus, Prevotella y Sneathia, mientras que los nacidos por cesárea están colonizados en un principio por Staphylococcus, Propionibacterium y Corynebacterium. Los lactantes amamantados presentan una mayor abundancia de Bifidobacterium sp. y de Lactobacillus sp. en comparación con los lactantes alimentados con leche artificial, que presentan una mayor abundancia de Bacteroides, Enterobacteriaceae y Clostridiaceae. A medida que se introducen los alimentos sólidos, el microbioma intestinal se vuelve cada vez más diverso y se modifica para pasar a un estado de predominio de Bacteroidaceae, Lachnospiraceae y Ruminococcaceae que se conserva en la edad adulta (Figura 1) [1].
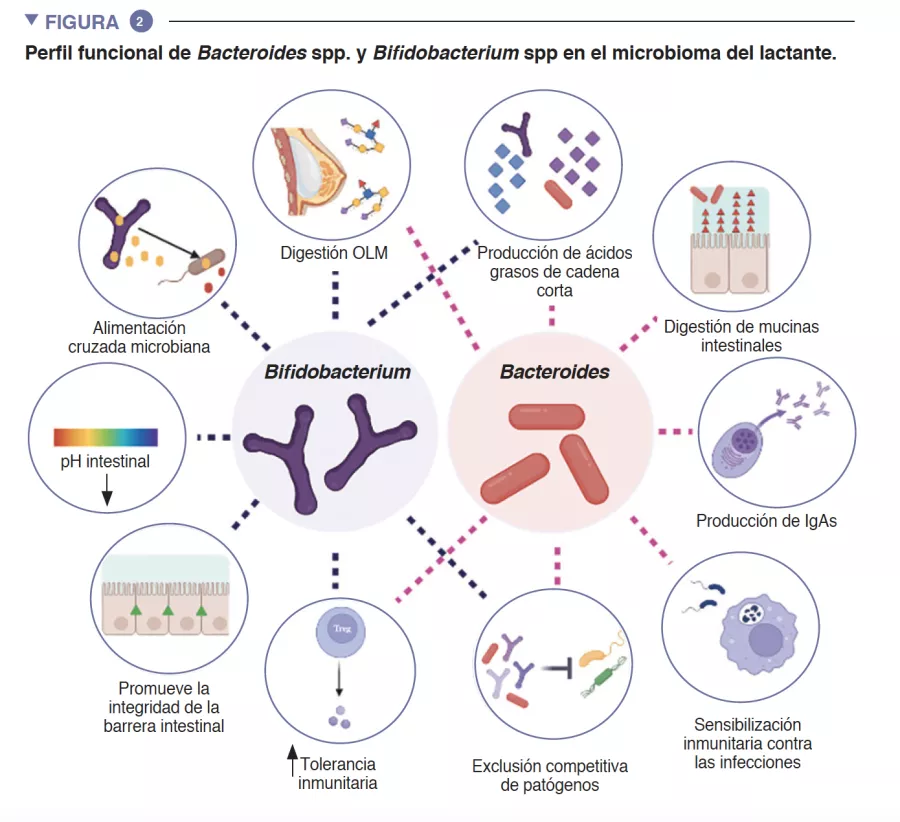
El intestino del lactante es el entorno en el que se produce un importante metabolismo que contribuye a la digestión, al metabolismo energético y a la educación inmunitaria. Gracias a la digestión microbiana de los componentes de la leche materna, las especies de Bifidobacterium reducen el pH luminal intestinal mediante la producción de lactato y acetato, lo que se considera una estrategia fundamental para aumentar la absorción intestinal de nutrientes. El acetato representa la mayor parte de los ácidos grasos de cadena corta (AGCC) que se producen en el intestino del lactante, y está implicado en la prevención de infecciones por enteropatógenos [2]. Las bifidobacterias también intervienen en un proceso conocido como alimentación cruzada, en el que la producción de acetato y de lactato sirve como sustrato para el crecimiento de otras especies, como Roseburia, Eubacterium, Faecalibacterium, y Anaeroestipes, lo que favorece la diversidad del microbioma. Las especies de Bacteroides también pueden fermentar la leche materna, y son importantes productoras de propionato, un ácido graso de cadena corta. Las especies de Bacteroides también tienen una capacidad única para metabolizar los oligosacáridos derivados de la mucina [3]. Esta plasticidad metabólica les permite adaptarse a las condiciones intestinales fluctuantes entre comidas, así como tras el destete y la introducción de alimentos sólidos. Las especies de Bacteroides también son clave para la educación inmunitaria, pues constituyen una fuente importante de lipopolisacárido, un componente microbiano, además de propiciar el desarrollo de respuestas inmunitarias adaptativas tolerógenas en el intestino [4]. Dada su especial adaptabilidad al entorno intestinal del lactante, la transmisión demostrada de cepas de madre a hijo, su predominio en el intestino del lactante, su importancia para otros miembros de este ecosistema microbiano y los beneficios para el anfitrión, es probable que tanto Bacteroides spp. como Bifidobacterium spp. sean especies clave del microbioma del lactante humano (Figura 2).
FACTORES QUE SUSTENTAN EL MICROBIOMA EN LOS PRIMEROS AÑOS DE VIDA
Las especies precursoras tempranas pueden tener consecuencias duraderas para la trayectoria del microbioma intestinal del lactante a través de efectos prioritarios. Este proceso ecológico establece que la llegada temprana a un nuevo ecosistema desempeña un papel fundamental en la formación de la comunidad. Este proceso explica la influencia del tipo de parto en la composición inicial del microbioma infantil. Los estudios en grandes cohortes han identificado diferencias en el microbioma relacionadas con partos por cesárea que perduran durante meses después del nacimiento, lo que probablemente repercute en este período decisivo del desarrollo del anfitrión [5]. Algunas de estas para aumentar la absorción intestinal de nutrientes. El acetato representa la mayor parte de los ácidos grasos de cadena corta (AGCC) que se producen en el intestino del lactante, y está implicado en la prevención de infecciones por enteropatógenos [2]. Las bifidobacterias también intervienen en un proceso conocido como alimentación cruzada, en el que la producción de acetato y de lactato sirve como sustrato para el crecimiento de otras especies, como Roseburia, Eubacterium, Faecalibacterium, y Anaeroestipes, lo que favorece la diversidad del microbioma. Las especies de Bacteroides también pueden fermentar la leche materna, y son importantes productoras de propionato, un ácido graso de cadena corta. Las especies de Bacteroides también tienen una capacidad única para metabolizar los oligosacáridos derivados de la mucina [3]. Esta plasticidad metabólica les permite adaptarse a las condiciones intestinales fluctuantes entre comidas, así como tras el destete y la introducción de alimentos sólidos. Las especies de Bacteroides también son clave para la educación inmunitaria, pues constituyen una fuente importante de lipopolisacárido, un componente microbiano, además de propiciar el desarrollo diferencias son una menor abundancia de Bacteroides y de Bifidobacterium spp., así como una mayor presencia de especies potencialmente patógenas.
Además del tipo de parto, la disponibilidad y la abundancia de sustratos nutricionales impone un efecto determinante en el microbioma de los primeros años de vida. La leche materna contiene más de 10 g/L de oligosacáridos de leche materna (OLM), de los cuales los más abundantes son 2’-fucosil-lactosa (2’FL) y 3’fucosil-lactosa- N-hexosa (TF-LHN) [6]. La mayoría de los OLM son digeridos por bifidobacterias y Bacteroides spp. que los convierten en AGCC. Las bifidobacterias cuentan con un amplio repertorio de genes para la digestión de los OLM. En el intestino del lactante se suelen encontrar varias subespecies de B. longum, de las cuales B. longum subsp. infantis (B. infantis), B. longum subsp. longum (B. longum), y B. longum subsp. breve (B. breve) suelen encontrarse aisladas en las heces de lactantes sanos alimentados con leche materna, mientras que los lactantes alimentados con leche artificial suelen estar colonizados por B. adolescentis. De estas subespecies, B. infantis cuenta con el mayor repertorio para digerir todas las estructuras de OLM de la leche humana [7]. La leche materna también influye en la composición del microbioma del lactante mediante factores inmunitarios, como compuestos antimicrobianos (lactoferrina y lisozima), así como factores inmunitarios (IgAs, células inmunitarias y citocinas), que son fundamentales para la exclusión inmunitaria de microbios patógenos [1]. En particular, la menor abundancia de Bifidobacterium en bebés alimentados con leche artificial se asocia con una menor concentración de lactato, IgAs y un pH luminal del intestino más alto, en comparación con los alimentados con leche materna.
Además del tipo de parto y de la alimentación del lactante, existen otros factores que pueden influir el microbioma de los primeros años de vida, como el tabaquismo materno, el índice de masa corporal de la madre, la diabetes gestacional, el asma familia y el estrés [8]. Los mecanismos que subyacen a las asociaciones entre esos factores y el microbioma del lactante siguen sin estar claros, pero es probable que estén relacionados con modificaciones en el microbioma materno y su posterior transmisión vertical al lactante, así como un mayor riesgo de cesárea y menor éxito de la lactancia materna vinculados a muchos de estos factores. En general, los efectos individuales de factores como el tipo de parto, la toma de antibióticos y la lactancia materna, están relativamente bien caracterizados. Sin embargo, siguen sin comprenderse bien los efectos combinados de estas exposiciones.
¿La colonización se produce en el útero?
- Se ha detectado ADN microbiano en la placenta, en el líquido amniótico y en el meconio, lo que lleva a pensar en una colonización en el útero.
- La imposibilidad de cultivar los microbios detectados en el útero, el efecto sistemático del tipo de parto en el microbioma y la generación exitosa de animales axénicos a partir de embriones han conducido al consenso actual de que la colonización microbiana de los recién nacidos sanos empieza al nacer [15].
LA DISBIOSIS EN LOS PRIMEROS AÑOS DE VIDA COMO CAUSA DE ENFERMEDADES NO TRANSMISIBLES
Al ser un ecosistema joven, el microbioma de los primeros años es intrínsecamente menos resistente. La resistencia ecológica se refiere a la capacidad de un ecosistema de volver a su estado original tras una perturbación. Esto expone al microbioma del lactante a un riesgo más elevado de que se altere su trayectoria de manera permanente durante una etapa decisiva del desarrollo. La toma peri- y posnatal de antibióticos induce cambios drásticos en la composición y diversidad del microbioma del lactante, conocidos como disbiosis, lo que reduce la abundancia de bifidobacterias y la diversidad general del microbioma, al tiempo que aumenta las especies patógenas. Este efecto se observa incluso cuando solo se administran antibióticos a la madre durante un parto vaginal (para prevenir infecciones por el estreptococo del grupo B), y aumenta cuando se administran a los lactantes durante su primer año de vida, en función de la dosis [9]. En particular, incluso una sola tanda de amoxicilina administrada a lactantes redujo la abundancia de bifidobacterias durante varios meses, lo que pone de relieve la susceptibilidad de este importante grupo de bacterias a estos fármacos de uso habitual [10].
La exposición a los antibióticos durante la gestación o en la etapa previa al destete de los roedores puede agravar las respuestas inmunitarias alérgicas (IgE, linfocitos Th2 y Th17), la adiposidad y la obesidad, las respuestas autoinmunes y la colitis crónica [1]. Estas respuestas sistémicas a la disbiosis en los primeros años están en consonancia con los hallazgos epidemiológicos que asocian la toma de antibióticos en los primeros años de vida con numerosas enfermedades no transmisibles. Por ejemplo, una revisión sistemática y un metanálisis de 13 estudios identificaron una asociación dosis-efecto entre la toma de antibióticos y la obesidad, que oscilaba entre un aumento del riesgo del 11 % para los lactantes que recibieron solo una dosis, hasta un aumento del riesgo del 24 % con más de un tratamiento [9]. Más recientemente, una revisión sistemática y un metanálisis de 160 estudios que abarcaban más de 22 millones de niños, reveló importantes asociaciones entre el uso pediátrico de antibióticos y la dermatitis atópica, las alergias alimentarias, la rinoconjuntivitis alérgica, el asma, la artritis juvenil, la psoriasis y el trastorno del espectro autista [11].
Es muy complicado establecer la direccionalidad y la causalidad de los estudios epidemiológicos. Sin embargo, los resultados de los estudios preclínicos combinados con las asociaciones sistemáticas dosis-efecto entre la toma de antibióticos y el asma y la obesidad, en particular, respaldan la aplicación de medidas más estrictas para el uso racional de los antibióticos. Un estudio reciente en niños canadienses observó una disminución paralela en la incidencia de asma a medida que a escala de la población disminuían las prescripciones de antibióticos entre los años 2000 y 2014. Hay que señalar que la composición del microbioma con 1 año de edad intervino en la asociación entre la exposición a los antibióticos y el diagnóstico de asma a los cinco años [12]. Este importante estudio ofrece pruebas sólidas de una relación causal entre la toma de antibióticos y el asma en los humanos, y pone de relieve la necesidad de un consumo prudente de antibióticos como estrategia para reducir los índices de asma.
REPARACIÓN DE LA MICROBIOTA, ¿LO HEMOS CONSEGUIDO?
Las consecuencias negativas de la disbiosis en los primeros años de vida justifican la continuidad de las investigaciones, pero también la toma de medidas. La disminución de las tasas de cesáreas, de la alimentación con leche artificial y de la prescripción de antibióticos, aunque son un objetivo respetable, tienen un potencial limitado de ser estrategias exitosas, dadas las necesidades de la sociedad. Sin embargo, ha habido varios intentos de restauración del microbioma, con resultados dispares. Se han probado dos métodos de restauración del ecosistema en partos con cesáreas programadas: la siembra vaginal y el trasplante de microbiota fecal (TMF). La siembra vaginal consiste en impregnar la piel o la boca del recién nacido con secreciones vaginales tomadas de la madre. Los tres ensayos de siembra vaginal publicados actualmente han demostrado que este método no restaura la microbiota del parto por cesárea para obtener una microbiota que se asemeje a la de un parto vaginal [8]. En cambio, un TMF de madre a hijo (realizado una vez durante la primera toma de leche) fue suficiente para corregir el microbioma del parto por cesárea [13]. Sin embargo, aunque los autores realizaron un cribado patógeno en las muestras de TMF, esta controvertida práctica conlleva un riesgo de infección innecesario para un recién nacido que por lo demás está sano, y es poco probable que se convierta en una opción terapéutica.
La toma de prebióticos y probióticos puede ofrecer un método más práctico y viable para la restauración del microbioma, especialmente si se fundamenta en los estudios resumidos más arriba. Un estudio reciente ha demostrado que la reducción de bifidobacterias y de genes que utilizan OLM podría mejorarse mediante la combinación de una administración de una cepa de B. infantis y la lactancia materna [14]. Esta estrategia también redujo las respuestas proinflamatorias que derivan en alergia al cabo de un año, lo que demuestra la existencia de mecanismos inmunitarios beneficiosos a largo plazo. A pesar de todo, no hay pruebas suficientes que demuestren que las estrategias actuales de restauración del microbioma ayudarán a reducir las alarmantes tasas de ENT pediátricas.
Conclusión
El microbioma de los primeros años de vida es un componente integral de la salud infantil. Nuestro conocimiento de los patrones de la composición y de la funcionalidad de la colonización temprana, así como de los factores que refuerzan o perturban estos patrones ha aumentado considerablemente. En cambio, los mecanismos que explican cómo la disbiosis contribuye a la patogénesis de las enfermedades son poco conocidos. Las medidas fundamentadas en el funcionamiento del ecosistema para restablecer las especies del microbioma del lactante perdidas a causa de la toma de antibióticos, el parto por cesárea o la alimentación con leche artificial, así como sus sustratos nutricionales, pueden ser medidas eficaces. Sin embargo, las estrategias actuales de restauración del microbioma son insuficientes, y aún no se ha demostrado que sean eficaces para reducir el ries go de ENT. Este es el próximo paso decisivo para impulsar cambios en las políticas y prácticas médicas.
1. Laforest-Lapointe I, Arrieta MC. Patterns of Early-Life Gut Microbial Colonization during Human Immune Development: An Ecological Perspective. Front Immunol 2017; 8: 788.
2. Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature 2011; 469: 543-7.
3. Sonnenburg JL, Xu J, Leip DD, et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont. Science 2005; 307: 1955-9.
4. Telesford KM, Yan W, Ochoa-Reparaz J, et al. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes 2015; 6: 234-42.
5. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118: 511-21.
6. Thurl S, Munzert M, Boehm G, et al. Systematic review of the concentrations of oligosaccharides in human milk. Nutr Rev 2017; 75: 920-33.
7. Underwood MA, German JB, Lebrilla CB, et al. Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res 2015; 77: 229-35.
8. Korpela K, de Vos WM. Infant gut microbiota restoration: state of the art. Gut Microbes 2022; 14: 2118811.
9. Mc- Donnell L, Gilkes A, Ashworth M, et al. Association between antibiotics and gut microbiome dysbiosis in children: systematic review and meta-analysis. Gut Microbes 2021; 13: 1-18.
10. Korpela K, Salonen A, Saxen H, et al. Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatr Res 2020; 88: 438-43.
11. Duong QA, Pittet LF, Curtis N, et al. Antibiotic exposure and adverse long-term health outcomes in children: A systematic review and meta-analysis. J Infect 2022; 85: 213-300.
12. Patrick DM, Sbihi H, Dai DLY, et al. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children: evidence from population-based and prospective cohort studies. Lancet Respir Med 2020; 8: 1094-105.
13. Korpela K, Helve O, Kolho KL, et al. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell 2020; 183: 324-34.e5.
14. Henrick BM, Rodriguez L, Lakshmikanth T, et al. Bifidobacteria-mediated immune system imprinting early in life. Cell 2021; 184: 3884-98.e11.
15. Perez-Muñoz ME, Arrieta MC, Ramer-Tait AE, et al. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome 2017; 5: 48.