Définir la dynamique de la communauté vaginale : variations quotidiennes du microbiote, rôle des menstruations, des bactériophages, et des gènes bactériens
Auteure : Prof. ass. Ina Schuppe Koistinen
Département de Microbiologie et Biologie tumorale et cellulaire, Institut Karolinska, Stockholm, Suède
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Commentaires sur l’article de Hugerth et al. (Microbiote 2024)
Cette étude métagénomique de haute résolution étudie les transitions quotidiennes du microbiote vaginal au cours d’un cycle menstruel chez 49 jeunes femmes en bonne santé. En analysant les données taxonomiques, virales et les gènes fonctionnels d’échantillons quotidiens, les auteurs introduisent un système de classification dynamique appelé Dynamique de la communauté vaginale (DCV), qui catégorise les femmes en quatre groupes : eubiose constante, dysbiose constante, dysbiose liée aux menstruations et dysbiose instable. Ces profils reflètent la façon dont les microbiotes individuels réagissent aux menstruations, à l’activité sexuelle ainsi qu’à d’autres expositions, et démontrent que la santé vaginale ne peut être évaluée de manière adéquate à partir d’échantillons statiques uniquement. Il convient de noter que l’abondance des bactériophages et le contenu génétique bactérien (comme les bactériocines) peuvent contribuer à la stabilité ou à l’instabilité des communautés microbiennes. Ces travaux mettent en évidence la complexité et l’individualité du comportement du microbiote vaginal et ont des implications dans la perspective d’améliorer les diagnostics et la personnalisation de la prise en charge en gynécologie.
Que savons-nous déjà à ce sujet ?
Le microbiote vaginal joue un rôle clé dans la défense contre les pathogènes, le maintien de l’immunité mucosale et la santé reproductive. La dominance des espèces de Lactobacillus, et en particulier de L. crispatus, maintient un pH bas et inhibe la colonisation pathogène2. La dysbiose (définie par une perte de lactobacilles et une prolifération d’espèces anaérobies telles que Gardnerella ou Prevotella) est associée à des risques accrus de vaginose bactérienne (VB), de naissance prématurée3, d’infertilité4, d’infections sexuellement transmissibles, d’infections par le papillomavirus humain (HPV) et de cancers gynécologiques5. Des études antérieures ont révélé que les changements hormonaux, les menstruations et les rapports sexuels peuvent influencer la composition du microbiome vaginal6. Bon nombre de ces études reposaient sur un échantillonnage de faible fréquence et manquaient de résolution pour évaluer les fluctuations à court terme ou déterminer les facteurs de transition entre l’eubiose et la dysbiose. Les contributions de la dynamique virale et des gènes bactériens fonctionnels sont demeurées largement inexplorées.
Quels sont les principaux enseignements de l’étude ?
Cette étude introduit le concept de DCV, offrant un nouveau cadre pour classer le comportement du microbiome au fil du cycle menstruel. Contrairement aux types d’état communautaire (TEC), qui décrivent des compositions statiques du microbiome, les DCV englobent des schémas temporels susceptibles de mieux refléter la résilience et la vulnérabilité du microbiome. Les quatre DCV (eubiose constante, dysbiose constante, dysbiose liée aux menstruations et dysbiose instable) représentent des profils distincts de stabilité microbienne. Les femmes du groupe eubiose constante conservaient une dominance de Lactobacillus tout au long du cycle, tandis que celles qui présentaient une dysbiose constante avaient des communautés associées à la VB persistante. La dysbiose liée aux menstruations était caractérisée par des changements temporaires pendant les règles, avec souvent une inversion en milieu de cycle, tandis que le groupe instable connaissait des fluctuations brusques après des expositions telles que les rapports sexuels, ce qui suggère une plus grande fragilité écologique.
L’une des principales conclusions était que l’instabilité du microbiome vaginal est associée à une activité bactériophage accrue et à une prévalence plus élevée de L. iners. Cette espèce est souvent liée à des états transitionnels ou moins stables, et l’abondance des phages peut refléter des cycles lytiques actifs déstabilisant les bactéries dominantes par le biais d’une dynamique d’« élimination du vainqueur ». En outre, les femmes présentant une dysbiose transitoire présentaient une abondance accrue de pathogènes potentiels tels que Sneathia spp. pendant et après les règles, ce qui indique l’existence de périodes spécifiques de vulnérabilité.
L’analyse au niveau des souches a révélé des différences dans le contenu des gènes bactériens, y compris des bactériocines produites par Gardnerella leopoldii susceptibles d’inhiber les lactobacilles. Ces gènes étaient plus fréquents dans les DCV instables et dysbiotiques, ce qui corrobore la possibilité d’un rôle mécanique dans la structuration de la communauté. Même si ces résultats génétiques nécessitent une validation plus approfondie, ils soulignent l’importance d’aller audelà de la classification au niveau de l’espèce pour comprendre la fonction microbienne et son impact sur la santé de l’hôte.
Quelles sont les conséquences pour la pratique clinique ?
Cette étude souligne la nécessité de repenser la manière dont la santé vaginale est évaluée et surveillée dans la pratique clinique. La reconnaissance du caractère dynamique du microbiote vaginal (et de différences de stabilité marquées entre femmes) a des répercussions sur le diagnostic, l’évaluation du risque et les stratégies thérapeutiques. L’échantillonnage à un moment unique, en particulier pendant les règles, peut ne pas saisir les fluctuations significatives ou donner une image erronée de l’état microbien de référence d’une femme. Les cliniciens devraient envisager de prélever des échantillons à plusieurs moments du cycle pour mieux évaluer le comportement du microbiome, en particulier chez les patientes présentant des symptômes récurrents ou des problèmes de reproduction.
Les limites de la classification basée sur le TEC apparaissent clairement dans cette étude. Deux femmes présentant un même TEC peuvent présenter des DCV totalement différents, l’une avec une eubiose stable et l’autre avec une dysbiose fréquente. Intégrer l’évaluation de la DCV pourrait ouvrir la voie à des interventions plus personnalisées, telles que la recommandation d’un soutien prophylactique du microbiome pour les femmes présentant des profils instables ou le ciblage des fenêtres à haut risque (postmenstruelles, par exemple) pour le dépistage des infections.
L’identification de l’instabilité induite par les phages et des caractéristiques bactériennes au niveau de la souche permet d’envisager une médecine de précision. Les thérapies futures devront peut-être s’intéresser à la fonction microbienne (comme la formation de biofilms ou la production de bactériocines) plutôt qu’à la seule composition. La compréhension de la dynamique des bactériophages vaginaux pourrait également déboucher sur de nouvelles stratégies de stabilisation du microbiome.
Figure 1. Les séries chronologiques vaginales peuvent être classées en quatre catégories (Dynamique de la communauté vaginale) en fonction de leur proportion d’échantillons eubiotiques
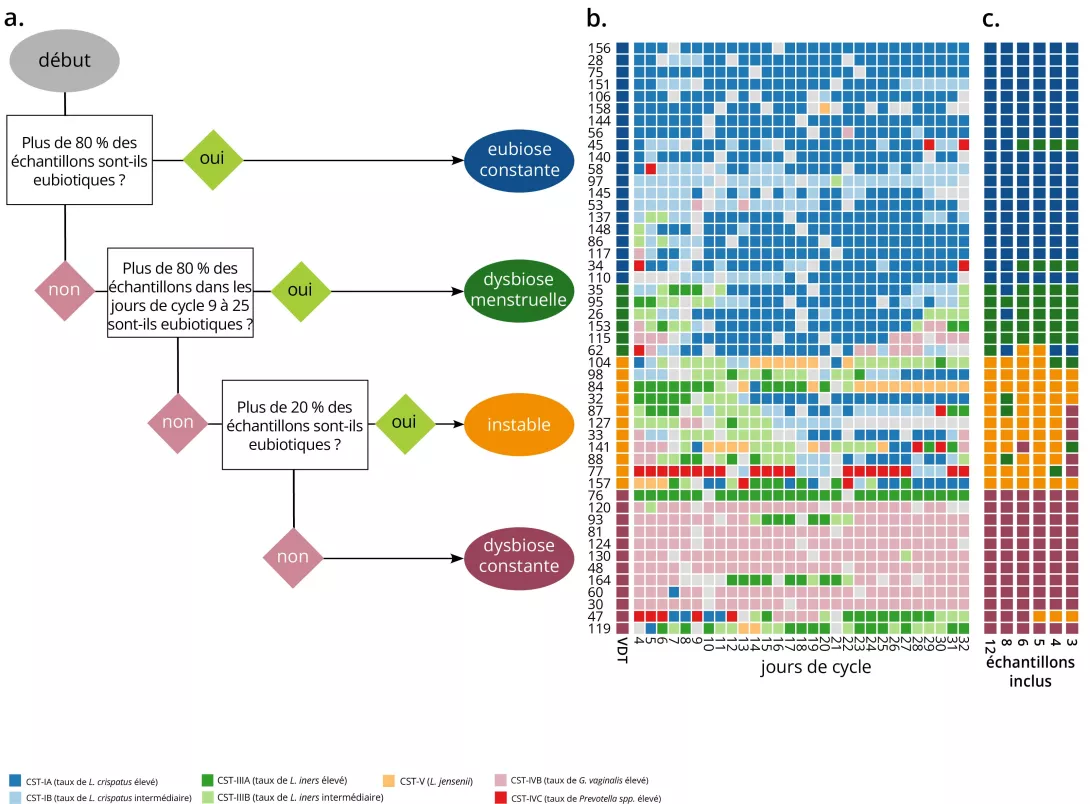
a. Un arbre de décision peut séparer une série temporelle d’échantillons en groupes dynamiques, sur la base des types d’état communautaire (TEC). Les informations fournies par l’utilisateur déterminent quels TEC sont considérés comme eubiotiques (ici : I, II et V) et quels jours doivent être considérés comme exempts de l’influence des menstruations (ici : du jour 9 au jour 25 du cycle). Les séries chronologiques comportant ≥ 80 % d’échantillons eubiotiques sont considérées comme un état d’eubiose constante ; à l’inverse, celles comportant > 80 % d’échantillons dysbiotiques sont considérées comme un état de dysbiose constante. Pour celles qui se situent dans la fourchette 20-80 %, une seconde évaluation a lieu les jours sans règles : si elles sont > 80 % eubiotiques, la série chronologique est considérée comme un état de dysbiose lié aux règles et, dans le cas contraire, comme un état instable (passant de l’eubiose à la dysbiose sans schéma temporel clair). b. Une carte en couleur avec un individu par rangée et un jour par colonne. La couleur de chaque intersection représente le TEC. Les barres colorées sur le côté gauche montrent la dynamique de la communauté vaginale de chaque femme. c. Des barres colorées supplémentaires montrent la dynamique de la communauté vaginale déduite pour chaque participante lorsque l’on utilise moins d’échantillons pour la classification. Reproduit de Hugerth LW, et al. Microbiome 2024, 12, 1531 (doi:10.1186/s40168-024-01870-5) sous licence a CC-BY 4.0 (creativecommons.org/licenses/by/4.0). Aucune modification n’a été apportée au graphique.
POINTS ESSENTIELS
- Le microbiome vaginal présente des profils individuels et dynamiques au cours du cycle menstruel susceptibles d’influer sur les résultats de reproduction.
- Une dysbiose transitionnelle ou instable est associée à un nombre plus élevé de phages, à une dominance de Lactobacillus iners et à des phases de risque accru.
- Les caractéristiques fonctionnelles au niveau de la souche, telles que la production de bactériocines, peuvent aider à expliquer les transitions vers et la persistance d’une dysbiose.
CONCLUSION
Cette étude représente une avancée significative dans notre compréhension du comportement du microbiome vaginal en déplaçant le focus des TEC statiques vers les profils communautaires dynamiques. En classant les femmes en quatre catégories de DCV, l’étude propose une nouvelle perspective pour évaluer la santé du microbiome et ses conséquences cliniques. Ces enseignements appellent à des approches plus personnalisées et davantage liées au facteur temps en matière d’échantillonnage, de diagnostic et d’intervention. L’intégration des données du virome et des caractéristiques fonctionnelles des bactéries peut permettre d’affiner davantage la prédiction du risque et les stratégies de traitement. En fin de compte, une compréhension plus approfondie de l’écologie du microbiome vaginal pourrait contribuer à réduire les complications telles que la vaginose bactérienne, les naissances avant terme et l’infertilité, et appuyer une norme de prise en charge plus individualisée de la santé reproductive des femmes.


