Microbiote vulvo-vaginal de la femme : quelle utilité dans la pratique clinique ?
Auteur : Dr Pedro Vieira Baptista
Hôpital Lusíadas Porto, Porto, Portugal ; département de gynécologie-obstétrique et pédiatrie, faculté de médecine de l’université de Porto ; faculté de médecine et des sciences de la santé, université de Gand, Gand, Belgique
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
Auteur
Malgré les connaissances encore limitées à son sujet, le microbiote vaginal humain est un monde fascinant. L’évolution a abouti à un scénario unique dans lequel la dominance de certaines espèces de lactobacilles constitue l’état optimal pendant les années de fertilité, en dépit d’une énorme variabilité interindividuelle, voire chez une même femme au fil du temps. Comprendre le microbiote vaginal et son potentiel est essentiel pour améliorer la santé des femmes dans des domaines tels que les infections sexuellement transmissibles et la vaginite récurrente. Autre élément, de la plus haute importance, il pourrait constituer la réponse à un problème qui n’a toujours pas trouvé de solution satisfaisante : le travail prématuré. Dans cet article, nous abordons la question du microbiote vaginal sous un angle évolutionnaire, en soulignant l’absence manifeste de continuum inter-espèces. Nous discutons de l’état actuel de la connaissance tout en mettant en exergue les possibilités futures.
Perspective historique
Le début du long périple menant à la compréhension du microbiote vaginal peut être attribué à Albert Döderlein, à la fin du 19e siècle. Dans son livre Das Scheidensekret und seine Bedeutung für das Puerperalfieber, il soulignait que les femmes « normales », en bonne santé, avaient un vagin dominé par des bacilles à Gram positif, qu’il nommait Lactobacillus acidophilus.
- L’étude du microbiome vaginal continue d’évoluer malgré les progrès considérables réalisés au cours des dernières décennies.
- Le microbiome vaginal optimal chez les femmes en âge de procréer est peu diversifié et dominé par les lactobacilles.
- L’absence de dominance du microbiome vaginal humain par les lactobacilles est associée à un risque accru d’infections sexuellement transmissibles, de cancer du col de l’utérus et d’issues obstétricales négatives.
- De futurs tests pourraient permettre un diagnostic plus précis de la vaginite et une évaluation du risque associé à des profils dysbiotiques spécifiques.
- Même si la recherche en matière de microbiome progresse rapidement, il est crucial de bien distinguer les tests expérimentaux de leurs applications cliniques pertinentes.
Ce concept continue de façonner les interprétations contemporaines du microbiote vaginal, mais la réalité est probablement bien plus complexe.
La compréhension de la vaginite est encore incomplète et sa prise en charge reste essentiellement empirique, alors qu’il s’agit d’une des causes les plus fréquentes de consultation médicale chez les femmes1.
En 2011, Ravel et al. ont publié un des articles les plus importants et les plus marquants pour la compréhension du microbiote vaginal humain. Dans cet article, ils démontraient qu’asymptomatique n’est pas synonyme de « normal » (conduisant du reste à la question de savoir ce qu’est un microbiote vaginal « normal », ou, de façon probablement plus précise, « optimal ») et qu’il y a des différences notables en fonction de l’appartenance ethnique2.
La diversité est la règle dans la nature, mais le vagin humain semble faire exception : le microbiote vaginal considéré comme « optimal » est dominé par une ou deux espèces de lactobacilles (faible diversité alpha). Si l’on pense à d’autres organes ou régions anatomiques, la dominance d’une espèce est généralement synonyme de maladie (infection). Si nous effectuons le même exercice en envisageant un système écologique quelconque, cela représente la dernière étape avant l’effondrement (ex. : les monocultures de plantes ne se rencontrent jamais dans la nature et, lorsqu’elles sont pratiquées artificiellement, elles doivent être limitées dans le temps). Il est possible de rechercher d’autres explications à cette apparente « anomalie » (ou « exception ») dans la nature, mais cela semble conduire à une impasse.
Devrions-nous plutôt changer de focale et étudier les pools génétiques plutôt que les espèces ou les genres pour surmonter cette apparente « anomalie » biologique ?
Le but ultime des êtres vivants semble être de transmettre leurs gènes aux générations suivantes, et l’évolution semble être largement mue par cet « instinct » primordial. On peut donc aisément présumer que le microbiote vaginal humain devrait être un élément clé du produit final de l’évolution pour optimiser le processus reproductif. Si cette prémisse est correcte, nous pouvons nous attendre :
- à une congruence évolutionnaire (comme cela a été mis en évidence, par exemple, dans l’intestin) ;
- au fait que toute différence devrait pouvoir s’expliquer plus ou moins facilement (processus d’accouplement, régime alimentaire, situation géographique, etc.) et, bien entendu,
- à un plus haut degré de similitude entre espèces étroitement apparentées.
Étonnamment, aucune de ces trois hypothèses ne se vérifie. Dans la nature, la phylogénie ne peut être liée au pH vaginal (un marqueur très indirect de la composition du microbiote vaginal), et la dominance des lactobacilles est unique à l’espèce humaine. Même si l’on compare les humains avec d’autres primates, les différences sont énormes et, à l’heure actuelle, difficiles à expliquer3,4.
Qu’est-ce qui a rendu le vagin humain si unique ? Était-ce le fruit d’événements aléatoires ou le corollaire évolutionnaire du cycle ovarien continu, du risque élevé de lacérations et d’infections à la naissance, ou encore de l’agriculture et de la consommation élevée d’amidon qui en découle3 ?
Microbiote et grossesse
Une question semble ne faire aucun doute : les lactobacilles sont essentiels au succès de la grossesse, mais celle de savoir s’il en va de même pour parvenir à une grossesse n’est pas aussi claire5.
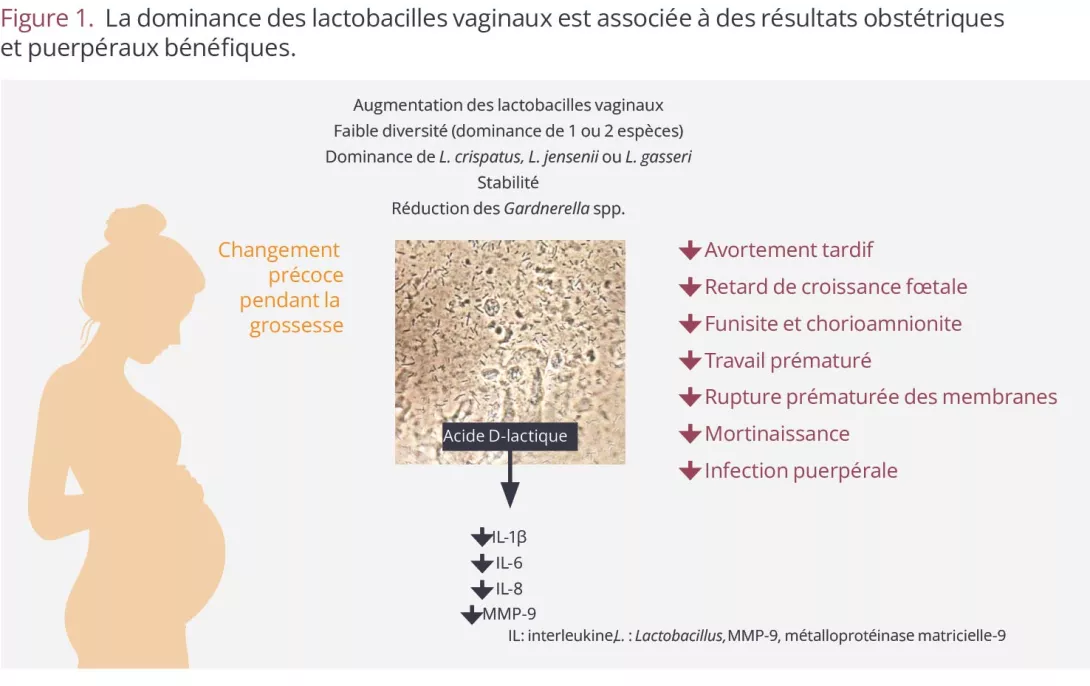
Les données disponibles montrent clairement qu’un vagin non dominé par les lactobacilles pendant la grossesse est associé à des résultats obstétricaux et puerpéraux négatifs, y compris un travail prématuré, une rupture prématurée des membranes et des infections puerpérales (Figure 1). Notons qu’un million de bébés meurent chaque année de complications liées à la prématurité6.
On a coutume de répéter que les lactobacilles ont un rôle protecteur et que leur présence est souhaitable, mais présumer cela revient à ignorer certaines évidences, telles que le fait que cette dominance ne se manifeste ni chez l’enfant, ni pendant l’allaitement, ni chez la femme ménopausée. On peut donc avancer l’hypothèse que notre relation symbiotique avec les lactobacilles est utile pendant les années de fécondité. On peut considérer que cet objectif inclut une réduction du risque d’infections sexuellement transmissibles (IST, qui constituent un risque pour le succès de la reproduction et pour la progéniture), d’infections génitales ascendantes (et donc d’avortement, de mortinatalité et de naissance avant terme), ainsi que de complications puerpérales. Le rôle du microbiote dans l’obtention d’une grossesse semble plus limité. Par exemple, les populations présentant des taux élevés de dysbiose vaginale ne semblent pas être moins fertiles7.
Figure 1. La dominance des lactobacilles vaginaux est associée à des résultats obstétriques et puerpéraux bénéfiques.
Pareillement, l’impact du microbiote cervicovaginal sur le résultat des traitements de fertilité n’est pas clair non plus5.
Une des plus grandes différences évolutionnaires entre les humains et les autres mammifères est liée à l’accouchement, à savoir le difficile équilibre entre le fait de naître avec un large périmètre céphalique et de négocier cet accouchement avec un bassin qui a dû s’adapter à la bipédie. Les humains ont les accouchements les plus difficiles, n’étant peut-être dépassés que par les hyènes. Ceci peut-il être la clé permettant de comprendre l’unicité du microbiote vaginal humain ? Quelle que soit la raison évolutive, pour la plupart des femmes en âge de procréer, même en dehors de la grossesse, la dominance des lactobacilles dans le vagin est l’état souhaitable. Cependant, un déficit en lactobacilles, même s’il représente un état dysbiotique, n’est pas synonyme de maladie.
Notre compréhension du rôle du microbiote vaginal demeure très limitée. Même des questions apparemment simples, telles que la manière dont les lactobacilles colonisent le vagin, n’ont pas encore de réponse claire.
Le microbiome vulvovaginal à l’état sain et à l’état pathologique
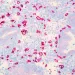
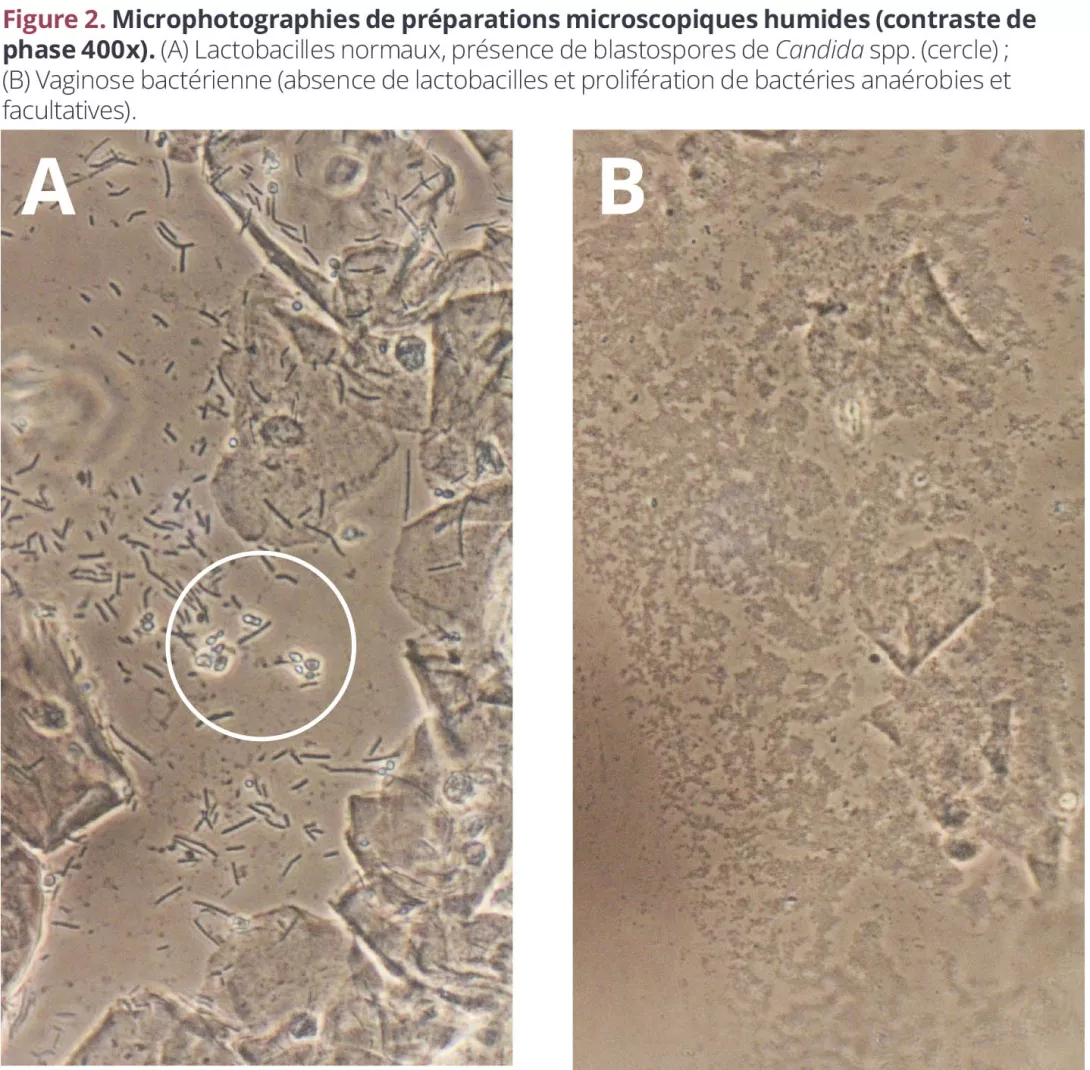
L’effet le plus manifeste d’un microbiome altéré est la vaginite. La plupart des femmes connaîtront au moins un épisode de candidose dans leur vie et, au sein de certaines populations, plus de la moitié des femmes en âge de procréer présentent une vaginose bactérienne (VB), asymptomatique la plupart du temps (figures 2A et 2B). Notre compréhension des causes de ces changements (« normal » – colonisation/état asymptomatique – symptomatique) est limitée8.
Figure 2. Microphotographies de préparations microscopiques humides (contraste de phase 400x)
(A) Lactobacilles normaux, présence de blastospores de Candida spp. (cercle) ; (B) Vaginose bactérienne (absence de lactobacilles et prolifération de bactéries anaérobies et facultatives).
Le microbiome vaginal peut induire différents profils de risque ou de protection.
Toutefois, le profil bactérien du vagin, indépendamment des symptômes, peut conférer différents profils de risque ou de protection. De manière générale, on considère que les Lactobacillus spp. ont tendance à être bénéfiques pour la santé. Néanmoins, toutes les espèces ne sont pas égales et seul un nombre limité d’espèces existantes se trouvent généralement à l’état dominant dans le vagin. L. iners, qui présente un génome nettement plus petit et un profil métabolique différent, est généralement associé à des états dysbiotiques ou transitionnels9.
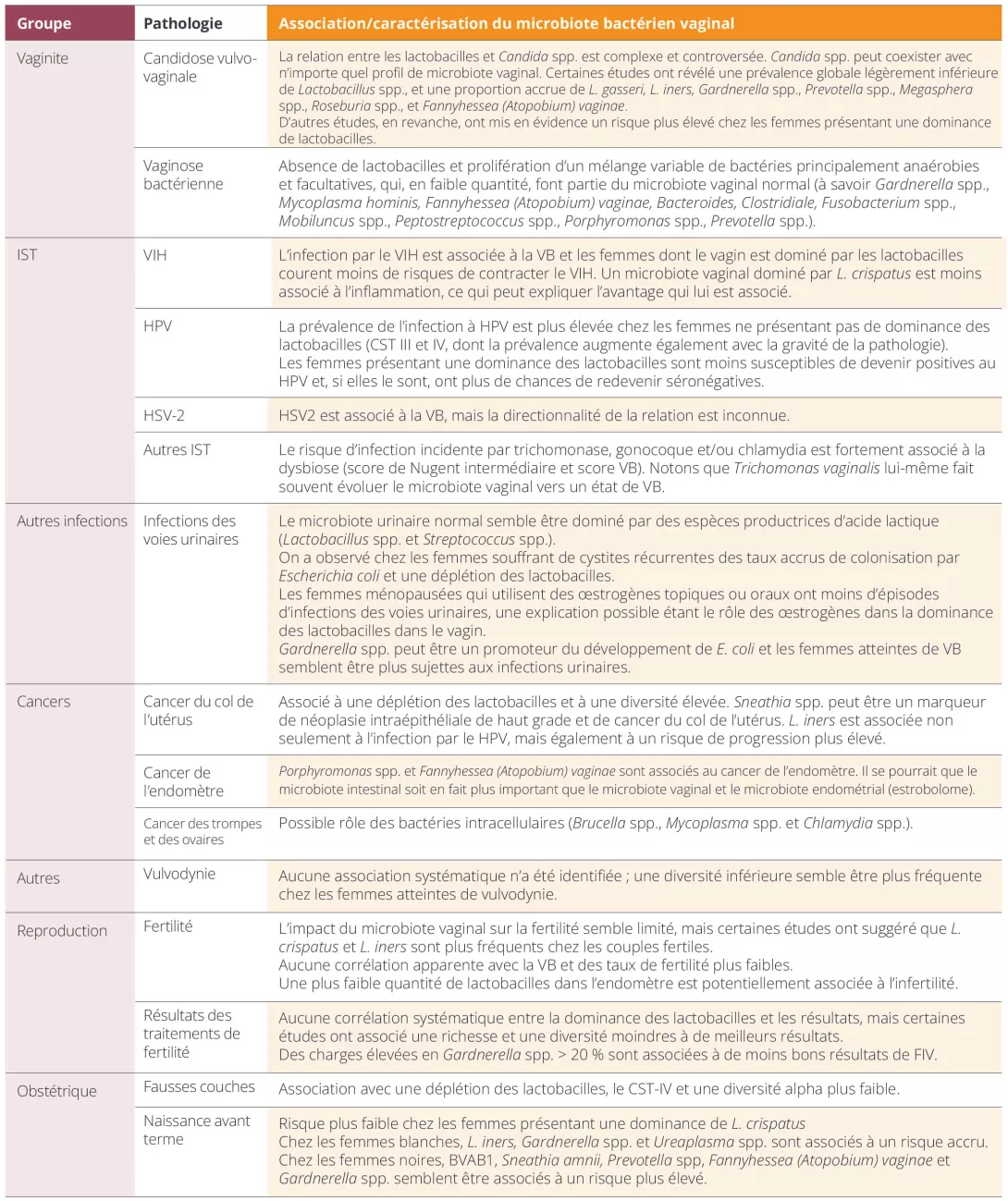
Tableau 1. Pathologies gynécologiques et obstétricales et leurs associations avec le microbiome vulvovaginal.
On sait peu de choses sur la relation entre Candida spp. et le microbiome vaginal.
Malgré l’absence actuelle de recommandations de traitement pour les dysbioses asymptomatiques (la VB, par exemple), celles-ci ont été associées à des complications obstétricales et non obstétricales (dont le risque de contracter des IST [HPV, VIH])8 (Tableau 1).
Lorsque des stratégies efficaces (de préférence non antibiotiques) seront disponibles, il pourrait être judicieux de dépister et de traiter la dysbiose chez les femmes présentant un risque accru d’IST ou même chez celles qui sont infectées par le HPV. Cela peut toutefois s’avérer plus complexe qu’il n’y paraît. Le comportement de la VB similaire à celui d’une IST est reconnu depuis longtemps, mais des données récentes l’ont confirmé et suggèrent que la réduction des récidives pourrait nécessiter le traitement des partenaires, ce qui pourrait constituer un obstacle important aux stratégies de prévention10.
La VB est un syndrome courant, impliquant une déplétion des lactobacilles et une prolifération de plusieurs bactéries anaérobies strictes et facultatives, associées à la formation d’un biofilm qui semble contribuer aux fréquentes rechutes après traitement. La composition de la VB est variable d’une femme à l’autre, et probablement même chez une seule et même femme au fil du temps11. Il est actuellement possible de diagnostiquer la VB à l’aide de tests moléculaires, mais on s’attend à ce qu’avec la connaissance croissante du microbiome vaginal, ces tests permettent le « profilage » de la VB, l’évaluation du résistome et un choix thérapeutique plus rationnel8.
La relation entre Candida spp. et le microbiome vaginal est très complexe et loin d’être entièrement comprise. Bien que la candidose puisse exister avec n’importe quel microbiome vaginal, elle tend à être plus courante avec une dominance des lactobacilles (et le pH faible qui en découle)12.
Plusieurs pathologies gynécologiques ont été associées à des caractéristiques spécifiques du microbiome et, quasi systématiquement, une réduction des lactobacilles induit un risque accru d’IST et de cancers gynécologiques (même du tractus génital supérieur). Il n’est cependant pas toujours facile d’établir une relation de cause à effet entre les anomalies du microbiome et les pathologies spécifiques. Nous pouvons toutefois espérer qu’un jour, nous pourrons évaluer ou moduler le risque de cancer grâce à l’évaluation du microbiome vaginal, en particulier pour le cancer du col de l’utérus13.
L’intérêt et la connaissance du microbiote vulvaire sont plus récents et les données sont rares, mais son rôle dans des pathologies telles que la vulvodynie, les dermatoses vulvaires, la néoplasie intraépithéliale vulvaire et le cancer est à l’étude14-16.
Vers quoi se dirige-t-on ?
La compréhension du microbiome vulvo-vaginal progresse à pas de géant. En attendant de comprendre totalement le microbiome, on peut commencer par le respecter, lui et son rôle fonctionnel, reconnaître que chaque femme est unique (et que cette unicité est évolutive), éviter le recours inutile aux antibiotiques et aux antiseptiques, et diagnostiquer correctement les IST et les vaginites, plutôt que de s’en remettre à l’empirisme. Un diagnostic précis permettra de réduire autant que possible les traitements erronés, avec un impact potentiel à long terme.
À ce stade, il est crucial de distinguer ce qui est expérimental de ce qui est cliniquement pertinent. Nous nous trouvons dans un processus d’apprentissage et tentons d’utiliser des techniques et des concepts expérimentaux dans la pratique clinique qui conduisent souvent à des tests, des dépenses et des traitements inutiles (la métagénomique, par exemple, est un outil de recherche très utile, mais elle n’a actuellement aucune place dans l’évaluation clinique de la vaginite).
Au cours des deux dernières décennies, nous avons accumulé une quantité considérable d’informations qui se traduiront bientôt par une amélioration des soins de santé pour les femmes, avec des recommandations diététiques spécifiques et des pré- et probiotiques. Nous pouvons nous attendre à ce que ces connaissances permettent de réduire considérablement le travail prématuré, les cancers gynécologiques, ainsi que la récurrence de la vaginite et de la cystite.
Les prochains chapitres seront sans nul doute les plus passionnants !
CONCLUSION
La compréhension du microbiome vaginal humain est encore incomplète et certaines de nos hypothèses actuelles pourraient devoir être actualisées ou adaptées à mesure que de nouvelles données apparaissent. Sa compréhension totale et le potentiel de manipulation pourront être dévoilés quand l’absence apparente de logique évolutionnaire sera complètement comprise.
Nous pouvons cependant être certains que les lactobacilles sont bénéfiques pour la plupart des femmes en âge de procréer et qu’ils ont une importance fondamentale dans la réussite de la grossesse, indépendamment de la géographie ou de l’ethnicité.
La connaissance croissante dans ce domaine conduit à des progrès dans le diagnostic et la prise en charge de la vaginite et, dans un avenir proche, elle permettra de réduire le risque de problèmes graves, tels que les IST et le travail prématuré.