¿Cómo puede ayudar la microbiota vaginal femenina en la práctica clínica?
por Dr. Pedro Vieira Baptista
Hospital Lusíadas Porto, Porto, Portugal; Departamento de Ginecología, Obstetricia y Pediatría, Facultad de Medicina de la Universidad de Oporto; Facultad de Medicina y Ciencias de la Salud, Universidad de Gante, Gante, Bélgica
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
El mundo de la microbiota vaginal humana es fascinante, a pesar del limitado conocimiento que se tiene sobre ella. La evolución nos ha llevado a un escenario en el que el predominio de ciertas especies de lactobacilos es el estado ideal durante la edad reproductiva, a pesar de las grandes variaciones interindividuales e incluso en la misma mujer a lo largo del tiempo. Entender el microbioma vaginal y su potencial es la clave para mejorar la salud femenina en áreas como las infecciones de transmisión sexual y la vaginitis recurrente. Además, y lo que es crucial, podría ser la respuesta a un problema para el que no ha habido respuestas satisfactorias hasta ahora: el parto prematuro. En este artículo, hablaremos sobre el microbioma vaginal a través de una visión evolutiva, destacando la aparente falta de continuidad entre especies. Hablaremos sobre el conocimiento actual, pero también nos centraremos en las posibilidades futuras.
Perspectiva histórica
El comienzo de un largo camino hacia el conocimiento del microbioma vaginal puede atribuirse a Albert Döderlein, a finales del siglo XIX. En su libro Das Scheidensekret und seine Bedeutung für das Puerperalfieber señala que las mujeres «normales» y saludables tienen su microbiota vaginal dominada por bacilos Grampositivos, a los que nombró Lactobacillus acidophilus.
- El estudio del microbioma vaginal sigue evolucionando a pesar del enorme progreso de las últimas décadas.
- El microbioma vaginal humano óptimo en mujeres en edad reproductiva está dominado por lactobacilos.
- No presentar predominio de lactobacilos en el microbioma vaginal humano se asocia con un aumento del riesgo de infecciones de transmisión sexual, cáncer de cuello de útero y resultados obstétricos negativos.
- Futuros exámenes podrían permitirnos proporcionar un diagnóstico más preciso de vaginitis y la evaluación del riesgo asociado a perfiles disbióticos específicos.
- Mientras la investigación del microbioma avanza rápidamente, es importante distinguir entre exámenes de investigación y sus aplicaciones clínicas relevantes.
Este concepto todavía moldea las interpretaciones contemporáneas del microbioma vaginal, pero la realidad es probablemente mucho más compleja.
La vaginitis todavía no se comprende por completo y su tratamiento es mayoritariamente empírico, a pesar de ser una de las causas más comunes de las mujeres para pedir atención médica1.
En 2011, Ravel et al. publicó uno de los artículos más importantes y que han cambiado la forma de pensar a la hora de entender el microbioma vaginal humano. En ese artículo se demostraba que asintomático no es sinónimo de «normal» (llevándonos también a la pregunta de qué es un microbioma vaginal «normal» o, probablemente más acertado, «ideal») y que existen notables diferencias dependiendo de la etnia2.
La diversidad es la norma en la naturaleza, pero la vagina humana parece una excepción: lo aceptado como microbioma vaginal «ideal» viene determinado por una o dos especies de lactobacilos (baja diversidad alfa). Si pensamos en otros órganos o regiones anatómicas, el predominio de una especie suele ser sinónimo de enfermedad (infección). Si realizamos el mismo ejercicio considerando cualquier sistema ecológico, esta representa el último paso antes del colapso (por ejemplo, los monocultivos de plantas no ocurren nunca en la naturaleza y, cuando se llevan a cabo de forma artificial, se deben limitar en el tiempo). Podemos buscar más explicaciones para esta aparente «anomalía» (o excepción) en la naturaleza, pero parece que nos deja en un punto muerto.
¿Deberíamos entonces cambiar el foco de nuestra perspectiva e investigar acervos genéticos en vez de especies o géneros para afrontar esta aparente anomalía biológica?
El objetivo final de los seres vivos es pasar los genes a las siguientes generaciones y la evolución parece muy motivada por este «instinto» primitivo. Por lo tanto, podemos asumir fácilmente que el microbioma vaginal humano debe ser una parte crucial del producto final de la evolución para optimizar el proceso reproductivo. Si esta premisa es correcta, podemos esperar:
- congruencia evolutiva (como se ha demostrado, por ejemplo, con la microbiota intestinal);
- cualquier diferencia debe explicarse más o menos con facilidad (proceso de apareamiento, dieta, localización geográfica, etc.) y con naturalidad
- mayor similitud en especies estrechamente relacionadas.
Sorprendentemente, ninguna de estas tres premisas se cumple. En la naturaleza, la filogenia no puede relacionarse con el pH vaginal (un indicador muy indirecto de la composición del microbioma vaginal) y el predominio de lactobacilos es algo exclusivo en la especie humana. Incluso cuando comparamos los humanos con otros primates, las diferencias son enormes y, actualmente, no se pueden explicar fácilmente3,4. ¿Qué hace que la vagina humana sea tan singular? ¿Es fruto de eventos aleatorios o de una consecuencia evolutiva del ciclo ovárico continuo, del alto riesgo de laceraciones e infecciones en el parto o de la agricultura y el consecuente consumo de almidón3?
Microbioma y embarazo
Está claro que los lactobacilos son fundamentales para quedarse embarazada, pero no lo es tanto si aplicamos lo mismo una vez se consigue la gestación5.
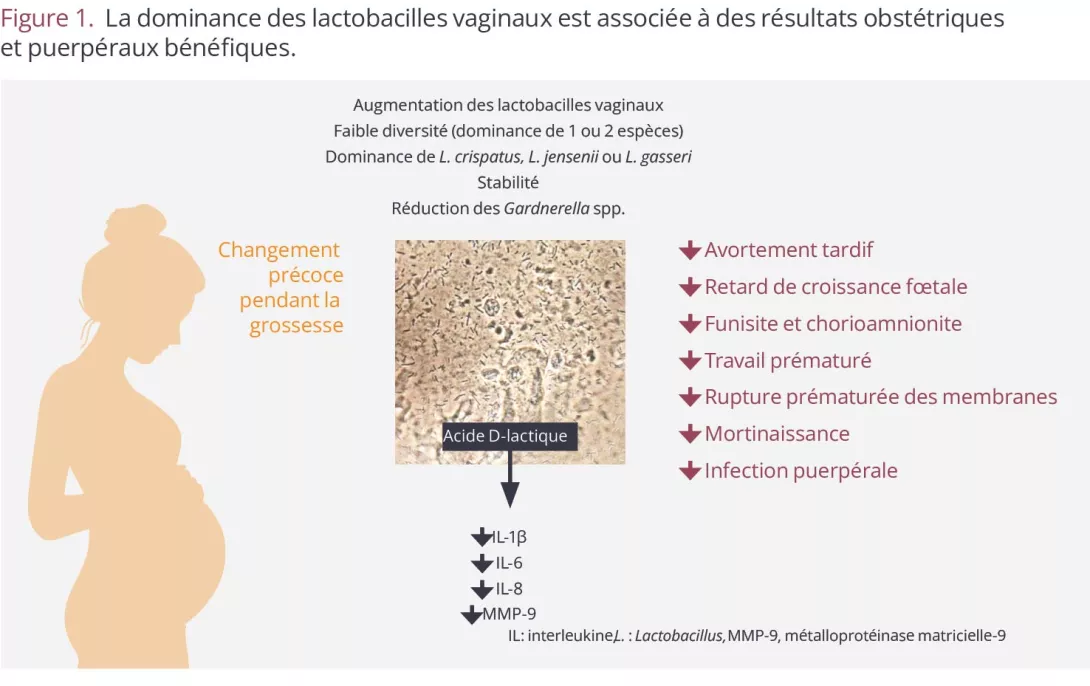
Los datos disponibles muestran claramente que no presentar un predominio de lactobacilos en la vagina durante el embarazo está relacionado con resultados obstétricos y puerperales negativos, incluidos parto prematuro, ruptura prematura de las membranas e infecciones posparto (Figura 1). Es importante destacar que un millón de bebés muere cada año por complicaciones relacionadas con la prematuridad6.
Solemos repetir que los lactobacilos tienen un papel protector y que su presencia es deseable, pero asumirlo significa que debemos ignorar algunos hechos evidentes, como que este predominio no ocurre en niños, ni durante el amamantamiento ni en mujeres posmenopáusicas. Por lo tanto, podemos suponer que nuestra relación simbiótica con los lactobacilos tiene una finalidad durante la edad reproductiva. Podemos considerar que esta finalidad incluye una reducción en el riesgo de infecciones de transmisión sexual (ETS) (que supone un riesgo para el éxito de la reproducción y los hijos), de infección del tracto genital superior (y como consecuencia, aborto, muerte fetal y parto prematuro), así como complicaciones posparto. El papel del microbioma a la hora de conseguir un embarazo parece más limitado.De hecho, las poblaciones con mayores tasas de disbiosis vaginal no parecen ser menos fértiles7.
Figura 1. El predominio de lactobacilos vaginales está relacionado con resultados obstétricos y de posparto favorables.
De la misma forma, el impacto del microbioma cervicovaginal en el resultado de los tratamientos de fertilidad tampoco está claro5.
Una de las mayores diferencias entre los humanos y otros mamíferos tiene que ver con el parto– el difícil equilibrio entre nacer con un perímetro cefálico grande y tener que pasar por una pelvis que tuvo que adaptarse al bipedismo. Los humanos tienen los partos más difíciles, probablemente solo superado por el de las hienas. ¿Puede que sea esta la clave para entender la singularidad del microbioma vaginal humano? Cualquiera que fuera la finalidad evolutiva, para la mayoría de mujeres en edad reproductiva, incluso sin embarazo, el predominio de lactobacilos en la vagina es conveniente. Sin embargo, la falta de lactobacilos, a pesar de que representa una disbiosis, no es sinónimo de enfermedad.
Nuestro conocimiento del papel de la microbiota vaginal sigue siendo muy limitado. Hasta las preguntas que parecen sencillas, como por ejemplo cómo pueden colonizar los lactobacilos la vagina, aún no tienen una respuesta clara.
El microbioma vaginal en estado sano y enfermo
El efecto más evidente de un microbioma alterado es la vaginitis. La mayoría de las mujeres sufrirán al menos un episodio de candidiasis en su vida y, en algunas poblaciones, más de la mitad de mujeres en edad fértil padecen vaginosis bacteriana (VB), la mayoría de las veces asintomática (figuras 2A y 2B). Tenemos un conocimiento limitado sobre lo que lleva a estos cambios («normal»- colonización/estado asintomáticosintomático)8.
Figura 2. Microfotografías de preparaciones microscópicas en fresco (contraste de fases 400x)
(A) Lactobacilos normales, presencia de blastosporas de Candida spp. (en el círculo); (B) Vaginosis bacteriana (ausencia de lactobacilos y exceso de bacterias anaerobias y facultativas).
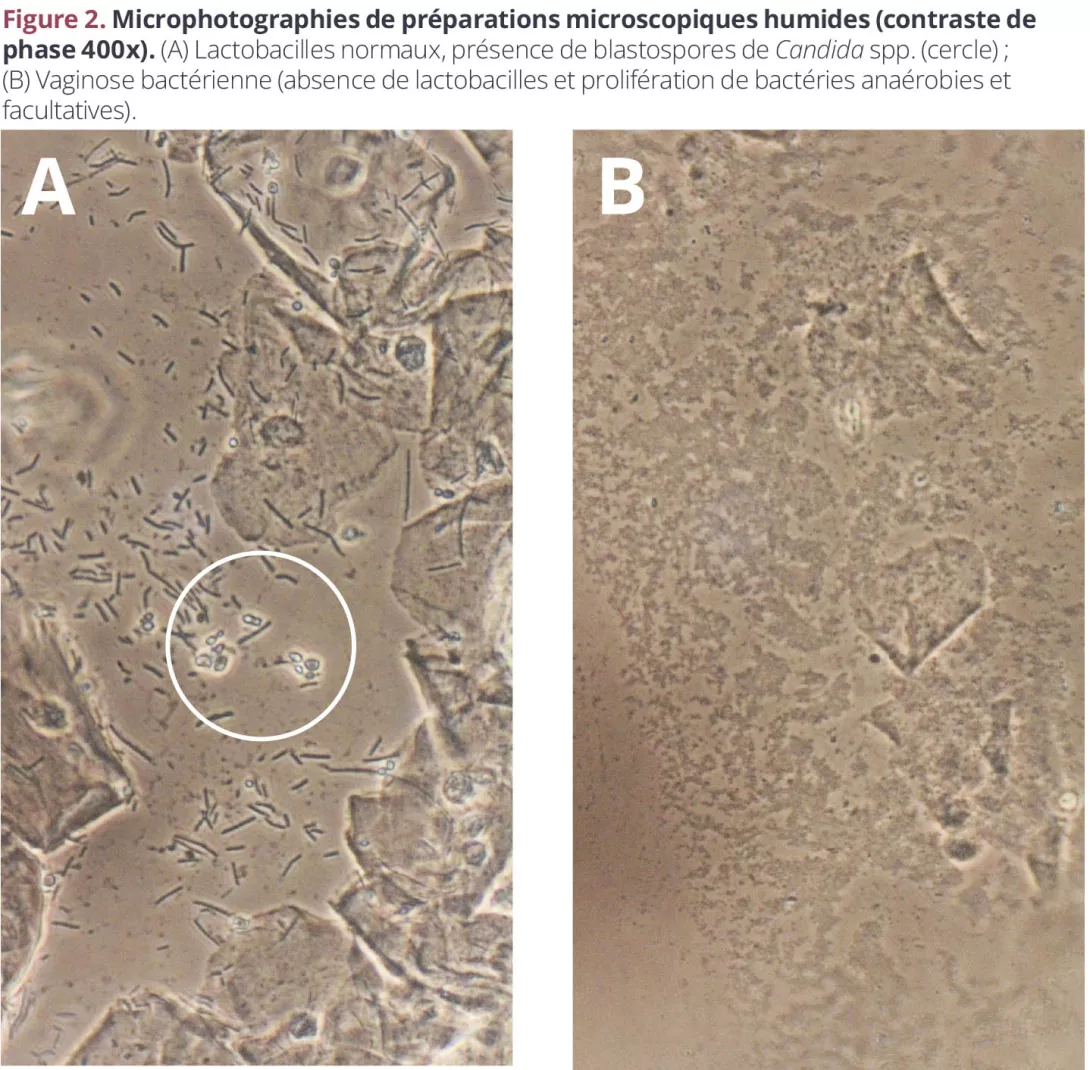
El microbioma vaginal puede proporcionar diferentes perfiles de riesgo o de protección.
Sin embargo, el perfil bacteriano de la vagina, independientemente de los síntomas, puede proporcionar diferentes perfiles de riesgo o de protección. En general, se considera que los Lactobacillus spp. suelen proporcionar beneficios para la salud. No obstante, no todas las especies son iguales y solo un número limitado de especies existentes predominan en la vagina. L. iners, con un genoma significativamente más pequeño y un perfil metabólico diferente, se asocia normalmente con estados de disbiosis o transición9.
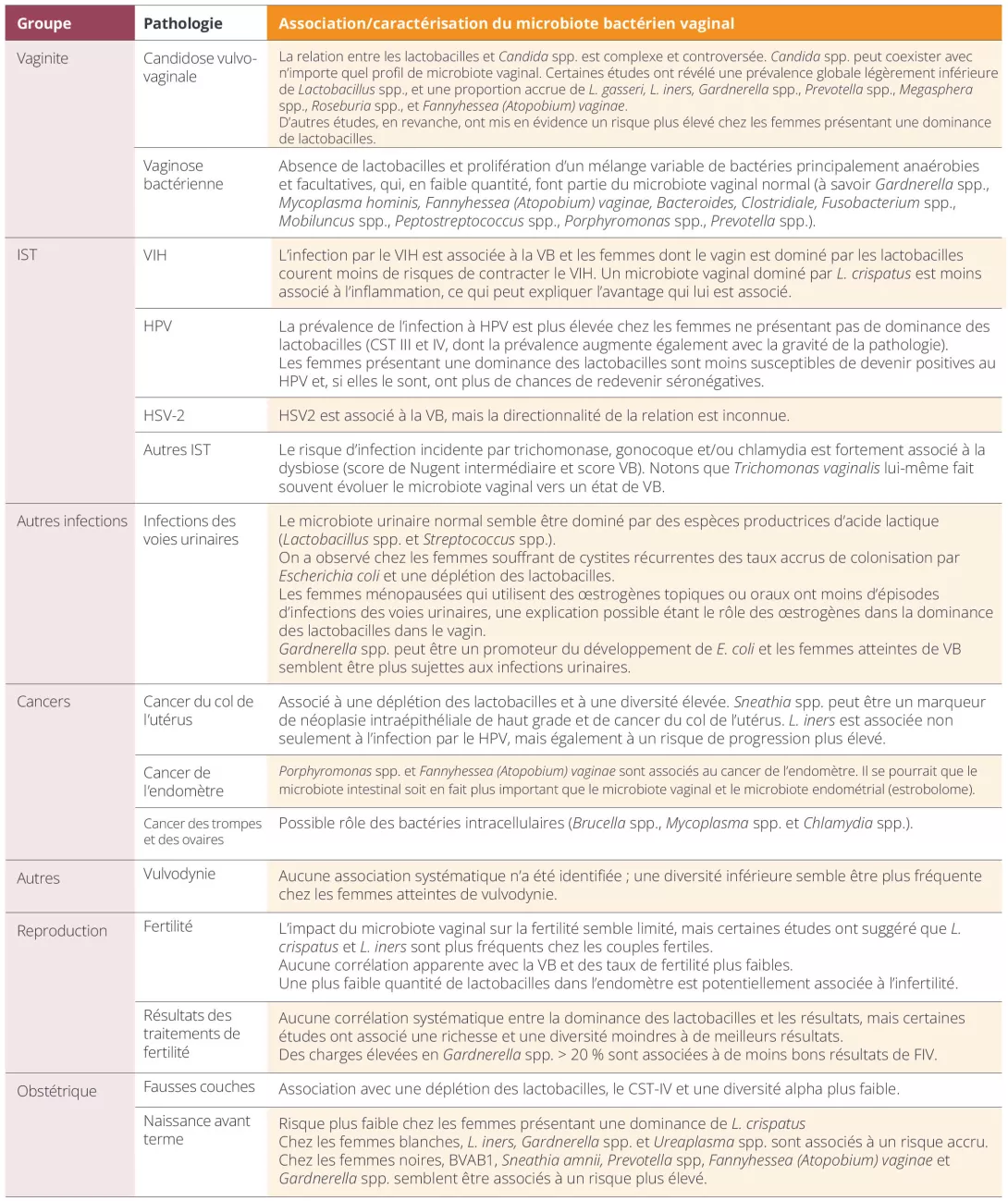
Tabla 1. Condiciones ginecológicas y obstétricas y sus asociaciones con el microbioma vaginal.
Poco se sabe sobre la relación entre Candida spp. y el microbioma vaginal.
A pesar de que actualmente no hay recomendaciones para tratar disbiosis asintomáticas (por ejemplo, VB), esta ha asociado con complicaciones obstétricas y no obstétricas (incluso el riesgo de contraer ITS [VPH, VIH])8 (Tabla 1).
Una vez que existen estrategias eficaces (de preferencia no antibióticas), sería recomendable realizar un cribado y tratar la disbiosis cuando haya mayor riesgo de ETS o incluso en las mujeres infectadas con VPH. Sin embargo, puede resultar más complejo de lo que parece. El comportamiento de la VB parecido al de una ETS se conoce hace tiempo, pero datos recientes lo han confirmado, así como también sugieren que la reducción de las recurrencias puede necesitar el tratamiento de las parejas, lo que supone un gran obstáculo para las estrategias de prevención10.
La VB es un síndrome común, en el que hay un reducido número de lactobacilos y un sobrecrecimiento de gran cantidad de bacterias anaerobias estrictas y facultativas, asociadas con la formación de una biopelícula que parece contribuir a las frecuentes recaídas después del tratamiento. La composición de la VB varía de mujer a mujer y, probablemente, hasta en la misma mujer con el paso del tiempo11. Actualmente, es posible diagnosticar VB usando test moleculares, pero se espera que con un mayor conocimiento del microbioma vaginal, estos tests permitan «perfilar» la VB, la evaluación del resistoma y una elección de tratamientos más racionaL8.
La relación entre Candida spp. y el microbioma vaginal es muy complejo y está lejos de ser completamente entendido. Aunque la candidiasis puede existir en cualquier microbioma vaginal, suele ser más común cuando existe un predominio de lactobacilos (y, por ende, un bajo pH)12.
Se han asociado diversas condiciones ginecológicas con características específicas del microbioma y es casi sistemático que un reducción en el número de lactobacilos proporciona un aumento del riesgo de ETS y cánceres ginecológicos (incluso del tracto genital superior). Sin embargo, la relación causal entre las alteraciones del microbioma y las condiciones específicas no siempre resulta clara. Podemos, sin embargo, un día esperar evaluar o reducir el riesgo de cáncer mediante la evaluación del microbioma vaginal– especialmente en el cáncer de cuello de útero13.
El interés y conocimiento sobre el microbioma vaginal es más reciente y los datos son escasos, pero se está estudiando su papel en entidades como la vulvodinia, la dermatosis vulvar, la neoplasia vulvar intraepiteliar y el cáncer14-16.
¿Qué es lo siguiente?
Se están dando pasos de gigante en el conocimiento del microbioma vaginal. Hasta entender completamente el microbioma, podemos empezar por respetarlo y su papel funcional, reconociendo que cada mujer es única (y esa singularidad es mutable), evitando el uso innecesario de antibióticos y antisépticos, y diagnosticando adecuadamente las ETS y la vaginitis, en vez de confiar en el empirismo. Un diagnóstico acertado reducirá tratamientos incorrectos, con un potencial impacto a largo plazo.
En esta fase, es importante diferenciar qué está en investigación y qué es relevante clínicamente. Estamos en un proceso de aprendizaje e intento de usar técnicas experimentales y conceptos en la práctica clínica que llevan a exámenes, gastos y tratamientos innecesarios, de hecho, la metagenómica es una herramienta de investigación muy útil, aunque actualmente no tiene lugar en la evaluación clínica de la vaginitis.
En las dos últimas décadas, hemos acumulado una enorme cantidad de información, que pronto se traducirá en mejor sanidad para las mujeres, incluyendo recomendaciones dietéticas específicas y prey probióticos. Podemos esperar que este conocimiento reducirá los casos de parto prematuro, cánceres ginecológicos así como de recurrencia de la vaginitis y la cistitis.
¡Sin duda, los siguientes capítulos serán los más emocionantes!
CONCLUSIÓN
El microbioma vaginal humano todavía no se entiende completamente y algunas de las hipótesis actuales pueden necesitar actualizaciones o adaptarse a medida que aparecen nuevos datos. Su entendimiento total y el potencial para manipularlo puede desentrañarse una vez que la aparente falta de lógica evolutiva se conoce completamente.
Sin embargo, podemos estar seguros de que los lactobacilos son beneficiosos para la mayoría de mujeres en edad reproductiva y son fundamentales para el éxito del embarazo, sin importar la geografía ni la etnia.
El creciente conocimiento en este ámbito está llevando al avance en el diagnóstico y tratamiento de la vaginitis y, en el futuro próximo, permitirá reducir el riesgo de problemas graves, como las ETS y el parto prematuro.