Diálogo entre la microbiota intestinal y las respuestas inmunitarias del anfitríon para luchar contra las infecciones
Síntesis
Por la Dra. Dorota Czerucka
iBiología médica, Equipo de ecosistemas e inmunidad, Centro científico de Mónaco, Mónaco
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
Los seres vivos han evolucionado desde hace millones de años en entornos complejos ocupados por ecosistemas microbianos, lo que los ha llevado a forjar relaciones simbióticas reguladas por el sistema inmunitario. Las nuevas técnicas de secuenciación han revolucionado nuestros conocimientos y nos han permitido poner de relieve que cada individuo alberga una microbiota propia, así como su función en la fisiología del anfitrión y en numerosa s enfermedades, como las infecciones. El diálogo entre la microbiota intestinal y el sistema inmunitario comienza desde la vida fetal. La organización específica de la microbiota –separada del anfitrión por una monocapa celular– supone un notable desafío para el sistema inmunitario, cuya función es reconocer lo «ajeno» como un posible signo de infección para iniciar las respuestas inmunitarias en cadena. Por consiguiente, los intercambios continuos con la microbiota tienen un impacto considerable en el sistema inmunitario del anfitrión. La respuesta inmunitaria, que debe tolerar a la microbiota, también afecta a la composición y la función de la microbiota. Así, los intercambios bidireccionales y constantes entre estas dos entidades moldean tanto la inmunidad del anfitrión como la microbiota intestinal para proteger de infecciones y de numerosas patologías.
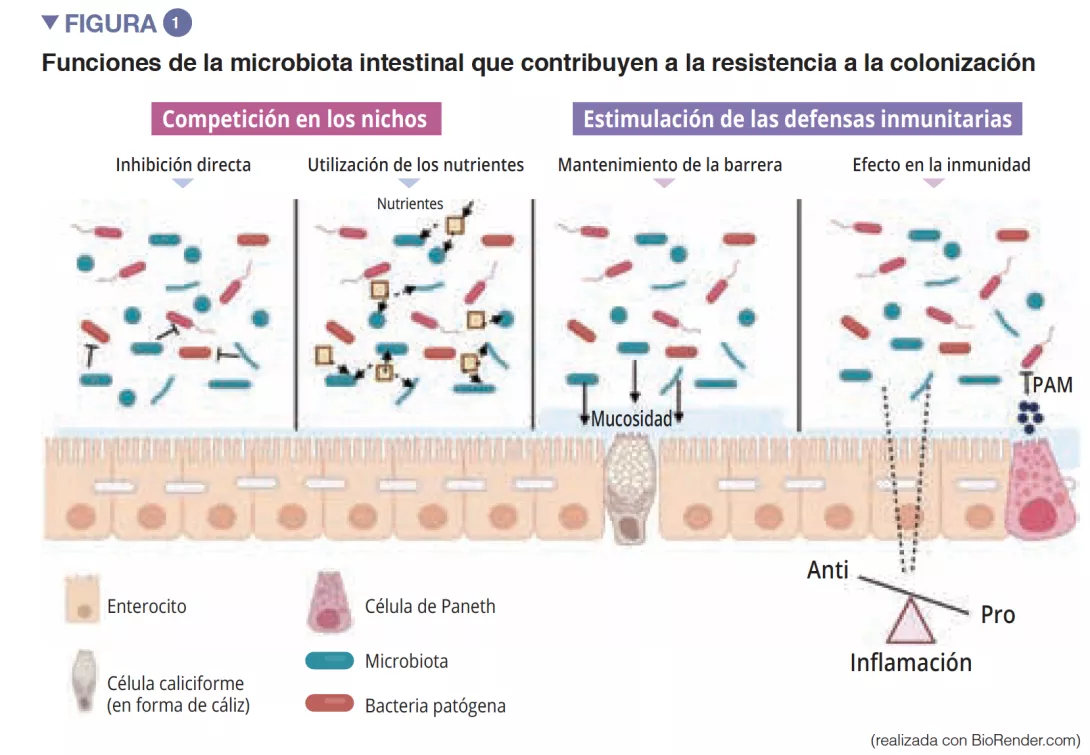
Microbiota intestinal y barrera intestinal
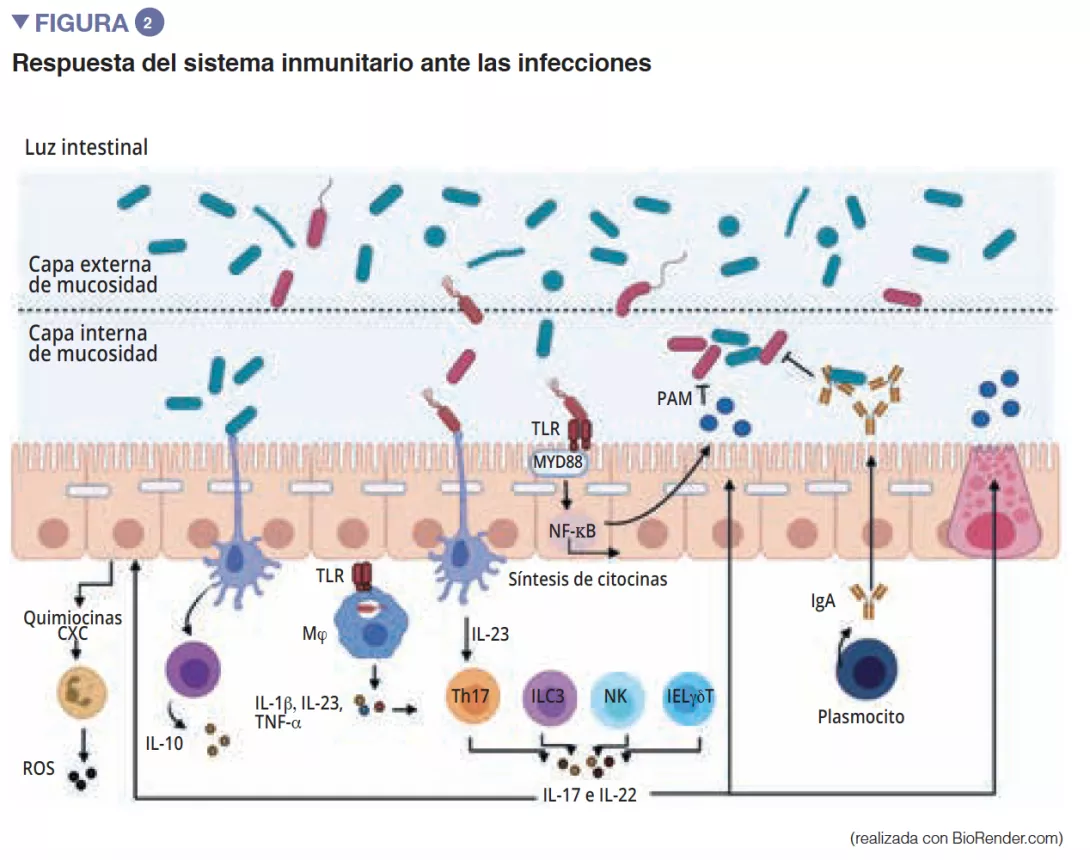
La microbiota intestinal es la primera barrera para proteger a la mucosa intestinal frente a los patógenos. Este ecosistema complejo habita de manera estable el tracto gastrointestinal y limita el acceso a los nichos del intestino, así como a los nutrientes necesarios para la multiplicación de bacterias exógenas, mediante el fenómeno de la «resistencia a la colonización » [1] (Figura 1). Los enterocitos, que proporcionan una barrera física entre la luz intestinal y el anfitrión, absorben el agua y los nutrientes, y segregan péptidos antimicrobianos PAM (RegIIIg, b-defensins y cathelicidin) [2]. Gracias al reconocimiento de patrones moleculares asociados a los microorganismos (Microbe-Associated Molecular Patterns, MAMPs) por receptores específicos (como los Toll-Like-Receptors, TLR), estas células serán capaces de transducir la señal en citocinas y quimiocinas para señalar una infección y reclutar células inmunitarias (Figura 2). Las células caliciformes –secretoras de mucosidad– y las células M tienen la capacidad de hacer pasar a la luz intestinal antígenos intactos y capturados al azar provenientes de bacterias comensales, de patógenos o de antígenos alimentarios. A continuación, las células dendríticas (CD) los procesarán y los presentarán a las células de la inmunidad adaptativa. Esta función es fundamental para la tolerancia intestinal y la inducción de respuestas inmunitarias en las mucosas [2]: así, se produce un equilibrio permanente entre las respuestas pro- y antinflamatorias (Figura 2). Esto se ha demostrado en concreto en modelos de ratones con colitis inducida o con falta de receptores TLR: la ausencia de microbiota o de reconocimiento de la misma, reduce la proliferación de células epiteliales intestinales o la reparación de la barrera [2]. Por último, la mucosidad también proporciona una protección, al capturar los PAM que mantienen a los patógenos alejados del epitelio. En un modelo de ratones con carencia de Muc2 (gen codificante de una de las proteínas que componen la mucosidad), se observa un aumento de la translocación de bacterias comensales, y estos animales acaban padeciendo enfermedades inflamatorias intestinales [3].
Diálogo entre la microbiota intestinal y el sistema inmunitario innato
De entre los actores del sistema inmunitario innato que participan en la homeostasis intestinal, las células presentadoras de antígenos (CPA) como los macrófagos (Mj)y las CD, desempeñan una función fundamental. Los Mj y las CD sintetizan la IL-10 y favorecen así la diferenciación en Treg [4] además de la maduración de los linfocitos Th17 mediante la implicación de bacterias comensales: las bacterias segmentadas filamentosas (Segmented Filamentous Bacteria, SFB). Estas tienen la particularidad de adherirse a las células epiteliales intestinales y producir una estimulación activa del sistema inmunitario [5] (Figura 3). Un estudio ha demostrado que la colonización de ratones con estas SFB induce la diferenciación de Th17 y ejerce así una protección frente a Citrobacter rodentium (equivalente en ratones de los EPEC y EHEC). Es posible que esta protección se pueda atribuir a la capacidad de las SFB para estimular la síntesis de IL-22 por Th17, citocina conocida por estimular la síntesis de los PAM [6]. Las CD, por su parte y gracias a una extensión de sus dendritas entre las células epiteliales, son capaces de fagocitar bacterias presentes en la luz intestinal. A continuación, estas bacterias son transportadas hasta los ganglios linfáticos mesentéricos para inducir la producción de IgA secretadas por los plasmocitos [1]). Las células linfoides innatas (Innate Lymphoid Cells, ILC) también desempeñan una función importante en la homeostasis intestinal, relacionada con su capacidad para iniciar y orientar las respuestas inmunitarias intestinales. Más concretamente, las ILC de tipo 3 (ILC3) ocupan un lugar especial en la interacción con la microbiota intestinal. A través de la síntesis de IL-22, estas células estimulan la producción de mucosidad y de PAM, además de la secreción de quimiocinas y el reclutamiento de células polimorfonucleares (PMN) (Figura 2) [1].
Diálogo entre la microbiota y el sistema inmunitario adaptativo
La maduración final del sistema inmunitario adaptativo se caracteriza por el asentamiento en la mucosa intestinal de linfocitos maduros efectores T proinflamatorios (Th17), antinflamatorios (Treg) y linfocitos B (Figura 2). Al margen de los efectos sobre los macrófagos y la diferenciación de los Th17, las SFB estimulan además el desarrollo de los órganos linfoides y participan en la diferenciación de los linfocitos B en células plasmáticas productoras de IgA que contendrán las bacterias patógenas en la mucosidad [5]. Otras bacterias comensales pueden estimular las respuestas inmunitarias adaptativas: una mezcla de 17 cepas de Clostridia, aislada de una muestra fecal humana e introducida en un ratón, induce una respuesta antinflamatoria al estimular los Treg [7]. Faecalibacterium prausnitzii también se ha identificado por su acción antinflamatoria in vitro e in vivo al actuar sobre el factor NF-kB, las CD y Mj, que segrega IL-10 y favorece la diferenciación de los Treg en detrimento de los Th17 [8]. De entre las Bacteroidetes, también se ha observado que Bacteroides fragilis y B. thetaiotaomicron ejercen una actividad antinflamatoria. B. fragilis sintetiza un polisacárido A (PSA) que suprime la producción proinflamatoria de IL-17, y estimula la secreción antinflamatoria de IL-10 Figura 3). En un modelo específico de colitis inducida por Helicobacter hepaticus, PSA estimula el desarrollo de los órganos linfoides, estimula el linfocito Treg y protege a los ratones [9].
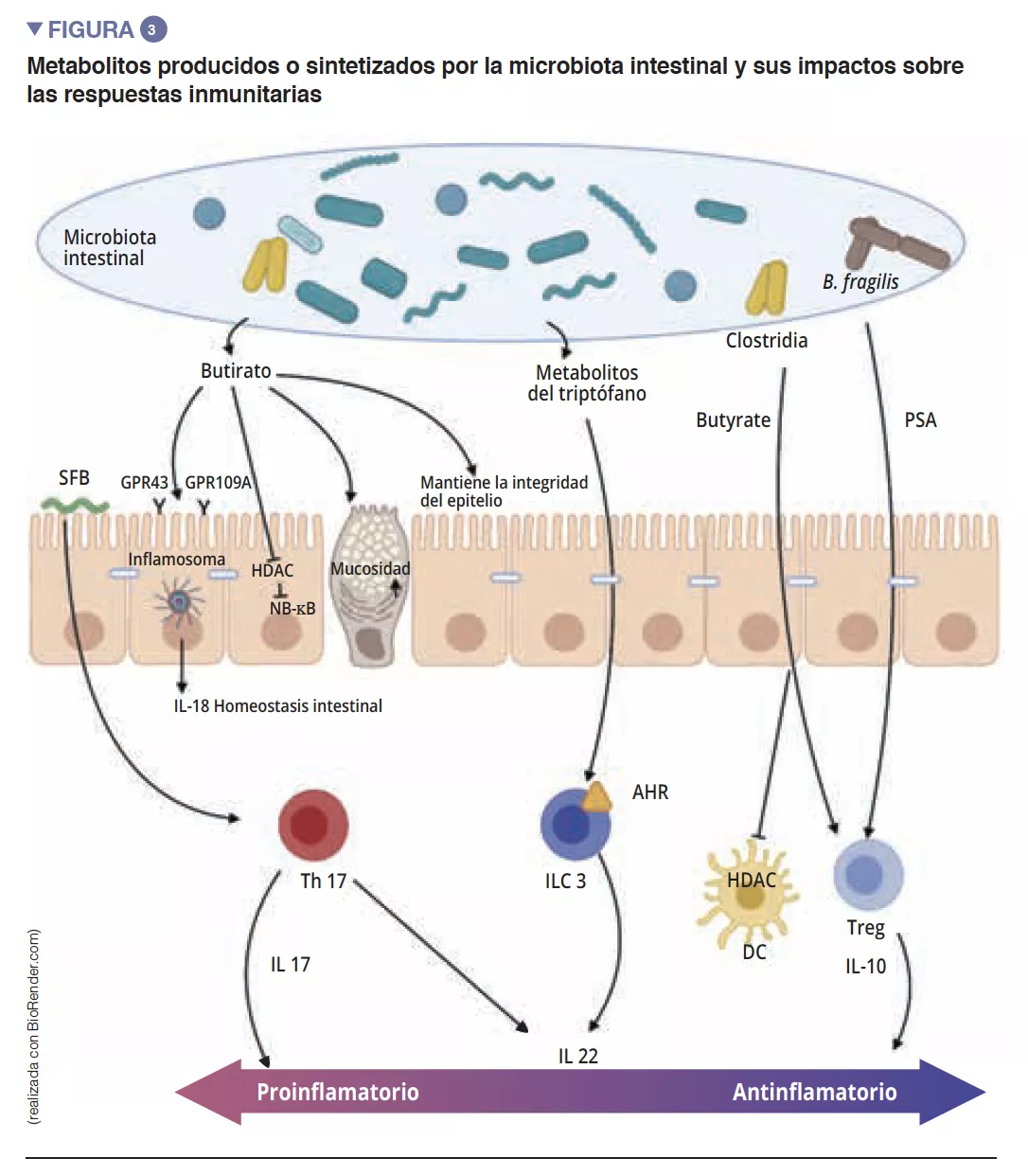
Los metabolitos microbianos: unos mediadores importantes del diálogo entre la microbiota y la inmunidad adaptativa
Los ácidos grasos de cadena corta (AGCC), los metabolitos derivados del triptófano y las sales biliares son los principales metabolitos procedentes de la microbiota intestinal que ejercen un efecto protector contra las infecciones [9, 10]. El butirato, el propionato y el succinato son conocidos por sus acciones sobre la homeostasia intestinal, sobre la secreción de mucosidad, pero también sobre las distintas células del sistema inmunitario. El butirato ejerce, entre otros, efectos antinflamatorios y antimicrobianos. En esta acción intervienen los receptores acoplados a las proteínas G (PGR) que se encuentran sobre las células epiteliales y los macrófagos [9]. F. prausnitzii es un gran productor de butirato, lo que puede explicar, en parte, su efecto antinflamatorio. De hecho, inhibe la activación de NF-kB e inhibe así la síntesis de citocinas proinflamatorias IFN-g, TNF-a, IL-1b, IL-8 por parte de los enterocitos [8] (Figura 3). Asimismo, induce modificaciones metabólicas y epigenéticas (a través de las histonas deacetilasas, HDAC) en macrófagos de ratones, amplificando así sus actividades antimicrobianas in vitro et in vivo [11]. Las bacterias comensales también pueden metabolizar el triptófano y producir sustancias antimicrobianas. Así, las Lactobacilli lo utilizan como fuente de energía para sintetizar un indol que se une a los receptores de arilhidrocarburos (AhR) presentes en las ILC3. Los AhR van a inducir primero la secreción de IL-22 por las ILC y posteriormente la secreción de AMP e inducirán una protección frente a infecciones [9].
Diálogo microbiotasistema inmunitario intestinal para protegerse de las infecciones víricas
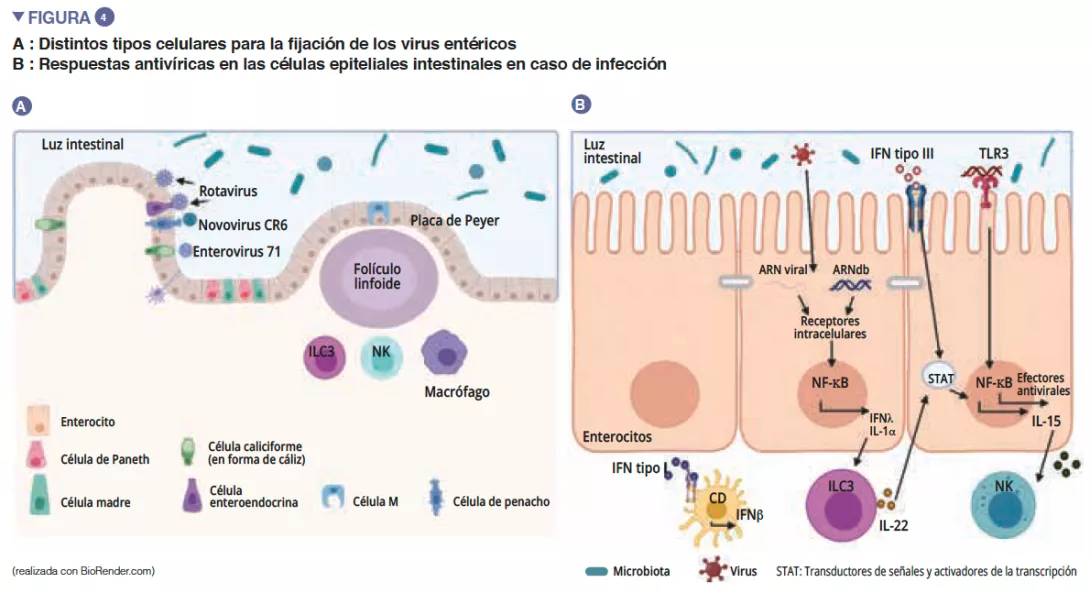
De entre los virus entéricos, el norovirus y el rotavirus son las principales causas de gastroenteritis [12]. Los virus entéricos infectan distintos tipos celulares: los enterovirus 71 infectan específicamente las células caliciformes, mientras que el tropismo de los rotavirus se dirige principalmente hacia los enterocitos [13] (Figura 4A). La microbiota intestinal actúa como una barrera contra las infecciones virales entéricas. Los virus han evolucionado y se han adaptado a su anfitrión desarrollando mecanismos que les permiten atravesar la barrera intestinal y escapar a la inmunidad de barrera: de hecho, es difícil infectar eficazmente por vía oral a ratones con virus entéricos humanos [13]. La penetración del virus en el enterocito provoca la secreción de interferón (IFN) de tipo III. La detección vírica puede inducir IL-la, que activa las ILC3 para producir la IL-22. Esta IL protege de las infecciones virales entéricas y actúa en sinergia con los IFN de tipo III para inducir la expresión de efectores antivirales y de IL-15. El reconocimiento vírico por parte de los TLR-3 conduce a la activación de la vía NF-kB así como la producción de IL-15. La IL-15 activa los linfocitos citotóxicos (células NK). Los virus que han atravesado la barrera intestinal inducen una producción de IFN de tipo I por los macrófagos de la lámina propia (Figura 4B). Ciertos virus entéricos (rotavirus, reovirus, enterovirus) son capaces de unirse a las bacterias intestinales, favoreciendo la penetración en las células epiteliales intestinales [13]. Las SFB, que permiten una renovación epitelial, proporcionan una protección frente a la infección por rotavirus en el ratón al expulsar las células infectadas [14]. Los ácidos biliares metabolizados por la microbiota intestinal también desempeñan una función al proteger al intestino delgado (pero no al colon) de la infección aguda por el norovirus en el ratón, y favorecen la producción de IFN de tipo III en el intestino delgado [15].
Conclusión
El estudio de las relaciones entre la microbiota intestinal y la inmunidad intestinal supone un gran avance en la investigación en gastroenterología. La homeostasis intestinal se mantiene gracias al reconocimiento de bacterias comensales por parte de células del sistema innato y de células del epitelio intestinal, ya sea por un contacto directo (en el caso de las SFB), o a través de la síntesis de metabolitos de la microbiota. La alteración de la homeostasis (disbiosis intestinal, infecciones, etc.) produce una estimulación de las respuestas innatas y una activación del sistema adaptativo. Una mala «gestión» de la inflamación podría dar lugar a enfermedades como el síndrome del intestino irritable posinfeccioso.
1 Perez-Lopez A, Behnsen J, Nuccio SP, Raffatellu M. Mucosal immunity to pathogenic intestinal bacteria. Nat Rev Immunol 2016 ; 16 : 135-48.
2 Allaire JM, Crowley SM, Law HT, et al. The intestinal epithelium: central coordinator of mucosal immunity. Trends Immunol 2018 ; 39 : 677-96.
3 Van der Sluis M, De Koning BA, De Bruijn AC, et al. Muc2-deficient mice spontaneously develop colitis, indicating that MUC2 is critical for colonic protection. Gastroenterology 2006 ; 131 : 117-29.
4 Kim M, Hill A A, Wu WJ, et al. Intestinal microbes direct CX3CR1+ cells to balance intestinal immunity. Gut Microbes 2018 ; 17 : 151-63.
5 Flanningan KL, Denning TL. Segmented filamentous bacteria-induced immune responses: a balancing act between host protection and autoimmunity. Immunology 2018 ; 154 : 537-46.
6 Ivanov I I, Atarashi K, Manel N, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell 2009 ; 139 : 485-98.
7 Atarashi K, Tanoue T, Oshima K, et al. Treg induction by rationally selected mixture of Clostridia strains from the human microbiota. Nature 2013 ; 500 : 232-6.
8 Miquel S, Martin R, Rossi O, et al. Faecalibacterium prausnitzi and human intestinal health. Curr Opin Microbiol 2013 ; 16 : 255- 61.
9 Levy M, Blacher E, Elinav E. Microbiome, metabolites and host immunity. Curr Opin Microbiol 2017 ; 35 : 8-15.
10 Michaudel C, Sokol H. The gut microbiota at the service of immunometabolism. Cell Metabolism 2020 ; 32 : 514-23.
11 Schulthess J, Pandey S, Capitani S, et al. The short Chain Fatty Acid Butyrate imprints an antimicrobial program in macrophages. Immunity 2019 ; 50 : 432-45.
12 Bányai K, Estes MK, Martella V, et al. Viral gastroenteritis. Lancet 2018 ; 392 : 175-86.
13 Segrist E, Cherry S. Using diverse model systems to define intestinal epithelial defenses to enteric viral infections. Cell Host Microbe 2020 ; 27 : 329-44.
14 Shi Z, Zou J, Zhang Z, et al. Segmented filamentous bacteria prevent and cure rotavirus infection. Cell 2019 ; 179 : 644-658.e13.
15 Grau KR, Zhu S, Peterson ST, et al. The intestinal regionalization of acute norovirus infection is regulated by the microbiota via bile acid-mediated priming of type III interferon. Nat Microbiol 2020 ; 5 : 84-92.