Abordar la microbiota intestinal para combatir las alergias
Síntesis
Por el Pr. Roberto Berni Canani, MD, PhD
Departamento de Ciencia Médica Traslacional; Laboratorio Europeo para la Investigación de las Enfermedades Provocadas por la Alimentación y Biotecnologías avanzadas CEINGE; Grupo de Trabajo sobre la Investigación de la Microbiota, Universidad de Nápoles “
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
Autor
La microbiota intestinal disbiótica desempeña un importante papel en la aparición de enfermedades alérgicas, sobre todo de las alergias alimentarias. La microbiota intestinal condiciona la maduración y el funcionamiento del sistema inmunitario, y los factores genéticos, ambientales y alimentarios podrían alterar la microbiota comensal y provocar así la desregulación de la función inmunitaria. Varios factores responsables de una disbiosis se han asociado a la aparición de alergias, como el parto por cesárea, la falta de lactancia materna, el uso de fármacos (principalmente antibióticos e inhibidores del ácido gástrico), el uso de antisépticos, y las dietas bajas en fibra y altas en grasas. Ningún taxón bacteriano concreto se ha asociado de manera sistemática a las alergias, pero los datos indican que las disbiosis intestinal ocurren incluso antes de la aparición de alergia. Los ácidos grasos de cadena corta (AGCC) son metabolitos fundamentales derivados de la microbiota intestinal que intervienen en la relación con el sistema inmunitario. Abordar la composición y el funcionamiento de la microbiota intestinal representa una estrategia prometedora contra las enfermedades alérgicas, y muy especialmente las alergias alimentarias infantiles.
La prevalencia, persistencia y gravedad de las enfermedades alérgicas y, en particular, de las alergias alimentarias (AA) ha aumentado sustancialmente en los últimos decenios en el mundo industrializado, presionadas por las interacciones entre los genes y el ambiente, y que provocan una disfunción del sistema inmunitario mediada, al menos en parte, por mecanismos epigenéticos [1, 2]. Este escenario cambiante ha dado lugar a un aumento de los ingresos hospitalarios, las consultas médicas, los tratamientos, y a una mayor carga asistencial de las familias. Todos estos factores ejercen un efecto significativo en los costes sociales y la calidad de vida, y suponen una gran carga psicológica para los pacientes y sus familias.
Las alergias alimentarias se caracterizan por una respuesta inmunitaria anómala hacia péptidos antigénicos alimentarios que normalmente son bien tolerados. La causa de las AA sigue sin estar bien definida. Partiendo de los conocimientos actuales, la susceptibilidad genética sola no puede explicar el patrón cambiante de las AA y ha habido un interés renovado por la función del ambiente en la sensibilización a los alimentos. Los datos apuntan a que las alteraciones de la microbiota intestinal (MI) (disbiosis) desempeñan un papel patogenético clave en la aparición de las alergias. Una MI sana tiene un efecto fundamental en el desarrollo del aparato digestivo y el sistema inmunitario. Una MI disbiótica está asociada a diversas enfermedades, entre ellas las alergias [3].
Importancia de la exposición microbiana para la tolerancia inmunitaria
Todavía no se ha definido del todo la manera en que los antígenos alimentarios se vuelven no inmunógenos a través de la tolerancia inmunitaria. Los datos permiten suponer un papel fundamental de los linfocitos T reguladores (Treg) que expresan el factor de transcripción Foxp3 (Treg Foxp3+), y de la compleja interacción entre la MI y las células inmunitarias y no inmunitarias. Para una tolerancia completa a los antígenos alimentarios es necesaria la presencia de poblaciones de Treg inducidas tanto por la alimentación como por microorganismos [4].
Durante el parto vaginal, los niños reciben su primer inóculo bacteriano del canal vaginal materno, el tejido cutáneo y, con frecuencia, materia fecal, que exponen al sistema inmunitario inmaduro a una importante carga bacteriana [3]. La maduración de una MI sana en las primeras etapas de la vida permite un cambio en el equilibrio Th1/Th2, al mismo tiempo que favorecen la respuesta celular Th1, mientras que la disbiosis altera la homeostasis huésped-microbiota y produce un desplazamiento del equilibrio de las citocinas Th1/Th2 hacia una respuesta de Th2 [5].
Los Treg se encuentran reducidos en ratones libres de gérmenes y en ratones que reciben una dieta basada en aminoácidos [4, 6]. Las IgA secretoras (IgAs) y los péptidos de la inmunidad congénita desempeñan una función fundamental en la regulación de la composición de la MI. Se ha observado deficiencia de inmunidad congénita y adquirida (sobre todo los valores bajos de IgA) en niños con múltiples AA [7]. Una MI sana que favorece la producción de IgAs facilita la supervivencia de las cepas bacterianas protectoras dentro de la luz intestinal [8].
La microbiota intestinal y las alergias
La expresión de un fenotipo alérgico depende de la interacción entre dos factores principales: la predisposición genética y las interacciones entre genes y ambiente. Un número creciente de estudios apunta a una correlación entre los factores que alteran la MI durante la infancia y la aparición de alergias en un momento posterior de la vida. Cada vez hay más pruebas de que la disbiosis de la MI en las primeras etapas de la vida constituye un factor fundamental en la aparición de las alergias.
Los principales factores responsables de disbiosis son: nacimiento por cesárea, ausencia de lactancia materna, uso de fármacos (sobre todo antibióticos e inhibidores del ácido gástrico), uso de antisépticos, calendario de introducción de alimentos sólidos, y dietas basadas en comida basura o bajas en fibra/altas en grasas [3, 9]. También se ha publicado que el uso materno de antibióticos antes y durante el embarazo, así como los tratamientos crónicos durante los primeros meses de vida, está asociado a un mayor riesgo de alergias a la leche de vaca (ALV) en niños [10]. Los datos que podrían usarse para caracterizar la microbiota en los pacientes con AA son aún preliminares. Recientemente describimos una disbiosis de la MI en niños afectados de ALV mediada por IgE; los niños con ALV presentaban niveles significativamente reducidos de Bifidobacteriaceae, Streptococcaceae, Enterobacteriaceae y Enterococcaceae y niveles significativamente elevados de determinadas cepas de las familias de Ruminococcaceae y Lachnospiraceae. La MI de los pacientes con ALV estaba formada por un 73 % de los taxones Bacteroidetes y Firmicutes, de los que se sabe que también predominan en el intestino adulto [11].
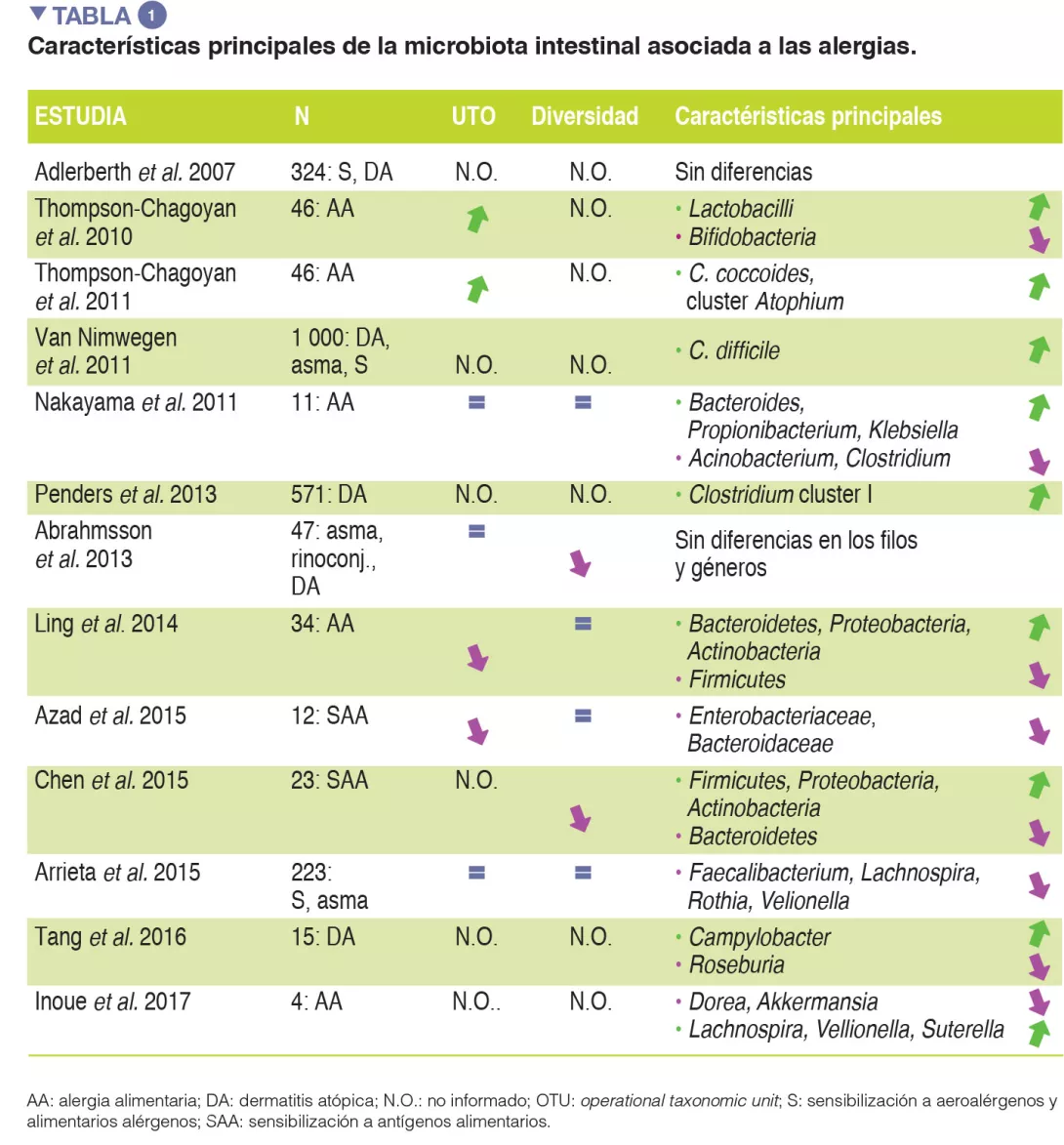
Aunque están surgiendo pruebas abrumadoras de la asociación entre la disbiosis de la MI y las AA, la heterogeneidad del diseño de los estudios (por ejemplo en los momentos de recogida de muestras, los métodos utilizados para caracterizar la microbiota y los fenotipos alérgicos estudiados) ha dificultado la determinación de una relación causal entre taxones bacterianos específicos y la aparición de alergias. No hay taxones bacterianos específicos que se hayan asociado de manera uniforme a AA, y una gran variedad de microorganismos hallados en el intestino humano podrían intervenir en los mecanismos tolerógenos. Los datos principales de la MI asociada a alergias se resumen en la tabla 1
La microbiota intestinal desempeña un papel central en la patogenia de las alergias
Los datos indican que el eje microbiota intestinal-epigenética, modulado por diversos factores ambientales y alimentarios, desempeña un papel importante en la aparición de alergias. Este eje regula varios mecanismos tolerógenos inmunitarios y no inmunitarios, y podría constituir la diana ideal para estrategias innovadoras, preventivas y terapéuticas contra las alergias.
Los AGCC constituyen los principales metabolitos de la MI que interaccionan con las células humanas. De entre los AGCC, el butirato tiene un papel fundamental en la inducción de inmunotolerancia, y se ha observado deficiencia de butirato en pacientes alérgicos [4]. Podría plantearse la hipótesis de que los diferentes tipos de disbiosis provocan efectos parecidos en términos de AGCC, o que la producción de otros metabolitos derivados de la microbiota puede facilitar la aparición de alergias. Especies de Clostridia, pertenecientes a los grupos IV y XIVa, constituyen la fuente predominante de AGCC en el colon. Los AGCC producidos por bacterias se han relacionado tanto con la regulación de la proporción como con la capacidad funcional de los Treg, que, en algunos estudios, se han atribuido específicamente a la producción de butirato por Clostridiales formadoras de esporas. Se ha observado un incremento de taxones de la clase Clostridia y del filo Firmicutes en sujetos humanos con resolución de ALV [9]. Los datos de nuestro laboratorio pusieron de manifiesto que el tratamiento con butirato oral provoca una inhibición espectacular de la respuesta alérgica aguda de la piel y de la valoración de síntomas anafilácticos, una temperatura corporal reducida, una mayor permeabilidad intestinal, y la producción de IgE de lactoglobulina anti-βLG (BLG), IL-4 e IL-10 en un modelo con ratones de ALV, lo que permite suponer que el butirato tiene un papel protector contra las AA [9]. El butirato presenta varios mecanismos de acción, pero muchos de ellos intervienen en la regulación epigenética de la expreexpresión génica a través de la inhibición de la histona desacetilasa (HDAC). La inhibición de la HDAC9 y 6 aumenta la expresión génica de FoxP3, así como la producción y la función supresora de los Treg [12]. Evaluamos los efectos directos del butirato en células mononucleares de sangre periférica (CMSP) de niños afectados por ALV mediada por IgE y demostrada mediante pruebas de desafío. Las CMSP fueron estimuladas con ALV en presencia o ausencia de butirato. Los resultados preliminares ponen de manifiesto que el butirato estimula la producción de IL-10 e IFN-γ y reduce la tasa de metilación del ADN de estas dos citocinas. La misma dosis efectiva de butirato induce desmetilación de la región promotora FoxP3 y un descenso de la expresión de HDAC6/HDAC9 [2].
Modulación de la microbiota intestinal asociada a las alergias
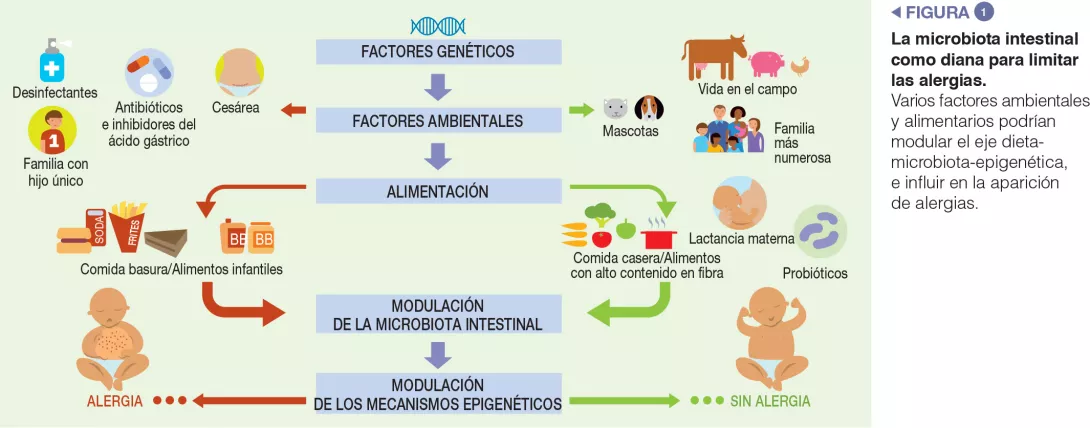
Los niños expuestos a entornos agrícolas presentan menos riesgo de aparición de alergias. Aunque no se ha demostrado de manera concluyente, una de las explicaciones plausibles del efecto protector asociado a dicha exposición en las primeras etapas de la vida es la función de la MI, ya que las personas expuestas a un entorno agrícola cuentan con una composición microbiana distinta a quienes tienen otros estilos de vida [3]. Otros factores epidemiológicos que protegen de las AA son la existencia de hermanos mayores y la exposición a mascotas en los primeros años de vida. Tener mascotas está asociado a una alta diversidad microbiana en el entornodoméstico. Un estudio reciente que examinó la influencia de los patrones alimentarios en la aparición de AA a los dos años de edad indica que los hábitos alimentarios podrían influir en la aparición de AA al alterar la composición de la microbiota intestinal. En concreto, una dieta infantil con niveles altos de fruta, verdura y comida casera se asoció a menos AA [9] (Figura 1).
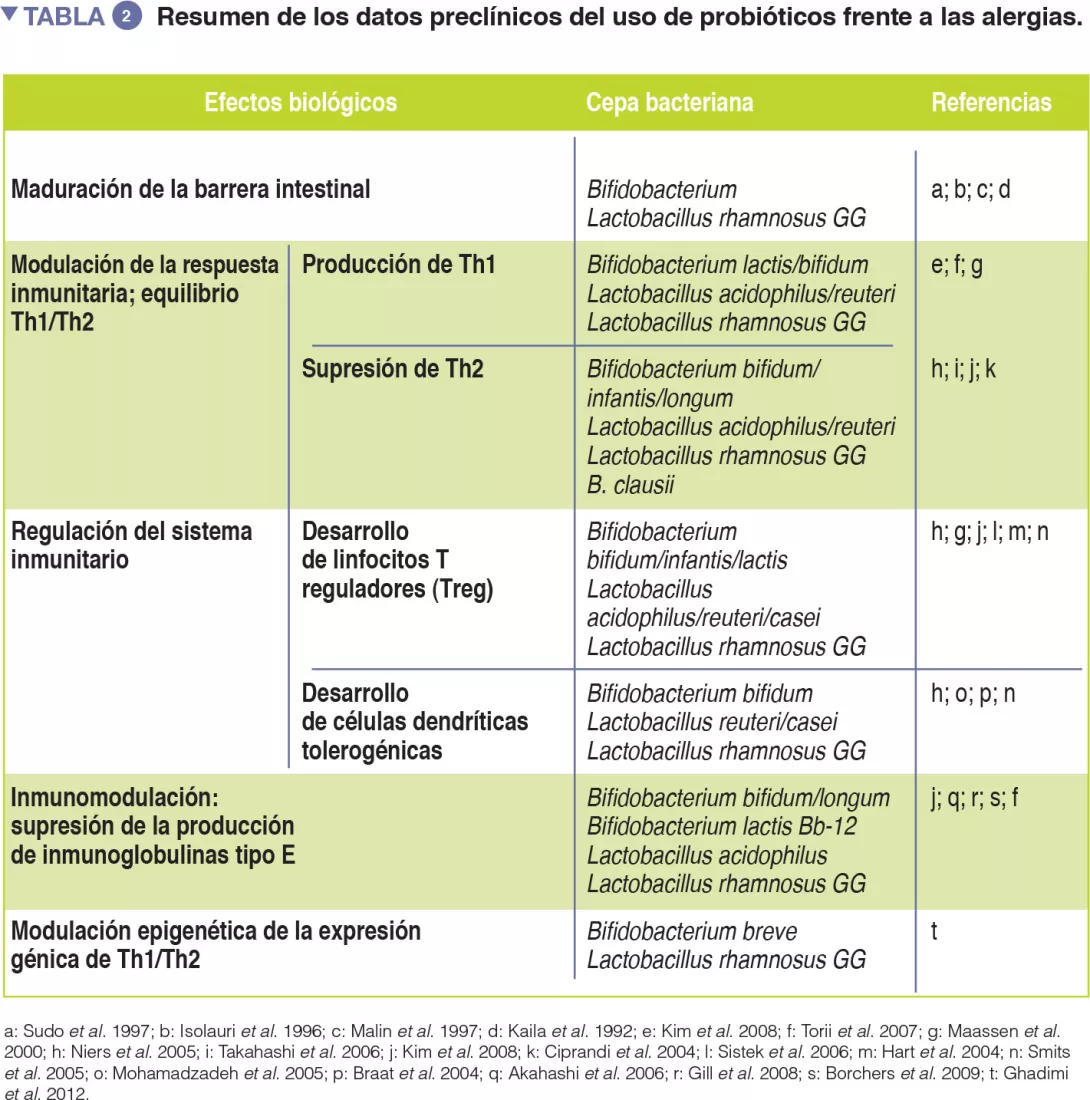
Los probióticos, definidos como microorganismos ingeridos que ofrecen beneficios para la salud del huésped, podrían ser beneficiosos para modular la MI [13]. Los datos sobre el uso de probióticos contra las alergias respiratorias siguen siendo preliminares (Tabla 2). Sin embargo, los metanálisis han revelado que el uso de determinados probióticos, desde la gestación hasta los seis primeros meses de vida, podría reducir la incidencia de eccema atópico en los niños con antecedentes familiares de enfermedad alérgica [14].
¿Cómo modular la microbiota intestinal?
Nuevos datos respaldan el uso de determinadas estrategias alimentarias y cepas probióticas para la prevención y el tratamiento de las alergias. (Tabla 2).
Anteriormente hemos demostrado que la adición del probiótico L. rhamnosus una leche maternizada hipoalergénica acelera la adquisición de inmunotolerancia y protege frente a la aparición de otras manifestaciones atópicas en los niños con ALV [15-17]. Cuando comparamos la microbiota fecal de los niños que recibían este tratamiento probiótico inductor de tolerancia, hallamos correlaciones positivas significativas entre la abundancia de géneros bacterianos con potencial de producir butirato y la concentración de butirato fecal [11]. La identificación a nivel de cepa de los géneros productores de butirato (incluidos Roseburia, Coprococcus y Blautia) hallados en niños pequeños que adquirieron tolerancia a la leche de vaca, indican que el tratamiento con L. rhamnosus contribuye a la adquisición de tolerancia, alterando la estructura de la comunidad a nivel de cepas con taxones con potencial de producir butirato [11]. En consecuencia, se ha demostrado que la inmunoterapia oral junto al aporte complementario de otra cepa de L. rhamnosus es eficaz para frenar la reacción a los cacahuetes en el 82 % de los niños alérgicos [18].
Conclusión
Los trillones de bacterias que habitan nuestro intestino regulan de manera fundamental funciones fisiológicas clave contra las alergias. Alteraciones de la composición y del funcionamiento de la MI inducidas por el ambiente (reducción de la producción de butirato, por ejemplo) dan lugar a una disbiosis que está vinculada con un mayor riesgo de alergia. El conocimiento del modo en que las comunidades bacterianas intestinales interactúan con el sistema inmunitario está abriendo el camino hacia nuevas estrategias terapéuticas preventivas de las alergias.