Кишечник младенца — фундамент иммунитета
Доктор Трэвис де Вульф
Раздел для широкой публики
Найдите здесь свое выделенное место
en_sources_title
en_sources_text_start en_sources_text_end
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Авторы
Содержание
ru_chapters_mobile
Pазвитие врожденного иммунитета
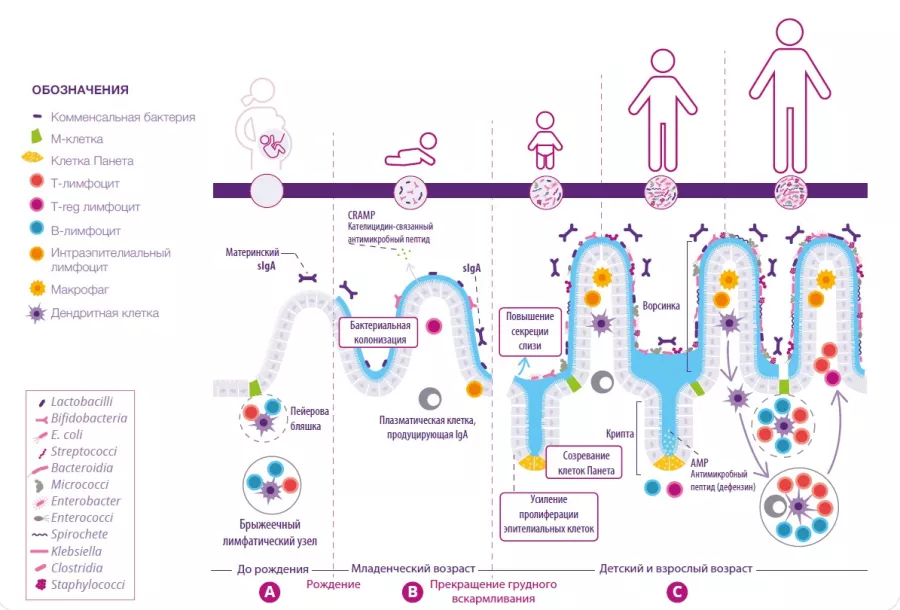
Развитие кишечной иммунной системы начинается еще в утробе матери и продолжается в течение всего периода грудного вскармливания. До рождения в кишечнике младенца образуются незрелые лимфоидные структуры, включая Пейеровы бляшки и брыжеечные лимфатические узлы (рисунок 1А). Поскольку эти структуры созревают лишь через некоторое время после рождения, эпителий кишечника вырабатывает антимикробные пептиды (AMP), которые функционируют в качестве защитного барьера для первых микроорганизмов, колонизирующих кишечник (рисунок 1B).1 Слизь — еще одна важная барьерная структура, которая вырабатывается бокаловидными клетками и секретируется на поверхность слизистой ЖКТ. Вместе эти компоненты врожденного иммунитета создают защитный барьер и играют ключевую роль в ограничении прямого контакта микробиоты кишечника с его эпителиальными клетками, особенно во время колонизации и закрепления микробиоты в кишечнике.
80% Более 80% клеток, продуцирующих Ig в организме, находятся в кишечнике
Bажная роль адаптивного иммунитета
Продуцируемый иммуноглобулин A (IgA) обладает различной аффинностью к микроорганизмам и пищевым антигенам, поступающим в кишечник. Секретируемый IgA связывает свои мишени в просвете кишечника и ограничивает их способность прилипать к эпителию кишечника и/или проникать в сами клетки (рисунок 1B).2 По мере прекращения грудного вскармливания микробиота кишечника ребенка становится все более разнообразной и концентрированной. Важную роль в это время играют изменение рациона питания и созревание слизистой кишечника. Это требует совершенствования защитных функций эпителиального барьера, что и происходит во время созревания местных лимфоидных структур. Активированные клетки Панета, локализующиеся в основании крипт тонкой кишки, начинают продуцировать защитные белки (дефензины), позволяя другим эпителиальным клеткам уйти от продукции AMP и сосредоточиться на своих основных функциях. Наконец, происходит увеличение скорости пролиферации и обновления эпителиальных клеток наряду с повышенной секрецией слизи (рисунок 1C).
РИСУНОК 1. Развитие микробиоты и иммунной системы кишечника до рождения (A), во время грудного вскармливания (B) и после его прекращения (C).
По материалам Brandtzaeg P, 20173 and Ximenez C et al, 20176
Bажность кишечного гомеостаза
Не менее 80% Ig-продуцирующих клеток организма расположены в кишечнике3: это самый большой эффекторный орган гуморального иммунитета. Специализированные эпителиальные клетки, захватывающие антигены (М-клетки), выполняют функцию «пропускного пункта», облегчая транспортировку антигенов, происходящих из комменсальных бактерий, компонентов пищи или патогенов, из просвета кишечника к расположенным глубже лимфоидным клеткам. Эти антигены будут затем переварены дендритными клетками (ДК) и презентированы адаптивной иммунной системе.
Вместе различные компоненты кишечного иммунитета способствуют гомеостазу посредством двух противовоспалительных стратегий (рисунок 1C):
1) Иммунное избегание чужеродных антигенов ограничивает / предотвращает избыточную колонизацию кишечника или проникновение микробов в его слизистую оболочку. Эту функцию выполняет sIgA.3
2) Пероральная толерантность действует путем ограничения местного и периферического иммунного ответа на безвредные антигены, которые вступают в контакт с эпителиальным барьером.4 Эта функция зависит от Treg-клеток, выполняющих регуляторные функции (рисунок 2).3 Когда эти стратегии функционируют корректно, регуляторные и эффекторные функции иммунной системы с учетом особенностей комменсальной микробиоты приводят к установлению длительных гомеостатических отношений между нашим организмом и микроорганизмами, которые будут иметь долгосрочные последствия для здоровья человека.5
ИММУННЫЕ КЛЕТКИ И НЕ ТОЛЬКО: важность слизистого кишечного барьера
(доктор Ларисса Челиберто)
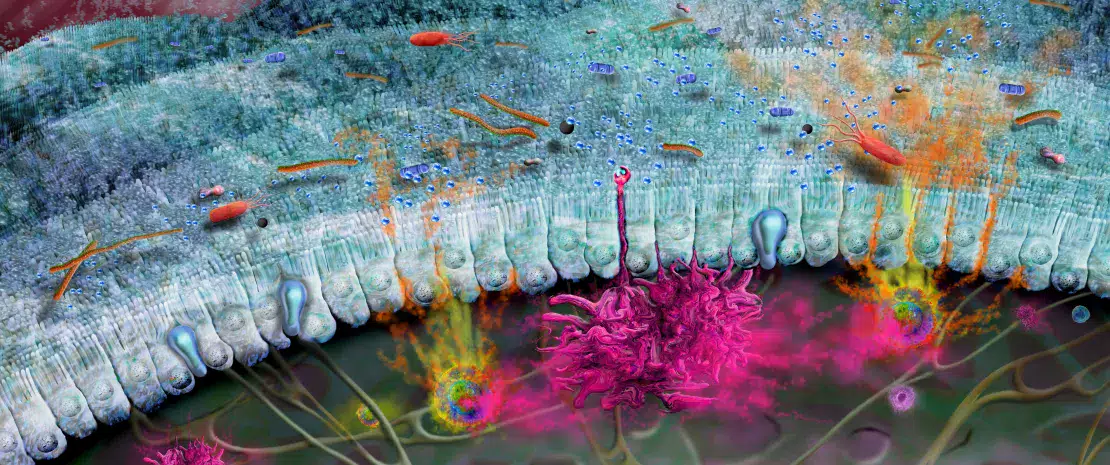
Стенка кишечника выстлана одним слоем клеток, называемым кишечным эпителием, поверх которого лежит плотный слой слизи (рисунок 1). Вместе эти барьеры ограничивают микробное взаимодействие в просвете кишечника, а также защищают основные компоненты иммунной системы от ненужной активации микробиотой3. В состав слизистого барьера входит муцин 2 (MUC2), гликопротеин, богатый молекулами сахаров, который обеспечивает основные свойства слизи. Недавние исследования показали, что микробиота значительно влияет на созревание и функционирование кишечного слизистого барьера, тогда как типы сахаров, входящие в состав MUC2, могут влиять на то, какие бактерии способны связываться с ним или использовать его и его сахарные цепи в качестве источника питательных веществ7. Примечательно, что нарушение этого барьера может привести к увеличению проникновения потенциально вредных бактерий из просвета кишечника в его стенку, что может привести к системной инфекции и воспалению8. Повреждение слизистого барьера и дисбиоз микробиоты кишечника9 наблюдаются при некоторых заболеваниях, например, воспалительных заболеваниях кишечника (ВЗК)10,11, сахарном диабете12 и т. д., что подчеркивает важность этого защитного барьера для здоровья человека.
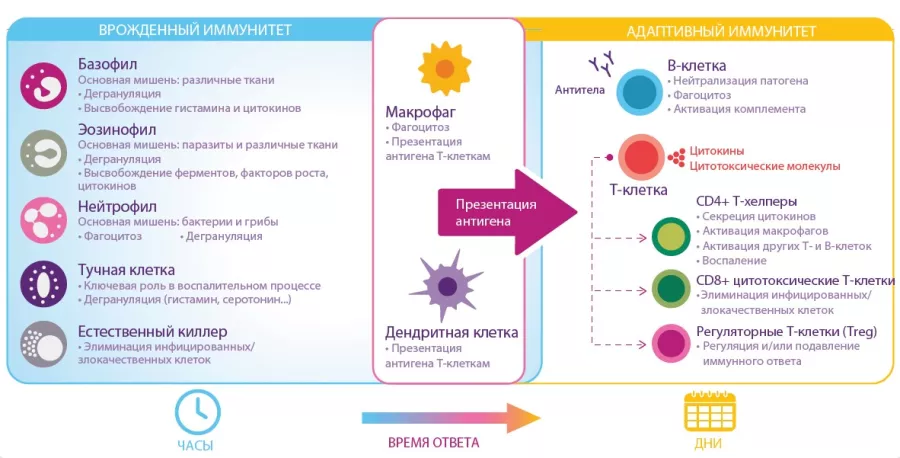
РИСУНОК 2. Клетки и функции врожденного и адаптивного иммунитета.
3 Brandtzaeg P. (2017) Role of the Intestinal Immune System in Health. In: Baumgart D. (eds) Crohn's Disease and Ulcerative Colitis. Springer, Cham.
4 Commins SP. Mechanisms of Oral Tolerance. Pediatr Clin North Am. 2015 Dec;62(6):1523-9.