Cuando los fármacos se encuentran con los microbios: un diálogo bidireccional con consecuencias terapéuticas
Por el Prof. Emmanuel Montassier
Urgencia, Cuidados Intensivos, Reanimación, Medicina Interna y Enfermedades Infecciosas, Universidad de Nantes, Francia
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos

Acerca de este artículo
Las interacciones bidireccionales entre fármacos orales y microbioma intestinal se consideran cada vez más importantes para la eficacia, seguridad y tolerancia de los medicamentos. Aunque es bien sabido que los antibióticos alteran las comunidades microbianas, en torno al 24 % de los fármacos no antibióticos también inhiben al menos a una especie comensal. Además, entre el 10 y el 15 % de los medicamentos ora les son transformados por los microbios intestinales in vivo, lo que influye en su eficacia o toxicidad. Los medicamentos habituales como los inhibidores de la bomba de protones (IBP), los antinflamatorios no esteroideos (AINE), la metformina y las estatinas, pueden alterar la composición y la función de la microbiota, influyendo en el metabolismo y en la inmunidad del anfitrión. A pesar de estos hallazgos, es frecuente no tener en cuenta el microbioma en el momento de recetar y desarrollar medicamentos. Esta revisión resume los principales conocimientos clínicos y farmacodinámicos, destaca las notables interacciones entre fármacos y microbiota y explora las estrategias emergentes para mejorar los desenlaces clínicos. La integración de la farmacomicrobiómica en la atención clínica puede reducir los efectos y ayudar a la medicina de precisión.
La microbiota intestinal actúa como un órgano metabólico, favoreciendo la digestión, la inmunidad y la homeostasis [1]. Sin embargo, su interacción con los fármacos es bidireccional: los medicamentos pueden alterar el equilibrio microbiano, mientras que los microbios pueden alterar la actividad de los fármacos. Esto hace que el microbioma sea un factor importante, aunque a menudo descuidado, en el riesgo de reacciones adversas a medicamentos (RAM) 2, 3. Las enzimas microbianas intestinales pueden transformar los fármacos en formas más tóxicas, aumentando la exposición de los tejidos y sus efectos nocivos. Hay cada vez más pruebas de que la variabilidad microbiana es un factor clave de las diferencias individuales en la respuesta a los fármacos y las reacciones adversas 2, 4. La integración de la farmacomicrobiómica en la evaluación del riesgo junto con los datos genéticos y clínicos podría ayudar a predecir la predisposición a los daños relacionados con los medicamentos y a orientar estrategias de prevención personalizadas.
Alteración de la microbiota provocada por fármacos: antibióticos y más allá
Es bien sabido que los antibióticos alteran la microbiota intestinal reduciendo la diversidad, alterando la composición y promoviendo cepas resistentes (cuadro 1) 5, 6. Van Zyl et al. descubrieron que los antibióticos especialmente las quinolonas y los betalactámicos, alteran sistemáticamente las comunidades microbianas en todas las zonas del cuerpo, y que los tratamientos combinados provocaban una disbiosis prolongada y un aumento de la carga patógena 5. Del mismo modo, Maier et al. demostraron que las diferentes clases de antibióticos tienen efectos distintos en las bacterias intestinales, los macrólidos y las tetraciclinas provocan pérdidas constantes de anaerobios, y fármacos como la amoxicilina y la ceftriaxona desplazan las poblaciones hacia las Proteobacterias. A pesar de la variabilidad individual, se observó una tendencia común: el agotamiento de anaerobios estrictos (por ejemplo, Firmicutes) y el enriquecimiento de microbios facultativos y potencialmente patógenos 6.
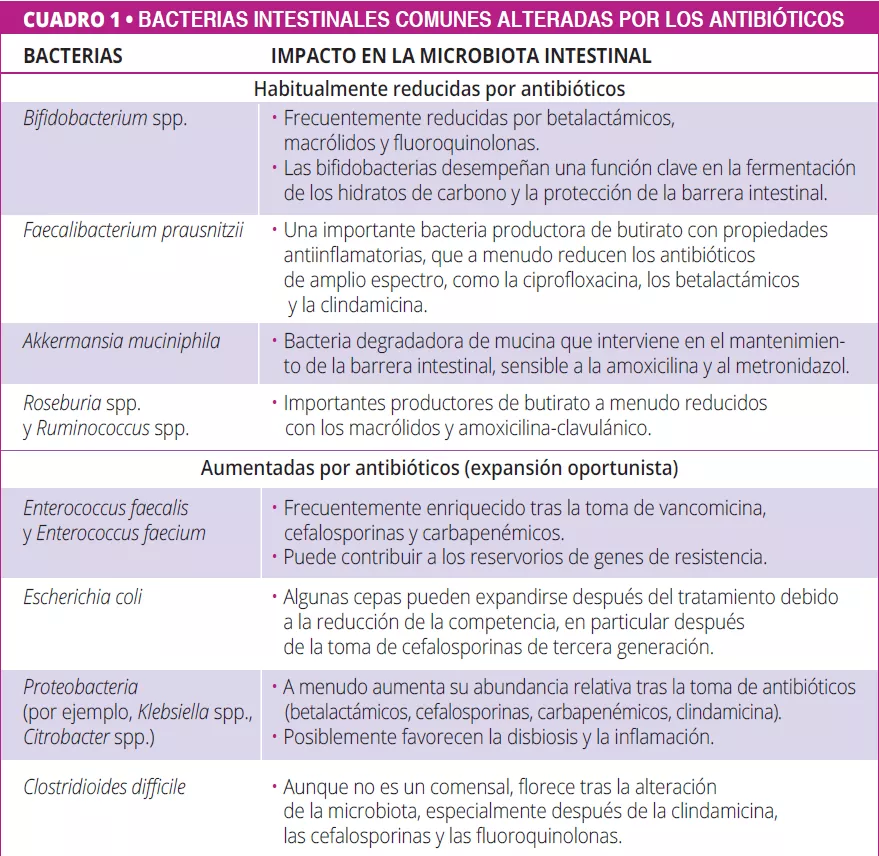
Más allá de los antibióticos, existen muchos fármacos no antibióticos como los IBP, la metformina, los AINE, los antipsicóticos y las estatinas que también alteran la microbiota intestinal (figura 1, cuadro 2) 7, 8. Los fármacos influyen en la microbiota intestinal a través de varios mecanismos: la acción antimicrobiana directa, la alteración del pH, la modulación de los ácidos biliares, los cambios en la motilidad intestinal y la secreción de moco 9.
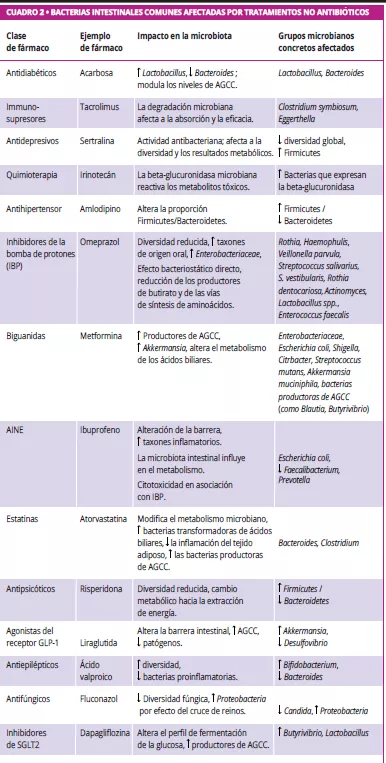
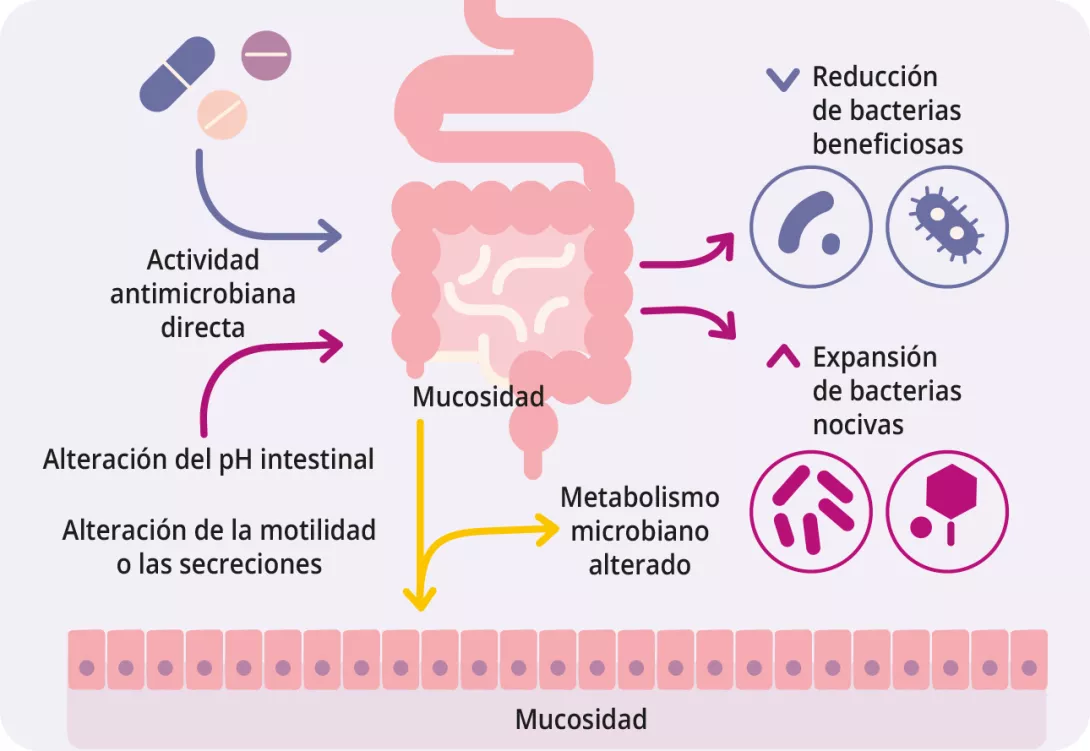
La microbiota intestinal modifica el metabolismo de los fármacos
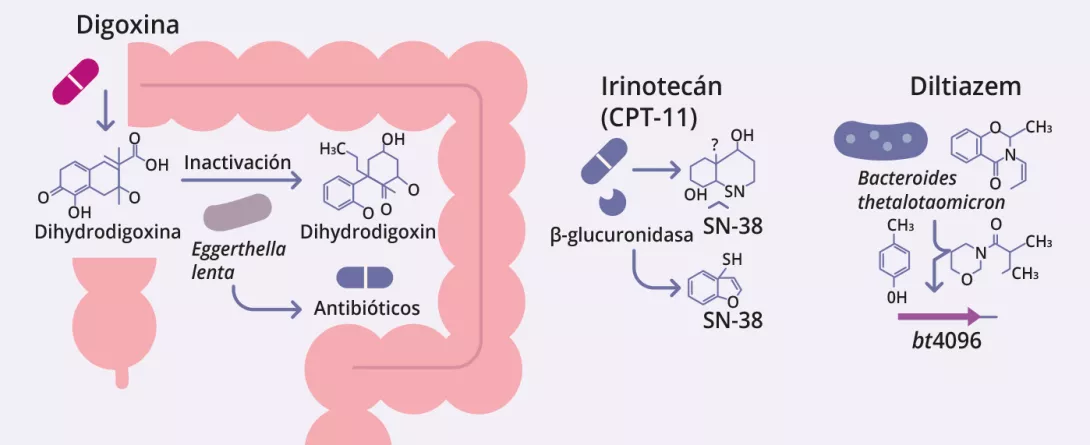
La microbiota intestinal puede biotransformar los fármacos terapéuticos, alterando su actividad, eficacia y toxicidad (figura 2, cuadro 3) 12-14. Zimmermann et al. trazaron un mapa del metabolismo microbiano mediante el cribado de 271 fármacos orales frente a 76 cepas bacterianas intestinales, y descubrieron que 176 eran metabolizados por al menos una cepa. En concreto, Bacteroides dorei y B. uniformis metabolizaron casi 100 fármacos. Se identificaron más de 40 enzimas microbianas que intervienen en una amplia gama de reacciones, como la reducción, la hidrólisis, la descarboxilación, la desalquilación y la desmetilación 12.
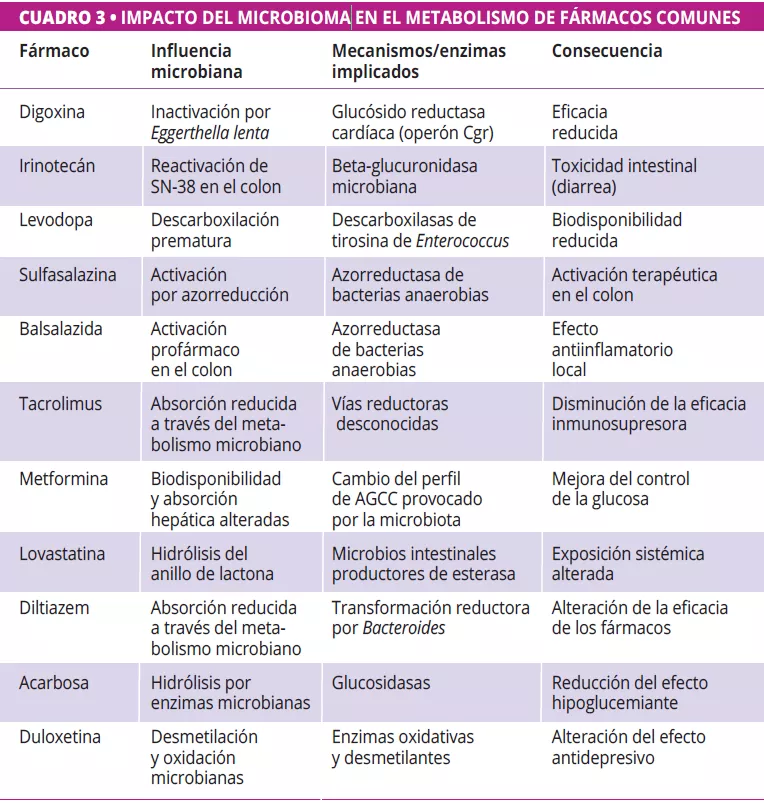
Javdan et al. desarrollaron una plataforma personalizada (MDM-Screen) para evaluar el metabolismo microbiano de los fármacos utilizando microbiota ex vivo de determinados donantes. Después de analizar 575 fármacos, descubrieron que el 13 % eran metabolizados por los microbios intestinales, incluidas muchas interacciones que no se habían reconocido anteriormente. Estas transformaciones, como la hidrólisis, la reducción y la desacetilación, pueden activar, inactivar o aumentar la toxicidad de los fármacos. El estudio reveló además una variabilidad significativa entre las personas, e identificó genes microbianos clave (por ejemplo, uridina fosforilasa, beta-glucuronidasa) vinculados a vías metabólicas específicas 15.
La eficacia de algunos fármacos puede depender más de la composición de la microbiota que de la genética del anfitrión.
Consecuencias clínicas: hacia una medicina personalizada
Las interacciones microbiota-fármaco tienen importantes implicaciones clínicas, ya que las diferencias individuales en la microbiota intestinal pueden explicar la variabilidad en la respuesta a los fármacos y sus efectos secundarios. Hay que señalar que lo que influye en los resultados del tratamiento no es únicamente la composición de la microbiota, sino también su estabilidad funcional.
En el melanoma avanzado, los pacientes que respondían bien al tratamiento anti-PD-1 presentaron funciones microbianas estables y
linfocitos CD8+ reactivos a los péptidos bacterianos de Lachnospiraceae, que imitan antígenos tumorales, lo que pone de relieve la funcionalidad microbiana como posible marcador pronóstico y complemento terapéutico en la inmunoterapia contra el cáncer 16.
Estos datos ponen de relieve la necesdad de integrar la genómica humana y microbiana en las evaluaciones farmacológicas. En el desarrollo de fármacos, la simulación informática de las interacciones microbiota-fármaco ha pasado a ser un elemento clave. Dodd y Cane propusieron un marco detallado que combina sistemas in vitro (como bibliotecas de cepas, comunidades derivadas de heces), herramientas
genéticas (ensayos de ganancia/ pérdida de función) y metagenómica para identificar genes microbianos implicados en el metabolismo de fármacos. Los modelos murinos gnotobióticos ayudan a diferenciar los efectos microbianos de los de los anfitriones en la farmacocinética.
A medida que avanza este campo, se perfila que una manera de personalizar los tratamientos y de reducir los efectos adversos será la prescripción teniendo en cuenta a la microbiota. En el futuro, la farmacomicrobiómica podría orientar las elecciones de fármacos y su posología según los biomarcadores microbianos, para dar paso a una medicina verdaderamente personalizada 17.
Es posible que, en el futuro, la personalización del tratamiento necesite de un perfil de la microbiota.
Preservar y restablecer la microbiota: Una frontera terapéutica
Proteger la microbiota intestinal durante el tratamiento farmacológico es una estrategia prometedora para reducir los efectos adversos y preservar la eficacia. Aunque se ha observado que los probióticos y los prebióticos presentan algunos beneficios contra la disbiosis inducida por fármacos, su eficacia varía. Los probióticos específicos adaptados a efectos farmacológicos concretos y el trasplante de microbiota fecal (TMF), en concreto para la infección recurrente por C. difficile, ofrecen opciones más fiables.
Se están investigando herramientas de precisión como inhibidores de enzimas microbianas (por ejemplo, bloqueadores de la beta glucuronidasa para frenar la toxicidad del irinotecán), probióticos de bioingeniería, el desarrollo de fármacos que no afecten a la microbiota e intervenciones basadas en la alimentación. Los ensayos clínicos están explorando los simbióticos adaptados a la farmacoterapia para mejorar los resultados con la mínima alteración de la microbiota. También se están evaluando los postbióticos, como el butirato, por sus efectos antiinflamatorios y de refuerzo de la barrera intestinal.
La integración de estrategias dirigidas a la microbiota en la farmacología necesitará herramientas avanzadas —multiómica, aprendizaje automático y modelización de sistemas del microbioma— para predecir y gestionar eficazmente las interacciones microbiota-fármaco.
La manipulación de la microbiota intestinal puede mejorar el éxito del tratamiento y reducir las complicaciones.
CONCLUSIÓN
Las interacciones microbiota-fármaco son un aspecto emergente y a menudo ignorado de la medicina, que tiene importantes repercusiones en los resultados de los tratamientos. La integración de estos conocimientos en la práctica clínica es fundamental para desarrollar tratamientos más seguros, más precisos y respetuosos con la microbiota. A medida que aumentan las pruebas, surgen nuevas oportunidades de modular el microbioma y así potenciar la eficacia, reducir la toxicidad y recuperar las respuestas
a los fármacos.
Los planteamientos innovadores como los bioterapéuticos vivos, los microbios genomanipulados y los metabolitos derivados de la microbiota (“farmabióticos”) están remodelando la farmacoterapia. Aunque el interés normativo es cada vez mayor, los protocolos clínicos normalizados se encuentran aún en fase de desarrollo. En un futuro cercano, la ingeniería del microbioma podría convertirse en un componente habitual de la atención médica personalizada basada en sistemas.
- Valdes AM, Walter J, Segal E, Spector TD. Role of the gut microbiota in nutrition and health. BMJ 2018; 361: k2179.
- Zhao Q, Chen Y, Huang W, Zhou H, Zhang W. Drug-microbiota interactions: an emerging priority for precision medicine. Signal Transduct Target Ther 2023; 8: 386.
- Wallace BD, Wang H, Lane KT, et al. Alleviating cancer drug toxicity by inhibiting a bacterial enzyme. Science 2010; 330: 831-5.
- Bolte LA, Björk JR, Gacesa R, Weersma RK. Pharmacomicrobiomics: The Role of the Gut Microbiome in Immunomodulation and Cancer Therapy. Gastroenterology 2025 Online publication ahead of print.
- Nel Van Zyl K, Matukane SR, Hamman BL, Whitelaw AC, Newton-Foot M. Effect of antibiotics on the human microbiome: a systematic review. Int J Antimicrob Agents 2022; 59: 106502.
- Maier L, Goemans CV, Wirbel J, et al. Unravelling the collateral damage of antibiotics on gut bacteria. Nature 2021; 599: 120-4.
- Vich Vila A, Collij V, Sanna S, et al. Impact of commonly used drugs on the composition and metabolic function of the gut microbiota. Nat Commun 2020; 11: 362.
- Macke L, Schulz C, Koletzko L, Malfertheiner P. Systematic review: the effects of proton pump inhibitors on the microbiome of the digestive tract-evidence from next-generation sequencing studies. Aliment Pharmacol Ther 2020; 51: 505-26.
- Le Bastard Q, Berthelot L, Soulillou JP, Montassier E. Impact of non-antibiotic drugs on the human intestinal microbiome. Expert Rev Mol Diagn 2021; 21: 911-24.
- Maier L, Pruteanu M, Kuhn M, et al. Extensive impact of non-antibiotic drugs on human gut bacteria. Nature 2018; 555: 623-8.
- Weersma RK, Zhernakova A, Fu J. Interaction between drugs and the gut microbiome. Gut 2020; 69: 1510-9.
- Zimmermann M, Zimmermann-Kogadeeva M, Wegmann R, Goodman AL. Mapping human microbiome drug metabolism by gut bacteria and their genes. Nature 2019; 570: 462-7. •
- Haiser HJ, Gootenberg DB, Chatman K, Sirasani G, Balskus EP, Turnbaugh PJ. Predicting and manipulating cardiac drug inactivation by the human gut bacterium Eggerthella lenta. Science 2013; 341: 295-8.
- Takasuna K, Hagiwara T, Hirohashi M, et al. Involvement of beta-glucuronidase in intestinal microflora in the intestinal toxicity of the antitumor camptothecin derivative irinotecan hydrochloride (CPT-11) in rats. Cancer Res 1996; 56: 3752-7.
- Javdan B, Lopez JG, Chankhamjon P, et al. Personalized mapping of drug metabolism by the human gut microbiome. Cell 2020; 181: 1661-79.e22.
- Macandog ADG, Catozzi C, Capone M, et al. Longitudinal analysis of the gut microbiota during anti-PD-1 therapy reveals stable microbial features of response in melanoma patients. Cell Host Microbe 2024; 32: 2004-18.e9.
- Dodd D, Cann I. Tutorial: Microbiome studies in drug metabolism. Clin Transl Sci 2022; 15: 2812-37.

