¿Podemos actuar sobre la microbiota en el abordaje de niños con trastornos funcionales de dolor abdominal?
Por Iulia Florentina Tincu, Roxana Elena Matran, Cristina Adriana Becheanu
Universidad de Medicina y Farmacia Carol Davila, Rumanía
Espacio para el público general
Encuentra aquí tu espacio dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Acerca de este artículo
El intestino disbiótico en los trastornos funcionales de dolor abdominal en niños
Los trastornos funcionales de dolor abdominal (TFDA), también conocidos como trastornos funcionales gastrointestinales (TFGI), representan una de las principales etiologías de dolor abdominal crónico en la población pediátrica e implican la interacción entre factores de regulación del sistema nervioso entérico y del sistema nervioso central [1]. El sistema de clasificación actual, ROMA IV, distingue varios TFGI con predominio del dolor a partir de patrones de síntomas reconocibles, como la dispepsia funcional (DF), el síndrome del intestino irritable (SII), la migraña abdominal y el dolor abdominal funcional no especificado (DAF-NOS) 2. Durante las
dos últimas décadas, numerosos estudios han investigado las posibles causas y mecanismos subyacentes de aparición, pero aún no se ha descubierto con detalle la fisiopatología, a pesar de los hallazgos de la neurogastroenterología pediátrica en términos de motilidad intestinal, moléculas de señalización, cambios en la microbiota o mecanismos epigenéticos 3.
Es posible que las modificaciones de la microbiota intestinal, conocidas como intestino disbiótico, desempeñen una función en los trastornos funcionales de dolor abdominal a través de la alteración de la inmunidad y de la integridad intestinales 4, 5. En numerosos estudios se describe un nivel inferior de diversidad microbiana en los pacientes con trastornos funcionales de dolor abdominal 6, 7 y especies como Lactobacilli y Bifidobacteria se encuentran considerablemente alteradas 8. Por lo tanto, disponemos de cada vez más datos clínicos sobre el uso de probióticos en el abordaje de los trastornos funcionales, aunque faltan datos de estudios en niños 9.
Perspectivas de investigación
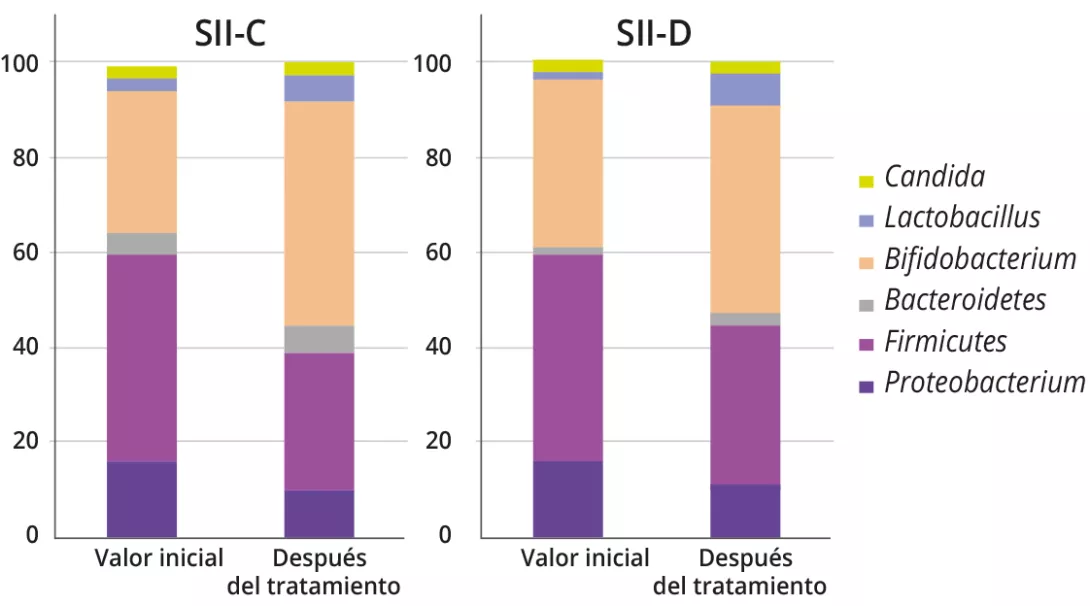
El análisis de la microbiota en 18 pacientes con TFGI proporcionó datos sobre la disbiosis intestinal en el momento del diagnóstico y sus cambios durante de un período de tres meses de tratamiento con cepas específicas de probióticos y prebióticos
(figura 1).
Pacientes. Entre 4 y 14 años de edad y con un diagnóstico de trastornos funcionales de dolor abdominal (dispepsia funcional y síndrome del intestino irritable) de acuerdo con los criterios de ROMA IV.
Intervención. Seis cepas bacterianas (Lactobacillus rhamnosus R0011, Lactibacillus casei R0215, Bifidobacterium lactis BI-04, Lactobacillus acidophilus La-14, Bifidobacterium longum BB536, Lactobacillus plantarum R1012) y 210 mg de fructooligosacáridos-inulina. Se administró una cápsula por vía oral, a diario, durante 12 semanas, y la medicación fue suministrada por profesionales sanitarios.
Resultado clínico. Se puntuó la gravedad de las molestias abdominales, la dispepsia, la flatulencia y el dolor epigástrico en una escala ordinal (calificación numérica) de diez puntos.
Se recogieron muestras fecales de los participantes antes y después del tratamiento con un kit especial de laboratorio con dos recipientes estériles, que se llevaron al laboratorio en condiciones que dependían del tiempo transcurrido desde la recogida hasta la entrega al laboratorio: si el intervalo era inferior a 24 horas, se almacenaban ambos recipientes y se transportaban en condiciones refrigeradas a 4 °C; si el período entre la deposición de las heces y la entrega al laboratorio superaba las 24 h, se almacenaba uno de
los recipientes congelado a -80 °C hasta el análisis, y el otro se refrigeraba a 4 °C. Las muestras de heces se analizaron mediante la prueba Colonic dysbiosis-basic profile (SBY 1) realizada por Synlab-Alemania. La composición de la microbiota se expresó como número de unidades formadoras de colonias (UFC) de diversas especies bacterianas y fúngicas aerobias/ anaerobias. El análisis proporcionó datos sobre pH fecal, IgA en μg/mL (rangos normales 510-2040 μg/mL), lactoferrina en μg/mL (rangos normales <7,2), calprotectina en mg/kg (rangos normales <50,0 negativo, 50-99 intermedio, >100 positivo).
En el análisis microbiano fecal se observó un aumento de la proporción de géneros bacterianos asociados a beneficios para la salud (por ejemplo, Bifidobacterium y Lactobacillus), tanto para el SII-C como para el SII-D (SII-C: 31,1 ± 16,7 % frente a 47,7 ± 13,5 %, p = 0,01; SII-D: 35,8 ± 16,2 % frente a 44,1 ± 15,1 %, p = 0,01). Por otro lado, se comprobó que los géneros de bacterias nocivas como
Escherichia, Clostridium, y Klebsiella disminuían después del tratamiento (21,3 ± 16,9 % frente a 16,3 ± 9,6 %, p = 0,02). No se observaron particularidades en los niños con DF.
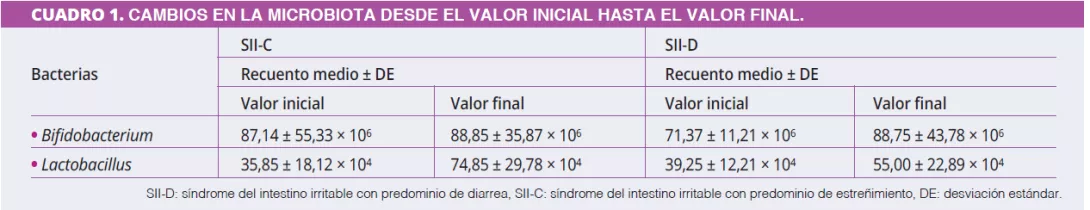
Al inicio, antes de que se produjera cualquier intervención simbiótica, los perfiles de Bifidobacterium eran significativamente diferentes entre SII-C y SII-D (87,14 ± 23,19 frente a 71,37 ± 12,24; p = 0,02), con recuentos más bajos en SII-D. La administración simbiótica tuvo
un efecto significativo en los perfiles bacterianos desde el inicio hasta el final del tratamiento, tanto en el grupo SII-C como en el SII-D (cuadro 1).
Consecuencias prácticas
Los síntomas clínicos en la población del estudio disminuyeron más tras el tratamiento, con significación estadística, lo que sugiere que influir en la disbiosis intestinal también puede reducir la carga de los pacientes además de mejorar las puntuaciones clínicas.
En total, 14 (el 78 %) pacientes afirmaron que el tratamiento había funcionado (definido como ausencia de dolor). La proporción de pacientes con un alivio adecuado de los síntomas fue mayor en el grupo SII-D que en el grupo SII-C; sin embargo, la diferencia no fue estadísticamente significativa (74,4 % frente al 61,9 %, p = 0,230). Tanto en el grupo SII-C como en el SII-D, las puntuaciones en la escala de Bristol mejoraron significativamente tras la intervención (valor inicial frente a después del tratamiento; 2,8 ± 0,6 frente a 3,9 ± 0,9, p = 0,03, 6,1 ± 0,9 frente a 4,1 ± 1,0, p = 0,01, respectivamente). Tanto la distensión abdominal como la flatulencia mejoraron significativamente en los grupos SII-C y SII-D (SII-C: 6,5 ± 2,8 frente a 3,7 ± 1,8, P = 0,01; SII-D: 5,9 ± 2,2 frente a 2,9 ± 1,8, P = 0,01).
- La exploración del microbioma humano ha revelado a lo largo del tiempo que la disbiosis desempeña una importante función en la patogénesis de los trastornos funcionales de dolor
abdominal, aunque los perfiles específicos como biomarcadores tempranos están aún lejos de tener un uso práctico en la actualidad. - Hay una necesidad real de futuros estudios unitarios en términos de intervenciones modificadoras de la microbiota para obtener un contexto más amplio de los trastornos pediátricos.
- Podemos concluir que una perspectiva novedosa en el campo en desarrollo de las terapias que modifican la microbiota en niños con TFGI puede aportar valiosos conocimientos sobre los mecanismos de la enfermedad, con lo que las estrategias terapéuticas personalizadas podrían mejorar los síntomas de los pacientes.
CONCLUSIÓN
Puede que la intervención centrada en la microbiota sea capaz de producir cambios significativos en la disbiosis gastrointestinal y este hallazgo está relacionado con el alivio de los síntomas gastrointestinales en pacientes con trastornos funcionales de dolor abdominal.
- Royle JT, Hamel-Lambert J. Biopsychosocial issues in functional abdominal pain. Pediatr Ann 2001; 30: 32-40.
- Hyams JS, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, van Tilburg M. Functional Disorders: Children and Adolescents. Gastroenterology 2016: S0016-5085.
- Oświęcimska J, Szymlak A, Roczniak W, Girczys-Połedniok K, Kwiecień J. New insights into the pathogenesis and treatment of irritable bowel syndrome. Adv Med Sci 2017; 62: 17-30.
- Chong PP, Chin VK, Looi CY, Wong WF, Madhavan P, Yong VC. The Microbiome and Irritable Bowel Syndrome - A Review on the Pathophysiology, Current Research and Future Therapy. Front Microbiol 2019; 10: 1136. Erratum in: Front Microbiol 2019; 10: 1870.
- Pantazi AC, Mihai CM, Lupu A, et al. Gut Microbiota Profile and Functional Gastrointestinal Disorders in Infants: A Longitudinal Study. Nutrients 2025; 17: 701.
- Carroll IM, Ringel-Kulka T, Keku TO, et al. Molecular analysis of the luminal- and mucosal-associated intestinal microbiota in diarrhea-predominant irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol 2011; 301: G799-807.
- Rosa D, Zablah RA, Vazquez-Frias R. Unraveling the complexity of Disorders of the Gut-Brain Interaction: the gut microbiota connection in children. Front Pediatr 2024; 11: 1283389.
- Bellini M, Gambaccini D, Stasi C, Urbano MT, Marchi S, Usai-Satta P. Irritable bowel syndrome: a disease still searching for pathogenesis, diagnosis and therapy. World J Gastroenterol 2014; 20: 8807-20.
- Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, Risk Factors, and Outcomes of Irritable Bowel Syndrome After Infectious Enteritis: A Systematic Review and Meta-analysis. Gastroenterology 2017; 152: 1042-54.

