Peut-on cibler le microbiote dans la prise en charge des enfants atteints de troubles douloureux abdominaux fonctionnels ?
Par Iulia Florentina Tincu, Roxana Elena Matran, Cristina Adriana Becheanu
Université de médecine et de pharmacie Carol Davila, Roumanie
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres
A propos de cet article
La dysbiose intestinale dans les troubles douloureux abdominaux fonctionnels de l’enfant
Les troubles douloureux abdominaux fonctionnels (TDAF), également appelés troubles gastro-intestinaux fonctionnels (TGIF), représentent l’une des principales étiologies des douleurs abdominales chroniques dans la population pédiatrique, impliquant des interactions entre des facteurs de régulation dans les systèmes nerveux entérique et central 1. Le système de classification actuel, ROME IV, distingue plusieurs TGIF avec douleurs prédominantes en fonction des types de symptômes, à savoir la dyspepsie fonctionnelle (DF), le syndrome de l’intestin irritable (SII), la migraine abdominale et les douleurs abdominales fonctionnelles non spécifiques (DAF-NS) 2. Au cours des deux dernières décennies, de nombreuses études ont recherché les causes possibles et mécanismes sousjacents de ces troubles mais la physiopathologie précise doit encore être établie, malgré les observations réalisées en neurogastro-entérologie pédiatrique concernant la motricité intestinale, les molécules de signalisation, les modifications du microbiote ou les mécanismes épigénétiques 3. Les modifications du microbiote intestinal, désignées par le terme « dysbiose intestinale », pourraient jouer un rôle dans les troubles douloureux abdominaux fonctionnels via l’altération de l’immunité et de l’intégrité intestinales 4, 5. Plusieurs études ont fait état d’une diminution de la diversité microbienne chez les patients atteints de troubles douloureux abdominaux fonctionnels 6, 7 et d’une forte altération d’espèces telles que Lactobacilli et Bifidobacteria 8. Un nombre croissant de données cliniques sont donc recueillies sur l’utilisation des probiotiques dans la prise en charge des troubles fonctionnels, même si les données chez l’enfant sont insuffisantes 9.
Description de l’étude
L’analyse du microbiote de 18 patients atteints de TGIF a fourni des données sur la dysbiose intestinale au moment du diagnostic et sur son évolution sur une période de trois mois de traitement avec des souches spécifiques de probiotiques et de prébiotiques (figure 1).
Population étudiée. Patients âgés de 4 à 14 ans, présentant un diagnostic de troubles douloureux abdominaux fonctionnels (dyspepsie fonctionnelle et syndrome de l’intestin irritable) conformément aux critères ROME IV.
Intervention. Six souches bactériennes (Lactobacillus rhamnosus R0011, Lactibacillus casei R0215, Bifidobacterium lactis BI-04, Lactobacillus acidophilus La-14, Bifidobacterium longum BB536, Lactobacillus plantarum R1012) et 210 mg de fructo-oligosaccharides-inuline. Une gélule a été administrée par voie orale chaque jour pendant 12 semaines, le médicament étant fourni par les professionnels
de santé.
Critère de jugement clinique. Les patients ont été évalués afin de déterminer la sévérité de la gêne abdominale, de la dyspepsie,
des flatulences et des douleurs épigastriques sur une échelle (numérique) ordinale en 10 points.
Des échantillons de selles ont été recueillis chez les participants avant et après le traitement à l’aide d’un kit spécial comportant deux récipients stériles, et transportés au laboratoire dans des conditions différentes selon le temps écoulé entre le recueil et la livraison au laboratoire : si ce délai était inférieur à 24 heures, les deux récipients étaient stockés et acheminés dans des conditions réfrigérés à 4 °C ; si le temps écoulé entre l’évacuation des selles et la livraison au laboratoire dépassait 24 heures, un récipient était stocké à l’état congelé à – 80 °C jusqu’à l’analyse, et l’autre était réfrigéré à 4 °C. Les échantillons de selles ont été analysés à l’aide du test Colonic dysbiosis-basic profile (SBY 1) réalisé par Synlab Allemagne. La composition du microbiote a été exprimée en nombre d’unités formant colonie (UFC) pour différentes espèces fongiques et bactériennes aérobies/anaérobies. L’analyse a fourni des données sur le pH fécal, les IgA en μg/mL (valeurs normales 510–2 040 μg/mL), la lactoferrine en μg/mL (valeurs normales < 7,2), la calprotectine en mg/kg (valeurs normales < 50,0 négative, 50–99 intermédiaire, > 100 positive).
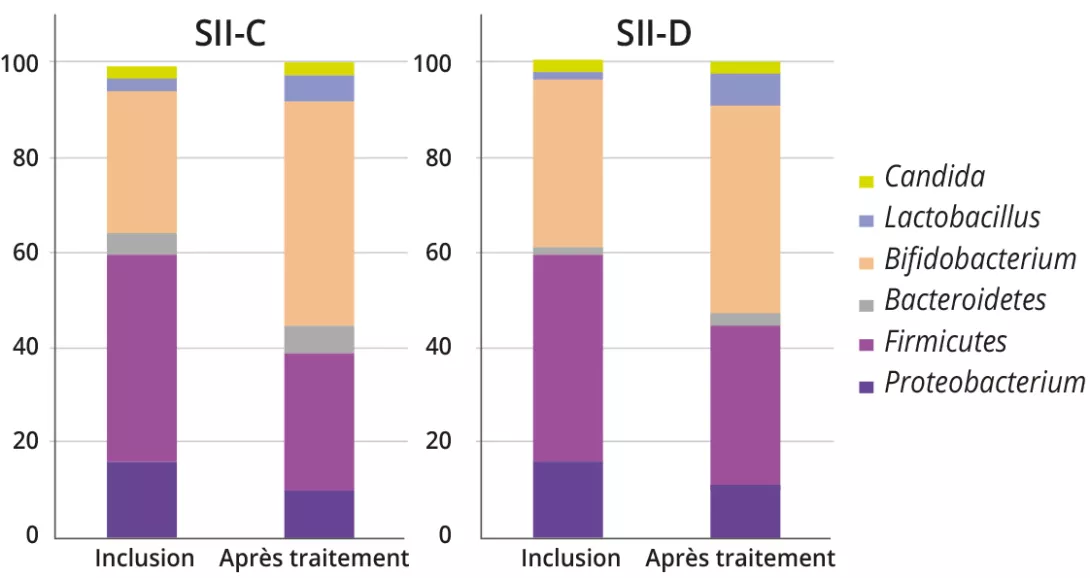
L’analyse microbienne fécale a montré une augmentation de la proportion des genres bactériens associés à des bénéfices pour la santé (p. ex. Bifidobacterium et Lactobacillus), à la fois pour le SII-C et le SII-D (SII-C : 31,1 ± 16,7 % vs 47,7 ± 13,5 %, p = 0,01 ; SII-D : 35,8 ± 16,2 % vs 44,1 ± 15,1 %, p = 0,01). À l’inverse, les genres de bactéries nocives, à savoir Escherichia, Clostridium et Klebsiella, étaient diminués après le traitement (21,3 ± 16,9 % vs 16,3 ± 9,6 %, p = 0,02). Aucune particularité n’a été observée chez les enfants atteints de DF.
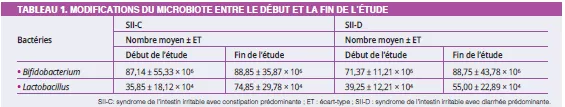
À l’inclusion, avant toute intervention symbiotique, les profils de Bifidobacterium étaient significativement différents entre le SII-C et le SII-D (87,14 ± 23,19 vs 71,37 ± 12,24 ; p = 0,02), avec des nombres plus faibles dans le SII-D. L’administration du symbiotique a eu un effet significatif sur les profils bactériens entre l’inclusion et la fin du traitement dans les deux groupes SII-C et SII-D (Tableau 1).
Conséquences en pratique
Les symptômes cliniques de la population de l’étude ont diminué de manière statistiquement significative après le traitement, suggérant que le fait d’agir sur la dysbiose intestinale pourrait également permettre de réduire le fardeau des patients et améliorer les scores cliniques.
En tout, 14 (78 %) patients ont rapporté une réussite du traitement (définie par l’absence de douleurs). La proportion de patients connaissant un soulagement adéquat des symptômes était plus élevée dans le groupe SII-D que dans le groupe SII-C ; cependant, la différence n’était pas statistiquement significative (74,4 % vs 61,9 %, p = 0,230). Dans les deux groupes SII-C et SII-D, les scores à l’échelle de Bristol étaient significativement améliorés après l’intervention (inclusion vs après traitement ; 2,8 ± 0,6 vs 3,9 ± 0,9, p = 0,03, 6,1 ± 0,9 vs 4,1 ± 1,0, p = 0,01, respectivement). La distension abdominale et les flatulences étaient significativement améliorées dans les deux groupes SII-C et SII-D (SII-C : 6,5 ± 2,8 vs 3,7 ± 1,8, p = 0,01 ; SII-D : 5,9 ± 2,2 vs 2,9 ± 1,8, p = 0,01).
- L’exploration du microbiote humain au cours du temps a révélé que la dysbiose joue un rôle important dans la pathogenèse des troubles douloureux abdominaux fonctionnels, mais des profils spécifiques sont encore loin d’être utilisés dans la pratique actuelle à titre de biomarqueurs précoces.
- D’autres études doivent être réalisées sur les interventions modulant le microbiote pour un plus large éventail de troubles pédiatriques.
- Nous pouvons conclure qu’une nouvelle approche dans le domaine en pleine expansion des traitements modulant le microbiote chez les enfants atteints de TGIF pourrait apporter des informations précieuses sur les mécanismes pathologiques, permettant d’envisager des stratégies thérapeutiques personnalisées à même d’améliorer les symptômes des patients.
Conclusion
Une intervention ciblant le microbiote pourrait entraîner des modifications significatives de la dysbiose gastro-intestinale, en lien avec un soulagement des symptômes gastro-intestinaux chez les patients atteints de troubles douloureux abdominaux fonctionnels.
- Royle JT, Hamel-Lambert J. Biopsychosocial issues in functional abdominal pain. Pediatr Ann 2001; 30: 32-40.
- Hyams JS, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, van Tilburg M. Functional Disorders: Children and Adolescents. Gastroenterology 2016: S0016-5085.
- Oświęcimska J, Szymlak A, Roczniak W, Girczys-Połedniok K, Kwiecień J. New insights into the pathogenesis and treatment of irritable bowel syndrome. Adv Med Sci 2017; 62: 17-30.
- Chong PP, Chin VK, Looi CY, Wong WF, Madhavan P, Yong VC. The Microbiome and Irritable Bowel Syndrome - A Review on the Pathophysiology, Current Research and Future Therapy. Front Microbiol 2019; 10: 1136. Erratum in: Front Microbiol 2019; 10: 1870.
- Pantazi AC, Mihai CM, Lupu A, et al. Gut Microbiota Profile and Functional Gastrointestinal Disorders in Infants: A Longitudinal Study. Nutrients 2025; 17: 701.
- Carroll IM, Ringel-Kulka T, Keku TO, et al. Molecular analysis of the luminal- and mucosal-associated intestinal microbiota in diarrhea-predominant irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol 2011; 301: G799-807.
- Rosa D, Zablah RA, Vazquez-Frias R. Unraveling the complexity of Disorders of the Gut-Brain Interaction: the gut microbiota connection in children. Front Pediatr 2024; 11: 1283389.
- Bellini M, Gambaccini D, Stasi C, Urbano MT, Marchi S, Usai-Satta P. Irritable bowel syndrome: a disease still searching for pathogenesis, diagnosis and therapy. World J Gastroenterol 2014; 20: 8807-20.
- Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, Risk Factors, and Outcomes of Irritable Bowel Syndrome After Infectious Enteritis: A Systematic Review and Meta-analysis. Gastroenterology 2017; 152: 1042-54.

