É possível ter como alvo a microbiota no tratamento de crianças com perturbações funcionais da dor abdominal?
Pelo Iulia Florentina Tincu, Roxana Elena Matran, Cristina Adriana Becheanu
Universidade de Medicina e Farmácia Carol Davila, Roménia
Área para o público geral
Encontre aqui o seu espaço dedicado
en_sources_title
en_sources_text_start en_sources_text_end
Capítulos
Sobre este artigo
O intestino disbiótico nas perturbações funcionais da dor abdominal em crianças
As perturbações funcionais da dor abdominal (FAPDs), também designadas por perturbações gastrointestinais funcionais (FGIDs), representam uma das principais etiologias da dor abdominal crónica na população pediátrica que envolve a interação entre fatores reguladores nos sistemas nervoso entérico e central 1. O sistema de classifi cação atual, ROME IV, distingue vários FGIDs com predominância de dor com base nos seus padrões reconhecíveis de sintomas, tais como a dispepsia funcional (DF), a síndrome do intestino irritável (SII), a enxaqueca abdominal e a FAP não especifi cada (FAP-NOS) 2. Durante as duas últimas décadas, diversos estudos investigaram as possíveis causas e mecanismos subjacentes ao aparecimento, mas a fi siopatologia clara ainda não foi revelada, apesar das descobertas da neurogastroenterologia pediátrica em termos de motilidade intestinal, moléculas de sinalização,
alterações na microbiota ou mecanismos epigenéticos 3. As modifi cações da microbiota intestinal, conhecidas como intestino disbiótico, podem desempenhar um papel nas perturbações funcionais da dor abdominal através da imunidade intestinal e da alteração da integridade 4, 5. Vários estudos relataram um nível mais baixo de diversidade microbiana em doentes com perturbações funcionais da dor abdominal 6, 7 e espécies como os Lactobacilli e as Bifidobacteria estão fortemente alteradas 8. Assim, foi reunido um conjunto crescente de dados clínicos sobre a utilização de probióticos no tratamento de perturbações funcionais, embora faltem dados de estudos sobre crianças 9.
Informações sobre a investigação
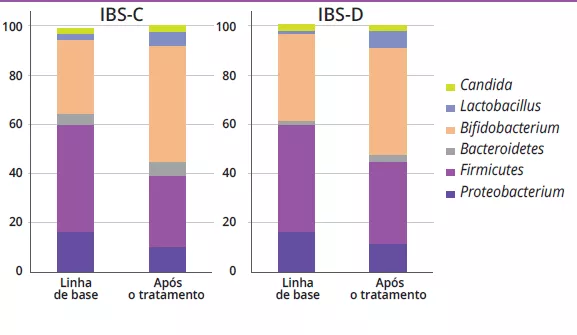
A análise da microbiota em 18 doentes com FGIDs forneceu dados sobre a disbiose intestinal no momento do diagnóstico e as suas alterações ao longo de um período de três meses de tratamento com estirpes específi cas de probióticos e prebióticos (figura 1).
Indivíduos. Idade 4-14 anos e diagnóstico de perturbações funcionais da dor abdominal (dispepsia funcional e síndrome do cólon irritável) de acordo com os critérios de ROME IV.
Intervenção. Seis estirpes bacterianas Lactobacillus rhamnosus R0011, Lactibacillus casei R0215, Bifi dobacterium lactis BI-04, Lactobacillus acidophilus La-14, Bifi dobacterium longum BB536, Lactobacillus plantarum R1012) e 210 mg de fructo-oligossacarídeos-inulina. Foi administrada uma cápsula por via oral, diariamente, durante 12 semanas, e a medicação foi fornecida pelos profissionais de saúde.
Resultados clínicos. Os doentes foram avaliados quanto à gravidade do desconforto abdominal, dispepsia, flatulência e dor epigástrica numa escala ordenada de dez pontos (classificação numérica)
As amostras de fezes foram colhidas dos participantes antes e depois do tratamento, utilizando um kit especial de laboratório com dois recipientes esterilizados, que foram depois levados para o laboratório em condições que dependiam do tempo decorrido entre a colheita e a entrega no laboratório: se o intervalo fosse inferior a 24 horas, ambos os recipientes eram armazenados e transportados em condições de refrigeração a 4 °C; se o período entre a eliminação das fezes e a entrega no laboratório fosse superior a 24 horas,
um recipiente era armazenado congelado a -80 °C até à análise e o outro era refrigerado a 4 °C. As amostras de fezes foram analisadas utilizando o teste Colonic dysbiosis-basic profile (SBY 1) realizado pela Synlab-Germany. A composição da microbiota foi expressa em número de unidades formadoras de colónias (CFU) para várias espécies bacterianas e fúngicas aeróbias/anaeróbias. A análise forneceu dados sobre o pH fecal, IgA em μg/ mL (intervalos normais 510-2.040 μg/ mL), lactoferina μg/mL (intervalos normais < 7,2), calprotectina em mg/kg (intervalos normais < 50,0 negativo, 50-99 intermediário, > 100 positivo).
Na análise microbiana fecal, verificou-seum aumento da proporção de géneros bacterianos associados a benefícios para a saúde (por exemplo, Bifidobacterium e Lactobacillus), tanto para a IBS-C como para a IBS-D (IBS-C: 31,1 ± 16,7% vs. 47,7 ± 13,5%, p = 0,01; IBS-D: 35,8 ± 16,2% vs. 44,1 ± 15,1%, p = 0,01). Por outro lado, verificou-se que os géneros de bactérias nocivas, incluindo Escherichia, Clostridium e Klebsiella, diminuíram após o tratamento (21,3 ± 16,9% vs. 16,3 ± 9,6%, p = 0,02). Não foram encontradas particularidades nas crianças com DF.
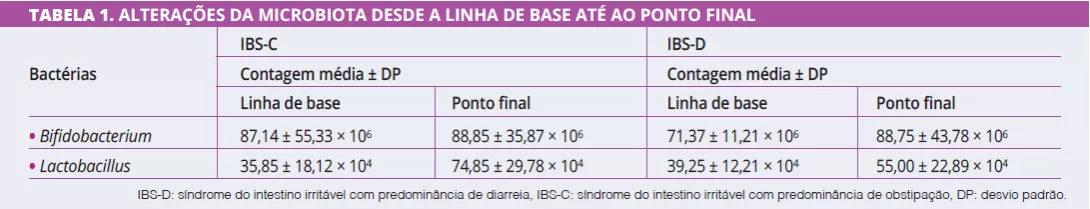
Na linha de base, antes de qualquer intervenção simbiótica, os perfis de Bifidobacterium eram significativamente diferentes entre IBS-C e IBS-D (87,14 ± 23,19 vs. 71,37 ± 12,24; p = 0,02), com contagens mais baixas em IBS-D. A administração simbiótica teve um efeito significativo nos perfis bacterianos desde a linha de base até ao fim do tratamento em ambos os grupos IBS-C e IBS-D (Tabela 1).
Consequências práticas
Os sintomas clínicos na população estudada diminuíram mais após o tratamento, com significado estatístico, sugerindo que influenciar a disbiose intestinal pode também reduzir o fardo dos doentes e melhorar os resultados clínicos.
No geral, 14 (78%) doentes relataram sucesso no tratamento (definido como ausência de dor). A proporção de doentes com alívio adequado dos sintomas foi maior no grupo IBS-D do que no grupo IBS-C; no entanto, a diferença não foi estatisticamente significativa (74,4% vs. 61,9%, P = 0,230). Em ambos os grupos IBS-C e IBS-D, as pontuações na escala de Bristol melhoraram significativamente
após a intervenção (linha de base vs. após o tratamento; 2,8 ± 0,6 vs. 3,9 ± 0,9, P = 0,03, 6,1 ± 0,9 vs. 4,1 ± 1,0, P = 0,01, respetivamente). A distensão abdominal e a flatulência melhoraram significativamente nos grupos IBS-C e IBS-D (IBS-C: 6,5 ± 2,8 vs. 3,7 ± 1,8, P = 0 01; IBS-D: 5,9 ± 2,2 vs. 2,9 ± 1,8, P = 0,01).
- A exploração do microbioma humano revelou, ao longo do tempo, que a disbiose tem um papel substancial na patogénese das perturbações funcionais da dor abdominal, embora os perfis específicos como biomarcadores iniciais ainda estejam longe da utilização prática atual
- Há uma necessidade real de futuros estudos unitários em termos de intervenções modificadoras da microbiota para um panorama mais vasto de doenças pediátricas
- Podemos concluir que uma nova perspetiva no campo crescente das terapias modificadoras da microbiota em crianças com FGIDs pode oferecer conhecimentos valiosos sobre os mecanismos da doença para que estratégias terapêuticas personalizadas possam melhorar os sintomas dos doentes
CONCLUSÃO
A intervenção orientada para a microbiota pode resultar em alterações significativas na disbiose gastrointestinal e esta descoberta está relacionada com o alívio dos sintomas gastrointestinais em doentes com perturbações funcionais da dor abdominal.
- Royle JT, Hamel-Lambert J. Biopsychosocial issues in functional abdominal pain. Pediatr Ann 2001; 30: 32-40.
- Hyams JS, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, van Tilburg M. Functional Disorders: Children and Adolescents. Gastroenterology 2016: S0016-5085.
- Oświęcimska J, Szymlak A, Roczniak W, Girczys-Połedniok K, Kwiecień J. New insights into the pathogenesis and treatment of irritable bowel syndrome. Adv Med Sci 2017; 62: 17-30.
- Chong PP, Chin VK, Looi CY, Wong WF, Madhavan P, Yong VC. The Microbiome and Irritable Bowel Syndrome - A Review on the Pathophysiology, Current Research and Future Therapy. Front Microbiol 2019; 10: 1136. Erratum in: Front Microbiol 2019; 10: 1870.
- Pantazi AC, Mihai CM, Lupu A, et al. Gut Microbiota Profile and Functional Gastrointestinal Disorders in Infants: A Longitudinal Study. Nutrients 2025; 17: 701.
- Carroll IM, Ringel-Kulka T, Keku TO, et al. Molecular analysis of the luminal- and mucosal-associated intestinal microbiota in diarrhea-predominant irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol 2011; 301: G799-807.
- Rosa D, Zablah RA, Vazquez-Frias R. Unraveling the complexity of Disorders of the Gut-Brain Interaction: the gut microbiota connection in children. Front Pediatr 2024; 11: 1283389.
- Bellini M, Gambaccini D, Stasi C, Urbano MT, Marchi S, Usai-Satta P. Irritable bowel syndrome: a disease still searching for pathogenesis, diagnosis and therapy. World J Gastroenterol 2014; 20: 8807-20.
- Klem F, Wadhwa A, Prokop LJ, et al. Prevalence, Risk Factors, and Outcomes of Irritable Bowel Syndrome After Infectious Enteritis: A Systematic Review and Meta-analysis. Gastroenterology 2017; 152: 1042-54.

