Des voies interconnectées relient les lipides plasmatiques, le microbiote fécal et l’activité cérébrale à la cognition liée à la malnutrition infantile
ARTICLE COMMENTE- Rubrique enfant
Par le Pr. Emmanuel Mas
Gastro-entérologie et nutrition, Hôpital des Enfants, Toulouse, France
Commentaire de l’article de Portlock et al., Nat Commun 1
Section grand public
Retrouvez ici votre espace dédié
en_sources_title
en_sources_text_start en_sources_text_end
Chapitres

A propos de cet article
La malnutrition touche plus de 30 millions d’enfants chaque année et a des répercussions immédiates et durables profondes. Les enfants qui y survivent souffrent souvent de séquelles neurocognitives durables qui ont un impact sur leurs résultats scolaires et leur situation socioéconomique. Les mécanismes à l’origine de ces conséquences sont mal compris. À l’aide de modèles SHAP interprétés par forêt aléatoire multisystèmes et d’une analyse de réseau, les auteurs montrent que la malnutrition aiguë modérée (MAM) est associée à une augmentation de la présence de Rothia mucilaginosa et de Streptococcus salivarius dans les selles et à une diminution de Bacteroides fragilis chez un groupe d’enfants âgés d’un an à Dacca, au Bangladesh. Ces modifications du microbiome forment des voies interconnectées qui impliquent une réduction des taux plasmatiques d’acides gras à chaîne impaire, une diminution de la puissance gamma et bêta de l’électroencéphalogramme dans les régions temporales et frontales du cerveau, et une réduction de la vocalisation. Ces résultats confirment l’hypothèse selon laquelle une colonisation prolongée par des espèces commensales orales retarde le développement du microbiome intestinal et du cerveau. Bien que les liens de causalité doivent être validés par des données empiriques, cette étude fournit des informations utiles pour améliorer les interventions ciblant les déficits neurodéveloppementaux associés à la MAM.
Que sait-on déjà à ce sujet
La malnutrition infantile est un problème majeur de santé publique et une des premières de cause de mortalité avant l’âge de cinq ans. La malnutrition aiguë modérée (MAM) est associée à un retard du développement neurocognitif, mais le lien reste méconnu. Elle est aussi associée à une dysbiose du microbiote intestinal (MI) dont la mise en place est ralentie et marquée par un enrichissement en espèces de Bifidobacterium et Escherichia. Ces perturbations du MI pourraient avoir un impact sur le développement cérébral par l’axe intestin-cerveau, en raison de défaut d’absorption de nutriments ou d’accumulation de métabolites toxiques. Cette communication interorganes pourrait être médiée indirectement par les lipides plasmatiques car les lipides sont le constituant essentiel du cerveau et sont modulés par des métabolites du MI comme les acides biliaires.
Quels sont les principaux résultats apportés par cette étude ?
Cette étude a été réalisée dans la région de Mirpur au Bengladesh et a comparé 159 enfants avec MAM à 75 témoins bien nourris à l’âge de 12 mois. La MAM a été définie par un rapport poids/taille entre - 2 et – 3 z-scores. Le groupe MAM était significativement associé à des facteurs sociaux-démographiques (toilettes, mode d’accouchement et traitement de l’eau – bouilloire).
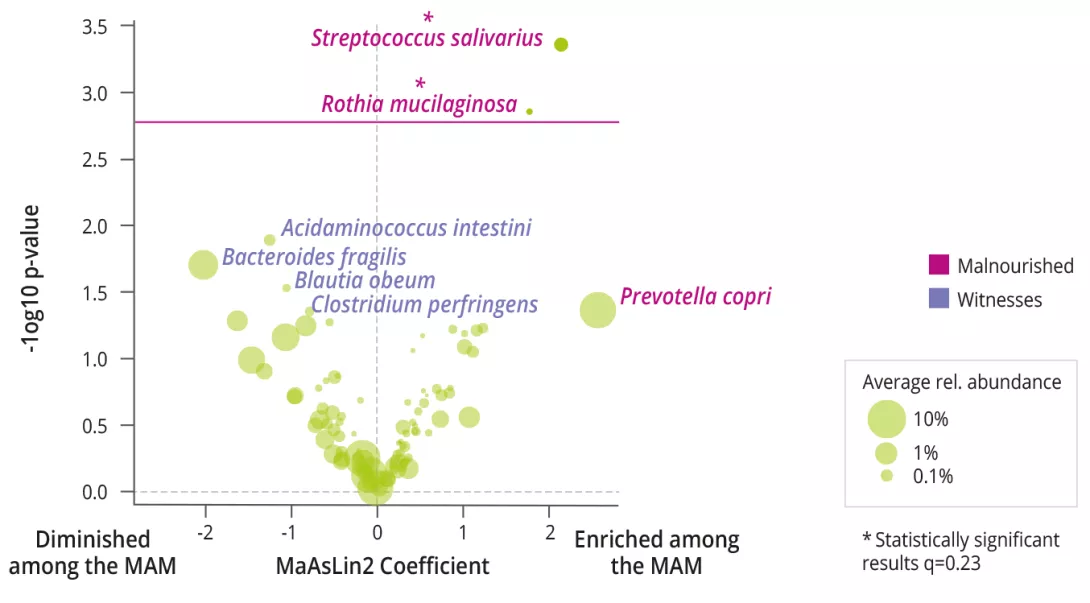
La MAM était associée à une diversité alpha bactérienne diminuée (Shannon), à une prévalence et abondance augmentées de Rothia mucilaginosa et de Streptococcus salivarius (figure 1), et à un ratio Bacteroidetes/Firmicutes augmenté. Les analyses fonctionnelles du MI n’ont pas montré de différences.
L’électroencéphalogramme (EEG) montrait une diminution significative des fréquences béta (12-30 Hz) et gamma (30-45 Hz) au niveau des régions temporales et frontales chez les enfants avec MAM. Une diminution significative des scores de communication expressive, de motricité fine et globale, ainsi que de la vocalisation était aussi observée.
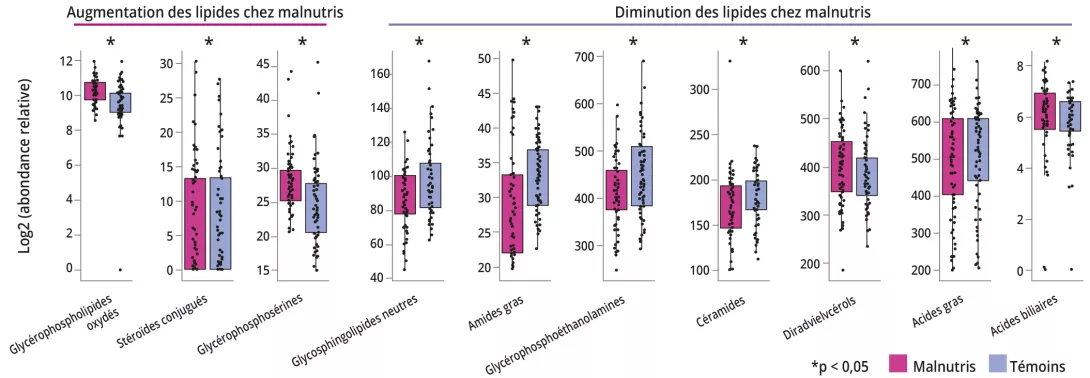
Après correction du mode d’accouchement, du sexe et de la durée d’allaitement exclusif, la MAM était associée à des changements du lipidome plasmatique, avec une abondance relative augmentée de 128 (16 %) composés et diminuée de 189 (24 %) (figure 2).
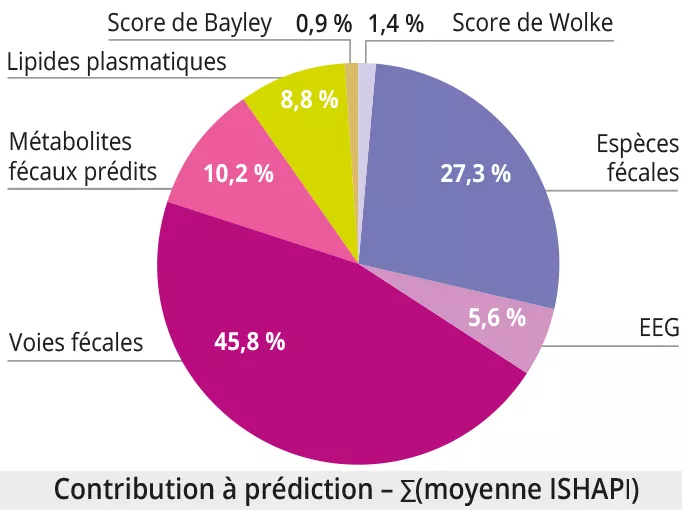
L’intégration des données multimodales a montré que les meilleurs prédicteurs de MAM à 12 mois étaient : 1)les lipides plasmatiques (AUROC = 0,95 ± 0,05) ; 2) les mesures cérébrales et comportementales (score de Wolke, EEG, score de Bayley) (AUROC = 0,73 ± 0,05, 0,71 ± 0,10, 0,68 ± 0,07 respectivement) ; 3) le profil taxonomique, fonctionnel et des métabolites prédits du microbiome fécal (AUROC = 0,56 ± 0,07, 0,53 ± 0,07, 0,52 ± 0,06). À noter la part importante des données liées au microbiome fécal pour prédire la MAM en analyse multimodale, malgré la faible performance du microbiome fécal (figure 3).
L’analyse multimodale des réseaux a permis de prédire qu’un cluster de B. fragilis, de voies de fermentation du pyruvate, de céramides plasmatiques, d’EEG et de communication expressive était fortement corrélé avec un bon état nutritionnel à 12 mois. Enfin, l’effet le plus fort comme interaction interespèces était observé entre R. mucilaginosa et S. salivarius dont la présence combinée amplifiait la prédiction de MAM à 12 mois.
Quelles sont les conséquences en pratique ?
Cette étude montre l’importance du MI dans l’état nutritionnel du nourrisson. La présence de bactéries orales commensales gram positives et anaérobies facultatives comme R. mucilaginosa et S. salivarius pourrait être à l’origine d’une dérégulation des acides biliaires. Cela pourrait entraîner des modifications lipidiques importantes pour le développement cérébral.
Par ailleurs, il est important de souligner le bénéfice de B. fragilis en lien avec des voies de fermentation sur l’état nutritionnel à 12 mois.
- La persistance au niveau intestinal de bactéries commensales Rothia mucilaginosa et Streptococcus salivarius chez des enfants MAM supplante la colonisation par Bacteroides fragilis. Cela interfère avec la synthèse d’acides gras qui sont essentiels au développement cérébral
Conclusion
Cette étude met en évidence que la dysbiose du microbiote intestinal est associée à des anomalies du développement cérébral présente chez les enfants avec MAM, via des modifications des lipides plasmatiques.

