Od biegunki do chorób przewlekłych: udokumentowane przypadki konsekwencji dysbiozy mikrobioty jelitowej wywołanej przez antybiotykoterapię
Leczenie antybiotykami może czasami przebiegać bez żadnych widocznych krótkoterminowych skutków ubocznych. Niemniej dysbioza wywołuje biegunkę nawet u 35% pacjentów; w dłuższej perspektywie zaburzenia mikrobioty spowodowane leczeniem antybiotykami moga stanowić czynnik ryzyka wywołania chorób alergicznych, autoimmunologicznych lub metabolicznych.
Sekcja dla ogółu społeczeństwa
Znajdź tutaj swoją dedykowaną przestrzeń
en_sources_title
en_sources_text_start en_sources_text_end
Sekcje
O tym artykule
Autor
Antybiotyki to potężne narzędzie w walce z infekcjami bakteryjnymi. Jednak badania wskazują również na ich szkodliwy wpływ na biliony bakterii komensalnych żyjących w przewodzie pokarmowym. Wywołana antybiotykoterapią dysbioza sprawia, że mikrobiota jelitowa traci zdolność pełnienia swoich funkcji ochronnych. W perspektywie krótkoterminowej dysbioza pozostawia otwarte drzwi dla oportunistycznych patogenów i niektórych wieloopornych bakterii. W dłuższej perspektywie mikrobiota jelitowa, pomimo pewnego stopnia odporności, może mieć trudności z powrotem do stanu pierwotnego.1,2 Istnieje zgoda co do tego, że może to w konsekwencji prowadzić do powstawania szeregu chorób. Niedawno przeprowadzone badania wykazały, że antybiotyki mogą powodować zmiany w różnorodności bakteryjnej, a także obfitości normalnego mikrobiomu i że wpływ ten może się przedłużać (zazwyczaj trwa on 8-12 tygodni po zaprzestaniu podawania antybiotyków).3,4
35%
Biegunka występuje nawet u 35% pacjentów otrzymujących antybiotyki.3,5,6
BIEGUNKA, NAJCZĘSTSZE DZIAŁANIE NIEPOŻĄDANE ANTYBIOTYKÓW
Główną krótkotrwałą konsekwencją antybiotykoterapii są zmiany zachodzące w pasażu jelitowym u niektórych pacjentów, co z kolei najczęściej prowadzi do biegunki. Częstość występowania biegunki poantybiotykowej zależy od kilku czynników (wiek, otoczenie, rodzaj antybiotyku itp.) i może wynosić od 5 do 35% pacjentów przyjmujących antybiotyki.3,5,6

Opinia eksperta
Antybiotyki zaburzają ochronną mikrobiotę jelitową, co może prowadzić do niezamierzonych konsekwencji, w tym do biegunki poantybiotykowej (do 35% pacjentów) i rozwoju opornych na antybiotyki szczepów patogenów, które są przedmiotem obaw na całym świecie w związku ze zwiększonymi kosztami opieki zdrowotnej i śmiertelnością.
Wśród dzieci odsetek ten może sięgać nawet 80%.3 W większości przypadków biegunka ma charakter zaburzenia czysto funkcjonalnego i jest spowodowana dysbiozą wywołaną antybiotykami. Zwykle ma łagodne nasilenie i ustępuje samoistnie po 1-5 dniach. Antybiotyki wykazujące szersze spektrum działania przeciwdrobnoustrojowego, takie jak klindamycyna, cefalosporyny i ampicylina/amoksycylina, są związane z wyższymi wskaźnikami występowania biegunki.6
Antybiotyki to nadzwyczajne odkrycie naukowe ratujące życie milionów ludzi, ale ich nadmierne i nieodpowiednie stosowanie powoduje obecnie poważne obawy o zdrowie, zwłaszcza z uwagi na antybiotykooporność i dysbiozę. Przyjrzyjmy się poświęconej temu tematowi stronie.
Dwie twarze antybiotyków
Szczególny przypadek biegunki c. Difficile
W 10 do 20% przypadków biegunka jest wynikiem zakażenia Clostridioides difficile (wcześniej znanego jako Clostridium difficile) kolonizującego mikrobiotę.6 Jest to utrzymująca się w środowisku w postaci zarodników, gram-dodatnia, bezwzględnie beztlenowa bakteria przetrwalnikująca. Zakażenie następuje poprzez spożycie zarodników. W określonych okolicznościach (np. w przypadku dysbiozy wywołanej antybiotykami) zarodniki mogą kiełkować, a wegetatywne komórki bakteryjne tego oportunistycznego patogenu mogą kolonizować jelita. W fazie infekcyjnej C. difficile produkuje 2 toksyny, które uszkadzają kolonocyty i wywołują reakcję zapalną o różnych perspektywach klinicznych, od umiarkowanej biegunki po rzekomobłoniaste zapalenie okrężnicy, toksyczne rozszerzenie okrężnicy i/ lub śmierć.
1/3
Prawie 1/3 przypadków biegunki poantybiotykowej spowodowana jest przez C. difficile3.
Najbardziej rozpoznawalnymi czynnikami ryzyka zakażenia C. difficile są wiek powyżej 65 lat, stosowanie inhibitorów pompy protonowej, choroby współistniejące i oczywiście stosowanie antybiotyków. Te ostatnie są natomiast najistotniejszym czynnikiem występowania infekcji C. difficile podlegającym naszej kontroli. Związek antybiotyków z zakażeniem C. difficile został ustalony w szpitalach, a ostatnio w środowiskach społecznych,7 gdzie ryzyko zakażenia waha się od średniego dla osób przyjmujących penicyliny, wysokiego wśród osób przyjmujących fluorochinolony i najwyższego u osób otrzymujących klindamycynę. Jeśli chodzi o tetracykliny, nie powodują one zwiększenia ryzyka8. W warunkach szpitalnych, najwyższe ryzyko rozwoju infekcji C. difficile obserwowano w przypadku cefalosporyn (od II do IV generacji), klindamycyny, karbapenemów, trimetoprimu/sulfonamidów, fluorochinolonów i kombinacji penicyliny.9
Kiedy mikrobiota jelitowa staje się rezerwuarem oporności na antybiotyki
Społeczności drobnoustrojów wystawione na działanie antybiotyków reagują w krótkim okresie nie tylko poprzez zmianę składu, ale także ewolucję, optymalizację i rozprzestrzenianie genów opornych na antybiotyki. Ludzka mikrobiota jelitowa nadmiernie narażona na działanie antybiotyków jest obecnie uważana za istotny rezerwuar genów antybiotykooporności, zarówno u dorosłych, jak i u dzieci.2 Znacznie utrudniając zwalczanie infekcji bakteryjnych, oporność na antybiotyki stała się jednym z głównych problemów zdrowia publicznego.
Otwarte drzwi dla chorób niezakaźnych
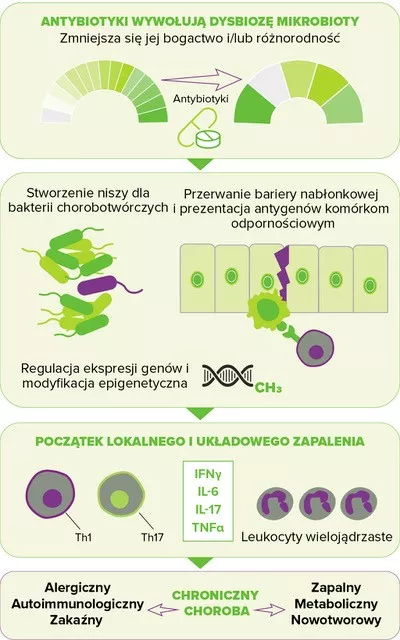
Podejrzewa się również, że zakłócenie mikrobioty jelitowej wynikające z ekspozycji na antybiotyki zwiększa ryzyko wystąpienia niektórych chorób przewlekłych poprzez podwyższenie reakcji zapalnej zarówno lokalnej jak i ogólnoustrojowej, prowadząc w ten sposób do deregulacji metabolizmu i upośledzenia homeostazy immunologicznej10 (rys. 1). Wykazano, że okres okołoporodowy, charakteryzujący się rozwojem układu odpornościowego oraz dojrzewaniem mikrobioty jelitowej, jest okresem szczególnie wrażliwym, w którym dysbioza antybiotykowa przekłada się na długofalowe skutki dla zdrowia, tj. większe ryzyko chorób w późniejszym okresie życia, w tym chorób zapalnych jelit (np. choroba Leśniowskiego-Crohna), chorób atopowych (np. astma) czy zaburzeń metabolicznych (np. cukrzyca typu 2, otyłość).
Przypadek kliniczny
del Lynne V. McFarland, PhD
-
53-letnia kobieta zgłosiła się do lekarza z trwającymi od 3 dni objawami infekcji układu oddechowego (kaszel, ból gardła i katar), a także z gorączką i zmęczeniem. Brak chorób współistniejących; ogólny stan zdrowia - dobry. Lekarz zalecił zbadanie próbki plwociny i przepisał jej 10-dniowy cykl doustnego cefakloru (500 mg, dwa razy dziennie). Analiza plwociny nie wykazała obecności patogenów.
-
Pacjentka została przyjęta do szpitala w trzecim dniu antybiotykoterapii, z powodu pojawienia się ostrej biegunki (sześć wodnistych stolców dziennie i skurcze brzucha) oraz wciąż obecnych objawów oddechowych. Analizy próbek (plwocina i stolec) nie wykazały obecności patogenów. Zaprzestano podawania antybiotyków, ale biegunka trwała przez następne dwa dni.
-
Lekarz przepisał pacjentce erytromycynę (500 mg trzy razy dziennie) i probiotyk przez tydzień. Objawy związane z układem oddechowym i biegunka ustąpiły w ciągu czterech dni. Dzień później pacjentka została wypisana ze szpitala bez żadnych komplikacji.
Co roku od 2015 r. WHO organizuje Światowy Tydzień Wiedzy o Antybiotykach, którego celem jest podnoszenie poziomu wiedzy o ogólnej odporności na mikroorganizmy. Kampania ta, realizowana w dniach 18-24 listopada, zachęca społeczeństwo, pracowników służby zdrowia i decydentów do ostrożnego stosowania antybiotyków, aby zapobiec dalszemu szerzeniu się oporności na nie.