Целіакія
Целіакія - це аутоімунне захворювання органів травлення, викликане непереносимістю глютену. Виявлено багато складових захворювання, в тому числі дисбаланс кишкової флори.
Мікробіота кишківника
Целіакія - це аутоімунне захворювання органів травлення, викликане непереносимістю глютену. Виявлено багато складових захворювання, в тому числі дисбаланс кишкової флори.
Мікробіота кишківника
Глютен - це речовина, яка природним чином міститься в зернах пшениці, ячменю та жита. На відміну від алергії на глютен, непереносимість проявляється повільно і може залишатися непоміченою протягом багатьох років. У західних країнах на захворювання страждає від 0,7 до 2% населення.
У своїй класичній формі целіакія починається приблизно у віці шести місяців, після введення в раціон перших злаків. Класичними симптомами є хронічна діарея, відсутність апетиту і апатія. Однак найчастіше целіакія протікає безсимптомно.
Целіакія з'являється у людей, які мають до неї генетичну схильність. Їх імунна система виробляє антитіла в присутності глютену, які атакують стінку кишківника. В результаті порушується травлення та засвоєння поживних речовин. Тут замішані й інші фактори, такі як вік, у якому був введений глютен, і повторні кишкові інфекції. Мікробіота шлунково-кишкового тракту також може спровокувати захворювання, згідно з гіпотезою, яка підтверджується наявністю дисбактеріозу у цих пацієнтів. Шлунково-кишкова флора містить менше корисних бактерій і більше потенційно патогенних мікробів у порівнянні зі здоровими людьми. Безглютенова дієта зменшує цей дисбаланс, але не може повністю виправити його.
Діагноз грунтується на клінічному обстеженні та наявності характерних ознак, а також на пошуку специфічних антитіл в крові і біопсії (при необхідності). Генетична схильність була показана за допомогою дослідження генів (HLA-типування).
Єдиним методом лікування целіакії є виключення глютену з раціону. Однак інший підхід націлений на дисбактеріоз – зацікавив дослідників. Вона полягає у зміні мікробіоти шлунково-кишкового тракту для запобігання розвитку захворювання у випадках підвищеного генетичного ризику або для поліпшення важких форм або навіть опору безглютенової дієті.
Харчова алергія - це постійно прогресуюче явище, яке як і раніше важко піддається лікуванню. Однак з відкриттям участі мікробіоти з'являються нові методи лікування.
Мікробіота кишківника
Харчова алергія - це порушення функції імунної системи, яка ненормально реагує відразу після вживання певної їжі. Їжа, зазвичай не шкідлива для організму, у подальшому називається "алергенною". На такі алергії страждає близько 3% населення в цілому та 5% дітей.
Продукти, які можуть викликати харчову алергію різноманітні і варіюються залежно від віку та харчових звичок людини. Урядові сайти регулярно оновлюють список виявлених алергенів. Діти більш чутливі до яєць, арахісу і коров'ячого молока, в той час як дорослі більш чутливі до ракоподібних і молюсків, деяких фруктів і сої.
На відміну від харчової непереносимості, симптоми харчової алергії проявляються бурхливо: вони можуть бути травними, респіраторними або нашкірними. Ангіоневротичний набряк, напади астми та анафілактичний шок визначаються як критичні ситуації, які небезпечні для життя.
До цих пір, не визначено, чому певні продукти викликають неадекватну імунну реакцію. Дослідження дуже швидко встановили зв'язок між цими алергічними явищами та змінами у мікробіоті, тобто у всіх пацієнтів з алергією мікробіота відрізняється від здорової. Спостереження за дисбактеріозом у пацієнтів показали, що певні бактерії відповідальні за появу гіперчутливості до харчових білків.
Хоча основним методом лікування харчової алергії є вилучення шкідливих продуктів із раціону, численні дослідження показали, що модулювання мікробіоти за допомогою пробіотиків і пребіотиків може запобігти розвитку алергії.
Функціональні шлунково-кишкові розлади (ФР) ШКТ, найбільш поширені кишкові захворювання, що являють собою сукупність хронічних травних симптомів, які не пояснюються будь-якої виявленої анатомічної аномалією.
Мікробіота кишківника
ФР ШКТ включають в себе набір симптомів, таких як СРК, закреп, діарея, функціональне здуття живота і неспецифічні функціональні розлади.
Тільки СРК вражає 10% населення і відрізняється від інших ФР ШКТ болями в животі, пов'язаними з запорами, діареєю або чергуванням їх. Це часто проявляється здуттям живота і більш високим рівнем стресу, ніж у населення в цілому.
Синдром роздратованого кишечника (СРК) - це функціональне шлунково-кишковий розлад, що характеризується періодичними болями в животі, які пов'язані зі зміною частоти стільця або форми стільця при відсутності яких-небудь органічних порушень. Використовуючи РИМСЬКІ критерії IV, СРК підрозділяється на чотири підтипи:
Супутні психіатричні захворювання, такі як тривога, депресія і соматизація, часто зустрічаються у пацієнтів з СРК.
У дуже маленьких дітей ФГДС являють собою найбільш поширену шлунково-кишкову причину звернення до лікаря. Це включає в себе дитячі кольки з проблемами зригування і запору, СРК та інші менш добре охарактеризовані функціональні проблеми. Біль у животі, здуття живота, діарея та запор зазвичай пов'язані з ФГДС і можуть мати серйозні наслідки для повсякденного життя дитини. Стрес і занепокоєння також можуть посилювати або продовжувати певні симптоми, особливо біль.
Причини СРК досі погано вивчені. Ризик розвитку СРК зростає в п'ять разів після бактеріальної інфекції, що викликає гостру діарею. Було висловлено припущення, що це може бути пов'язано з порушенням зв'язку між мозком і кишківником в поєднанні з дисбалансом кишкової флори. У більшості випадків спостерігається втрата різноманітності серед видів бактерій, складових мікробіоти, тобто знижується кількість позитивних бактерій і зростає чисельність патогенів. Ця дисфункція викликає проблеми з моторикою кишківника: транзит сповільнюється, змінюється кишковий бар'єр і розвивається незначне запалення. Це також викликає підвищену чутливість слизової оболонки, що робить нормальні явища, такі як рух кишкових газів, болючими.
Це відноситься до порушення хиткого балансу між мільярдами мікроорганізмів, що складають нашу мікробіоту, і їх взаємовідносинами з нашим організмом.
Для дорослих, в додаток до контрольованій дієті, варіанти лікування включають спазмолітики, проносні і протидіарейні засоби. У дітей перевага віддається методам релаксації і гіпнозу, які можуть полегшити біль. Іноді призначають спазмолітики. Для зміни мікробіоти в даний час є багатообіцяючі дані про пробіотиках, зокрема бифидобактериях і лактобацили і про фекальних трансплантатах. Однак для підтвердження кожного з цих варіантів ще належить провести масштабні клінічні випробування.
Колоректальний рак та рак шлунка - це два види раку шлунково-кишкового тракту, на походження яких, швидше за все, впливає кишкова мікробіота.
Мікробіота кишківника
З 694 000 смертей на рік по всьому світу колоректальний рак займає 2-е місце по смертності від раку. Генетичні фактори є суттєвою, але незначною причиною раку шлунково-кишкового тракту, який найбільшою мірою обумовлений факторами навколишнього середовища, такими як малорухливий спосіб життя, ожиріння і, зокрема, незбалансоване харчування, яке викликає дисбактеріоз кишківника. Крім того, гіпотеза про дисбаланс між шкідливими і корисними видами бактерій щодо цього раку більш ніж імовірна.
Колоректальний рак довгий час не проявляє ніяких симптомів, потім проявляється постійними або несподіваними проблемами з кишковим транзитом: закрепами, діареєю, гострою необхідністю у кишківнику і т.і.
Дослідження калу на наявність крові і колоноскопія є двома основними методами виявлення колоректального раку.
Хірургічне втручання є основою лікування шляхом видалення частини товстої кишки, що інокли комбінується з хіміо- або променевою терапією.
Хоча були виявлені різні фактори ризику (куріння, дієта, сімейний анамнез, генетична схильність), основною причиною раку шлунка є Helicobacter pylori - патогенна бактерія, що викликає хронічний гастрит.
Симптоми не дуже специфічні: біль у животі, що повторюються; нудота та блювання, які впливають на загальний стан. Тільки ендоскопія шлунку і стравоходу може підтвердити діагноз.
Хірургічне втручання є еталонним методом лікування локалізованих пухлин з частковим або повним видаленням шлунку. При локальних формах раку лікарі також додають хіміотерапію.
Оскільки існування зв'язку між бактеріями та раком шлунково-кишкового тракту видається більш ніж імовірним, маніпулювання мікробіотою з допомогою про- і пребіотиків вивчається в якості потенційного терапевтичного методу лікування.
"Плач моєї новонародженої дитини - самий несамовитий звук, який я коли-небудь чула".1 Отже, багато батьків, які виявляються безпорадними в кабінеті свого педіатра, не в силі заспокоїти незрозумілі крики своєї дитини. Симптоми часто важко виявити, і вони можуть стати важким випробуванням для батьків, тому важливо знати, як їх розпізнати і зрозуміти. Чи прихована відповідь на це питання у складі мікробіоти кишківника новонародженого?
Мікробіота кишківника
Дитяча колька характеризується надмірним плачем з невідомих причин у здорових немовлят. Причиною таких розладів є незрілість шлунково-кишкового тракту, алергія або непереносимість коров'ячого молока, шлунковий рефлюкс,2,3 але також вивчалися й інші причини, не пов'язані з шлунково-кишковою системою,2,3 такі як батьківський стрес,4 або куріння матері.2.
Кольки часто зустрічаються у немовлят, але їх симптоми, такі як постійний плач, можуть викликати занепокоєння у батьків.
Слово "колька" походить з грецької - "κoλικóς" (колікос), що відноситься до товстої кишки. Однак, незважаючи на роки досліджень, причина дитячих кольок залишається невідомою, тому немає достовірної інформації щодо участі в цьому кишківника (товстого кишківника)5.
Дитина багато плаче, капризує, лаштує гримаси, стискає кулаки - ймовірно, це кишкові гази.5 Педіатри вже давно використовують "правило трьох" для діагностики дитячих кольок.6 Саме ці критерії були введені у 1954 році та були адаптовані міжнародною організацією як: повторювані і тривалі періоди занепокоєння; плач або дратівливість без очевидної причини, такої як затримка росту, лихоманка або погане самопочуття, яка не може бути усунуте особами, які здійснюють догляд за малюком.7
Нещодавно було встановлено зв'язок між дитячими кольками і кишковою мікробіотою, також відомої як кишкова флора.8 Декілька досліджень показали, що мікробіота кишківника немовлят, які страждають на кольки, відрізняється від мікробіоти інших дітей:9
Цей дисбаланс кишкової мікробіоти, відомий як “
(sidenote:
Дисбіоз
Зазвичай визначається як зміна складу та функції мікробіоти, спричинена поєднанням факторів навколишнього середовища та індивідуальних особливостей людини.
Levy M, Kolodziejczyk AA, Thaiss CA, et al. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17(4):219-232.
)
”, тісно пов'язаний з кольками. Згідно з однією з гіпотез - змінений склад кишкової мікробіоти змінює перистальтику кишківника (спосіб, яким їжа проходить через травну систему), що призводить до надмірного виділення газів.5
Визначення рівня білку - кальпротектину може бути використане для виявлення запалення кишківника. Він міститься у великих кількостях у немовлят, які страждають коліками, і пов'язаний зі зниженням різноманітності кишкової мікробіоти.9
Сімейний лікар залишається першим пунктом призначення, який діагностує коліки у немовляти та може заспокоїти батьків.10 Ліків від кольок не існує, але кілька простих щоденних практик можуть допомогти полегшити симптоми. До них відносяться грудне вигодовування, виношування дитини і збалансування кишкової мікробіоти вашої дитини, особливо за допомогою пробіотиків.5 Пробіотики, мабуть, є перспективним напрямком, оскільки споживання "хороших" бактерій протягом декількох місяців може зменшити запалення кишківника,6 допомогти скоротити щоденну тривалість плачу.11 Оскільки вони допомагають підтримувати хороший кишковий баланс то пробіотики також можна використовувати в якості профілактичних засобів.5
Ця стаття заснована на науково підтверджених джерелах, але не є заміною медичної консультації. Якщо у вашої дитини проявляються симптоми, будь ласка, проконсультуйтеся з вашим сімейним лікарем чи педіатром.
1 Groopman J. The Colic Conundrum. The crying that doctors can’t stop. Annals of Medicine, Sept 17, 2007 Issue. https://www.newyorker.com/magazine/2007/09/17/the-colic-conundrum
3 Gupta SK. Is colic a gastrointestinal disorder? Curr Opin Pediatr. 2002 Oct;14(5):588-92.
8 Verduci E, Arrizza C, Riva E, et al. Microbiota and infantile colic: what’s new? Int J Probiotics Prebiotics. 2013; 8(1):25–28
15 Tannock GW. A special fondness for lactobacilli. Appl Environ Microbiol. 2004 Jun;70(6):3189-94.
Діти, підлітки, дорослі... майже кожна людина хоча б раз у житті хворіла гастроентеритом. Хоча це захворювання є другою за поширеністю причиною смерті в світі,1 причин для занепокоєння немає, оскільки інфекційного гастроентериту можна уникнути за допомогою гігієнічних заходів, а схеми лікування нестримно покращуються.2 Крім того, відновлення кишкової мікробіоти може обмежити тяжкість і тривалість симптомів.3
Мікробіота кишківника Діарея мандрівників
Гастроентерит - симптомом якого є діарея часто супроводжується тяжкими симптомами, які в більшості випадків швидко зникають.4 У пацієнтів спостерігається дисбаланс кишкової мікробіоти,5 який може зберігатися після усунення інфекції та пов'язаний з підвищеним ризиком розвитку хронічних розладів.6
Слово "гастроентерит" походить від грецьких слів - gastron, що означає "шлунок" та - enteron, що означає "тонка кишка", іншими словами, запалення шлунка і тонкої кишки.7
У країнах заходу інфекційний гастроентерит, як правило, доброякісний, є основною причиною смерті в розвинених країнах, особливо серед дітей у віці до 5 років.4 На його частку доводиться 10% всіх дитячих смертей у країнах, де він представляє серйозну проблему для охорони громадського здоров'я.1 Високі показники смертності у цих країнах8 часто пов'язані з тяжким зневодненням, яке воно викликає. Основним збудником захворювання - патогенні мікроорганізми, найчастіше віруси, а в цьому випадку це відомо як вірусний гастроентерит.
Ротавірус є однією з основних причин вірусного гастроентериту у всьому світі та смертельної діареї у дітей навіть у країнах де проводиться вакцинація.10 Інші віруси, такі як норовірус або аденовірус, також можуть бути причетні до цього.4 Крім того, гастроентерит також може бути викликаний бактеріями (бактеріальний гастроентерит) або паразитами, особливо під час подорожей.7 Наразі, попри всі наявність оснащення досить важко діагностувати їх збудника.11
Зараження відбувається через забруднену їжу або воду, або безпосередньо при фізичному контакті, посиленому поганою гігієною.6 Хоча дані про зв'язок між кишковою мікробіотою і гастроентеритом все ще дуже обмежені, у пацієнтів спостерігається дисбаланс мікробіоти кишківника (дисбіоз) під час інфекції, незалежно від причини.5,12,13 Дослідження показують, що у дітей з важким або ускладненим вірусним гастроентеритом, і особливо у дітей, інфікованих ротавірусом, спостерігається менша різноманітність кишкової мікробіоти, ніж у здорових дітей.14 Нарешті, інші дослідження показують, що зміни в микробіоті кишківника можуть зберігатися протягом тривалого часу і можуть чинити несприятливий вплив на здоров'я, наприклад, сприяти розвитку синдрому роздратованого кишківника.15 Проте сучасні дані про внесок кишкової мікробіоти у розвиток, ускладнення та результат захворювання вимагають подальшого вивчення.
На додаток до діареї (визначається як три або більше рідких або водянистих випорожнень протягом однієї доби)6 симптоми можуть включати нудоту, блювання, спазми в животі, лихоманку або анорексію.16 Симптоми вірусного гастроентериту зазвичай тривають менше тижня і зазвичай зменшуються протягом 1-3 діб.4 Особливу увагу слід приділяти дітям, літнім людям, особам з послабленим імунітетом, які піддаються більшому ризику зневоднення.4 Хоча, у деяких випадках лікар може призначити додаткові аналізи (аналіз калу, аналіз крові, і т.д.)4
Незалежно від причини інфекційного гастроентериту, лікування є симптоматичним.4 При діареї основним методом лікування є регідратація (відновлення водно-електролітного балансу)6 Лікування антибіотиками не є обов'язковим і виправдано тільки в тому випадку, якщо встановлена бактеріальна причина діареї.11 При вірусному гастроентериті антибіотики можуть бути навіть контрпродуктивними.11 З іншого боку, пробіотики, спрямовані на відновлення кишкової мікробіоти, можуть обмежити тяжкість і тривалість симптомів.7,17
Ця стаття заснована на науково підтверджених джерелах, але не є заміною медичної консультації. Якщо у вас або вашої дитини проявляються симптоми, будь ласка, проконсультуйтеся з вашим сімейним лікарем чи педіатром.
Запальні захворювання кишківника (ЗЗК) включають хворобу Крона та виразковий коліт. Ці захворювання не впливають на очікувану тривалість життя, але вони значно змінюють якість життя. Плани лікування починають орієнтуватися на склад мікробіоти у кишківнику…
Мікробіота кишківника
ЗЗК, хвороба Крона та виразковий коліт (ВК) характеризуються запаленням в стінці частини травного тракту, що пов'язано з гіперактивністю травної імунної системи. Під час спалахів ЗЗК найбільш поширеними симптомами є болі в животі і діарея, яка іноді може містити елементи крові. Ці захворювання можуть також проявлятися в системах за межами травного тракту, включаючи суглоби, зорову, шкірну і печінкову системи.
ЗЗК вражає 1 людину з кожних 1000 в Західній Європі і найчастіше проявляється у віці від 20 до 40 років. Ці захворювання протікають переривчасто, чергуються з періодами загострень і ремісій. При хворобі Крона це запалення може локалізуватися на всіх стадіях травної системи, від ротоглотки до заднього проходу, хоча найчастіше воно зустрічається у кишківнику. Виразковий коліт локалізується в прямій і товстій кишці.
Причини ЗЗК включають генетичну схильність, фактори навколишнього середовища, такі як забруднення навколишнього середовища і дієта, імунна система і кишкова мікробіота. ЗЗК також може бути викликано недостатнім впливом мікроорганізмів в дитинстві, наприклад, із-за надмірної гігієни.
Кишкова мікробіота, мабуть, відіграє важливу, але все ще погано вивчену роль в характерному запаленні слизової при ЗЗК. У численних дослідженнях був виявлений дисбіоз саме у таких пацієнтів. Тобто зміна рівноваги мікробіоти тісно пов'язана з генетичними чинниками і факторами навколишнього середовища. Зокрема, знижується чисельність протизапальних бактерій, тому при дисбалансі змінюється бактеріальний вміст кишківника, що може призвести до хронічного запалення.
Лікувальної терапії не існує, але протизапальні засоби можуть обмежити спалахи захворювання. Лікування в даний час включає терапію кортикостероїдами, імуномодулючими засобами, тобто такими методами, які можуть знизити реакції імунної системи (анти-TNFα терапія та хірургічне втручання у 80% випадків хвороби Крона та у 20% випадків при ВК). Це рідко призводить до кінцевого результату лікування, але в даний час дослідники намагаються визначити роль мікробіоти при ЗЗК, намагаючись при цьому зменшити присутність патогенів і стимулювати зростання корисних мікроорганізмів.
Це не те, що ви думаєте...
До уваги мандрівників, які стали жертвами страшного "туриста": ця в основному доброякісна інфекція, яка порушує мікрофлору кишківника1, насправді називається діарею мандрівників. Дуже поширене захворювання, воно зустрічається у 10-40% туристів2 протягом двотижневої мандрівки, в залежності від країни, яку візитують та схильностей мандрівника до інфекцій. Зазвичай вона вражає до 60% мандрівників в тропічних або субтропічних регіонах.3 Хоча захворювання багато в чому відрізняється від гастроентериту, але перш за все інфекція сприяє діареї.2
Мікробіота кишківника Діарея, пов'язана з прийомом антибіотиків
Всупереч поширеній думці, діарея мандрівників викликана не екзотичними продуктами, які погано перетравлюються “непідготовленими” шлунками. Це справжня інфекція, найчастіше викликається бактеріями (кишкова паличка, сальмонела, шигелла, кампілобактер).2 Це також може бути викликано паразитом (Giardia, Cryptosporidium і т. д.),2 або вірусом(норовірус, ротавірус).2 Патоген, що викликає діарею, виявляється лише у 40-60% мандрівників з симптомами.4 Основним джерелом мікроорганізмів є забруднені продукти харчування (особливо сирі овочі, недоварене м'ясо або риба, неочищені фрукти і т. д.) та забруднена вода.5 Інфекція також може передаватися при контакті з іншими людьми при недотриманні правил гігієни.5
40%-60% Збудник, викликає діарею та виявляється лише у 40%-60% випадків у мандрівників із симптомами
Однією з функцій кишкової мікробіоти є запобігання або обмеження проникнення в кишківник патогенів.6 Незважаючи на поширеність "туриста", незалежно від збудника, діарея порушує баланс кишкової мікробіоти, принаймні тимчасово, що призводить до дисбактеріозу.1 Цей дисбаланс може мати довгострокові наслідки, включаючи підвищений ризик розвитку постінфекційного7 синдрому роздратованого кишківника, який зустрічається у 3-17% пацієнтів.2 Нещодавно дослідницька група показала, що різноманітність кишкової мікробіоти була значно нижчою у шведських мандрівників, що заразилися кампілобактерною інфекцією, ніж у мандрівників, які залишилися незараженими.8 Інша дослідницька група виявила, що діарея під час подорожі була пов'язана з більш високим відносним вмістом в кишківнику певної бактерії (Prevotella copri) до від'їзду та після повернення.9 Чи можливо використовувати склад кишкової мікробіоти мандрівників для прогнозування ризику розвитку діареї під час поїздки? Оскільки досліджень у цій області все ще дуже мало, це ще належить підтвердити.
Симптоми і тривалість варіюються в залежності від причини4 (бактеріальної, паразитарної або вірусної), але в середньому симптоми тривають 4-5 діб без лікування.2 На додаток до частого рідкого або водянистому стільця (не менше 3-х випорожнень протягом доби)5 повинен бути присутнім принаймні один з наступних симптомів: лихоманка, нудота, блювання, спазми в животі або нагальна потреба сходити в туалет.2 Основним ризиком є зневоднення, що виникає в результаті втрати рідини в результаті водянистої діареї. Особи з групи ризику (діти, літні люди або люди з хронічними захворюваннями, або з ослабленим імунітетом2) з більшою ймовірністю будуть госпіталізовані.
Толерантна діарея, яка не заважає запланованій активності.
Діарея, яка обмежує або заважає запланованій діяльності.
Інвалідизуюча діарея, що призводить до повної неможливості виконувати заплановані дії. Дизентерія, тобто діарея, яка супроводжується кров’ю та/або слизом, вважається різновидом тяжкої діареї.
Тривалість діареї протягом двох тижнів.
Профілактика діареї мандрівників в основному включає в себе гігієнічні заходи, такі як часте миття рук і запобіжні заходи стосовно харчових продуктів.5 Перед поїздкою проконсультуйтеся зі своїм лікарем або фармацевтом. Регідратація є ключем до лікування діареї мандрівників:5 пиття чистої води (наприклад бутильована вода і т.і.) або трав'яного чаю у невеликих кількостях. Рекомендується будь-яка злегка солодка і / або солона їжа (тверда їжа не протипоказана).4 Протидіарейні препарати допомагають знизити ризик зневоднення і можуть бути рекомендовані в деяких випадках.10 Також можуть знадобитися антибіотики. Однак антибіотики можуть призвести до зменшення різноманітності кишкової мікробіоти, яка, таким чином, втрачає свою здатність діяти в якості бар'єру проти патогенів. Більше того, застосування антибіотиків може призвести до селекції стійких до антибіотиків бактерій.11 З цієї причини вони рекомендуються тільки при тяжкій бактеріальній діареї, а в деяких випадках і при помірній діареї10 під наглядом лікаря. Пробіотики можуть бути корисними у якості профілактичного заходу,12 а також для обмеження інтенсивності та тривалості симптомів.13,14
Ця стаття заснована на науково підтверджених джерелах, але не є заміною медичної консультації. Якщо ви відчуваєте симптоми, будь ласка, зверніться до свого сімейного лікаря.
5 World Health Organization. 2017. Diarrhoeal disease. World Health Organization, Geneva, Switzerland. http://www.who.int/mediacentre/factsheets/fs330/en/. Accessed 28 October 2017.
6 Riddle MS, Connor BA. The Traveling Microbiome. Curr Infect Dis Rep. 2016 Sep;18(9):29.
Антибіотики є потужним інструментом у боротьбі з бактеріальними інфекціями. У той час як лікування іноді здається без очевидних короткострокових побічних ефектів, дисбаланс кишкової мікробіоти, який вони провокують, може викликати діарею у 35% пацієнтів.1-3 Ця діарея, пов'язана з прийомом антибіотиків (AAД), іноді може приховувати серйозні кишкові інфекції.3
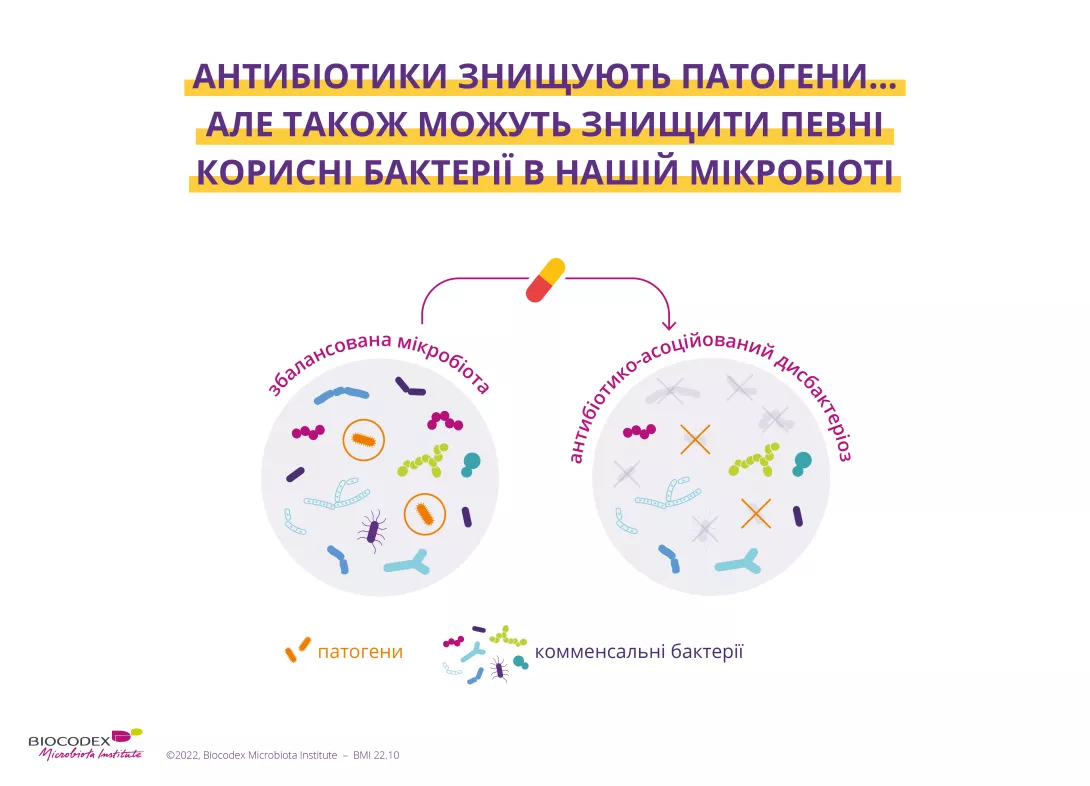
У той час як антибіотики знищують патогенни, які причетні до розвитку інфекції, вони також можуть знищувати деякі корисні бактерії у вашій мікробіотi, систематично викликаючи дисбаланс різного ступеня в цій екосистемі. Цей дисбаланс (відомий як дисбіоз) проходить у вигляді антибіотико-асоційованої діареї (AAД), оскільки кишкова мікробіота менш здатна виконувати свої захисні функції. ААД може вражати до 35% пацієнтів1-3 та до 80% дітей, які отримують лікування антибіотиками.1

Кишкова мікробіота демонструє певну ступінь стійкості до антибіотиків (тобто відновлюється до початкового складу, аналогічного тому, який існував до дисбалансу викликаного антибіотиками), але вона не завжди повністю відновлюється.4,5 Недавні дослідження показали, що антибіотики можуть змінювати різноманітність і чисельність бактерій, тому цей дисбаланс може бути тривалий (зазвичай розвивається протягом 8-12 тижнів після закінчення лікування).1,6
Основним короткостроковим наслідком лікування антибіотиками є зміна спорожнення кишечника, який відчувають деякі пацієнти,що найчастіше призводить до діареї. AAД визначається як три або більше дуже рідких або рідких випорожнень протягом 24 годин після початку лікування антибіотиками або до 2 місяців після застосування.7-9 Його частота залежить від декількох факторів, включаючи вік, контекст і тип антибіотика. Діарея зазвичай буває легкої або помірної інтенсивності і в переважній більшості випадків носить функціональний характер, тобто пов'язана з дисбалансом кишкової мікробіоти.1 Антибіотики з дуже широким спектром протимікробної активності (тобто ті, які впливають на дуже широкий спектр бактерій) пов'язані з більш частими випадками виникнення діареї.3
Антибіотики рятують життя! Чи знаєте ви, що вони також впливають на вашу мікробіоту? Чи знаєте ви, що неправильне та надмірне використання антибіотиків може призвести до резистентності до антибіотиків? Що ви чули про Всесвітній тиждень обізнаності про протимікробні препарати (WAAW)? Всі відповіді на цій спеціальній сторінці:
Зазвичай у 10-20% випадків діарея виникає в результаті інфекції, викликаної Clostridioides difficile (C. difficile), бактерією, яка може стати патогенною з-за певних факторів, таких як використання антибіотиків, вік старше 65 років або наявність певних супутніх захворювань.3 Колонізація кишкової мікробіоти цією бактерією викликає запальну реакцію з клінічними наслідками, що варіюються від помірної діареї до більш серйозних симптомів, включаючи смерть.3
Лікування ААД залежить від симптомів і збудника (наприклад - інфекція C. difficile).10 При легкій чи помірній діареї лікування включає припинення прийому антибіотиків (або заміну антибіотика на той, який з меншою ймовірністю викликає діарею), щоб дати можливість микробіоті відновитися, а пацієнту відновити водно-сольовий баланс.10
Численні дослідження показали, що пробіотики можуть допомогти відновити мікробіоту кишківника, а деякі пробіотики навіть довели свою ефективність в профілактиці та лікуванні ААД.6,11,12 Було показано, що при прийомі пробіотиків під час лікування антибіотиками сприяє зниженню ризику первинної та вторинної інфекції C. difficile.13-15 Трансплантація фекальної мікробіоти (природна передача здорової мікробіоти хворій людині з метою відновлення мікробної екосистеми) в даний час використовується тільки при найбільш серйозних інфекціях, тобто при рецидивах інфекцій, викликаних C. difficile.16,17
Ця стаття заснована на науково підтверджених джерелах, але не є заміною медичної консультації. Якщо у вас або вашої дитини проявляються симптоми, будь ласка, проконсультуйтеся з вашим сімейним лікарем чи педіатром.
Кожен рік, починаючи з 2015 року, ВООЗ організовує Всесвітній тиждень обізнаності про протимікробні препарати (WAAW), метою якого є підвищення обізнаності про глобальну стійкость до протимікробних препаратів.
Стійкість до протимікробних препаратів виникає, коли бактерії, віруси, паразити та грибки з часом змінюються і більше не реагують на ліки. В результаті медикаментозної стійкості антибіотики та інші протимікробні препарати стають неефективними, а інфекції стають все більш важкими або неможливими для лікування, збільшуючи ризик поширення захворювання, важких захворювань і смерті.
Ця кампанія, яка щорічно проводиться 18-24 листопада, заохочує широку громадськість, медичних працівників і осіб, які приймають рішення, обережно використовувати антибіотики, противірусні, протигрибкові та протипаразитарні препарати, щоб запобігти подальшій появі антимікробної резистентності.
1 McFarland LV, Ozen M, Dinleyici EC et al. Comparison of pediatric and adult antibiotic-associated diarrhea and Clostridium difficile infections. World J Gastroenterol. 2016;22(11):3078-3104.
2 Bartlett JG. Clinical practice. Antibiotic-associated diarrhea. N Engl J Med 2002;346:334-9.
3 Theriot CM, Young VB. Interactions Between the Gastrointestinal Microbiome and Clostridium difficile. Annu Rev Microbiol. 2015;69:445-461.
4 Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci U S A. 2011;108 Suppl 1(Suppl 1):4554-4561.
5 Francino MP. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol. 2016;6:1543.
6 Kabbani TA, Pallav K, Dowd SE et al. Prospective randomized controlled study on the effects of Saccharomyces boulardii CNCM I-745 and amoxicillin-clavulanate or the combination on the gut microbiota of healthy volunteers. Gut Microbes. 2017;8(1):17-32.
7 Wiström J, Norrby SR, Myhre EB, et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J Antimicrob Chemother. 2001 Jan;47(1):43-50.
8 McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea. Dig Dis. 1998 Sep-Oct;16(5):292-307.
9 Bartlett JG, Chang TW, Gurwith M, et al. Antibiotic-associated pseudomembranous colitis due to toxin-producing clostridia. N Engl J Med. 1978 Mar 9;298(10):531-4.
10 Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ. 2002 Jun 8;324(7350):1345-6.
11 Szajewska H, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther. 2015 Oct;42(7):793-801.
12 Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012 May 9;307(18):1959-69.
13 McFarland LV, Surawicz CM, Greenberg RN, et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease. JAMA. 1994 Jun 22-29;271(24):1913-8.
14 Kotowska M, Albrecht P, Szajewska H. Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea in children: a randomized double-blind placebo-controlled trial. Aliment Pharmacol Ther. 2005 Mar 1;21(5):583-90.
15 McFarland LV. Probiotics for the Primary and Secondary Prevention of C. difficile Infections: A Meta-analysis and Systematic Review. Antibiotics (Basel). 2015 Apr 13;4(2):160-78.
16 Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013 Apr;108(4):478-98; quiz 499.
17 Li YT, Cai HF, Wang ZH, et al. Systematic review with meta-analysis: long-term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther. 2016 Feb;43(4):445-57.
Астма – поширене хронічне респіраторне захворювання, яке вражає як дорослих, так і дітей. Понад 260 мільйонів людей у всьому світі страждають на це захворювання1, і це найпоширеніше хронічне захворювання у дітей.1 Неконтрольована астма, найбільш виснажлива форма захворювання, має серйозні наслідки для повсякденного життя пацієнтів. Відкриття того, що мікробіота кишечника, легень і носа бере участь у розвитку астми, відкриває нові терапевтичні шляхи. Пояснення нижче.
Мікробіота легень
Астма — це хронічне захворювання дихальної системи, яке проявляється кашлем, хрипами, задишкою, стисненням у грудях або комбінацією цих симптомів.1 Симптоми спричинені звуженням дихальних шляхів у легенях через запалення бронхи.1 Напади астми частіше трапляються вночі або під час фізичної активності, і тяжкість і частота нападів варіюються від пацієнта до пацієнта.1
Астма є складним багатофакторним захворюванням. Вона може розвинутися через генетичну схильність (алергічне походження) та/або вплив факторів навколишнього середовища, таких як алергени (пилок, кліщі), тютюновий дим або забруднене повітря. Сильні емоції, холодне повітря або фізичні вправи також можуть викликати напади. Нарешті, також можуть мати місце індивідуальні фактори, такі як інфекція або навіть ожиріння.2
Численні дослідження відзначають роль різноманітної мікробіоти в захворюванні:
Зменшення різноманітності кишкової мікробіоти, тобто дисбаланс у складі кишкової мікробіоти (відомий як дисбактеріоз), у перші роки життя пов’язаний із підвищеним ризиком розвитку астми пізніше в дитинстві.3 Деякі дослідники вважають, що аналіз мікробіоти кишечника немовляти може передбачити, що ризик розвитку захворювання.4 Одним із факторів такого дисбалансу, якому приділено багато уваги, є вплив антибіотиків, які приймаються в перші тижні чи місяці життя, тобто коли розвивається мікробіота кишечника та імунітет.5 Деякі дослідження показали зв’язок між використання антибіотиків і підвищений ризик астми в дитинстві.6 Крім того, одна дослідницька група нещодавно припустила, що кишковий дисбактеріоз у немовлят, які піддавалися антибіотикам, може бути відповідальним за дитячу астму.7 Однак цей механізм ще не підтверджено.
Вважається, що легенева мікробіота також відіграє певну роль, і хоча наше розуміння в цій галузі все ще дуже обмежене, це сфера досліджень, яка швидко розширюється.8 Відкриття унікальної легеневої флори зі специфічними ознаками пацієнтів свідчить про її роль у розвитку астми. .9,10 Крім того, здається, що респіраторна функція при помірній та тяжкій астмі пов’язана зі ступенем запалення легенів і складом мікробіоти.11,12 Хоча дослідження для підтвердження цих результатів тривають, характеризуючи популяції бактерій, що живуть у нижніх дихальних шляхах можуть допомогти покращити лікування пацієнтів або навіть краще передбачити напади.10
Дані, що стосуються назальної мікробіоти, також дуже обмежені. Однак дисбаланс у складі назальної мікробіоти також був пов’язаний із захворюванням [13] і навіть із тяжкістю нападів [14], хоча причинно-наслідковий зв’язок не встановлено. Нарешті, як і у випадку з кишковою мікробіотою, нещодавнє дослідження за участю 700 дітей свідчить про те, що зміна назальної мікробіоти внаслідок лікування антибіотиками до 1 року може пояснити виникнення дитячої астми у віці 7 років.15 Однак це має бути доведеним клінічно.
Хоча астму неможливо вилікувати, існують методи лікування, які дозволяють хворим на астму вести нормальний і активний спосіб життя. Симптоматичне лікування в основному обмежує інтенсивність гострих нападів шляхом відкриття бронхів, тоді як лікування, що модифікує захворювання, зменшує запалення дихальних шляхів, таким чином покращуючи дихальну функцію та зменшуючи тяжкість нападу.1
Дослідження взаємозв’язку між мікробіотою та астмою свідчать про те, що модифікація мікробіоти може допомогти запобігти захворюванню, що спонукає дослідників зосередити свої зусилля на використанні пробіотиків і пребіотиків.16,17 Їх використання для лікування захворювання також вивчається. 18
Вплив (sidenote: мікроорганізми Живі організми занадто малі, щоб їх можна було побачити неозброєним оком. До них відносяться бактерії, віруси, гриби, археї, найпростіші і т.д., відомі під загальною назвою "мікроби". Джерело: What is microbiology? Microbiology Society. ) у ранньому дитинстві, здається, допомагає запобігти астмі. Всупереч поширеній думці, життя в дезінфікованому середовищі не обов’язково захищає від респіраторних захворювань. Деякі дослідження показують, що домашній пил не обов’язково є фактором ризику розвитку захворювання,19 тоді як інші показали зниження ризику астми у дітей, які народилися та виросли в сільській місцевості20 або з домашніми тваринами.21
Ця стаття заснована на науково перевірених джерелах. Однак, якщо у вас або вашої дитини з’являються симптоми, зверніться до свого сімейного лікаря або педіатра.
1 World Health Organization. 2021. Asthma. World Health Organization, Geneva, Switzerland. https://www.who.int/news-room/fact-sheets/detail/asthma
2 Dharmage SC, Perret JL, Custovic A. Epidemiology of Asthma in Children and Adults. Front Pediatr. 2019 Jun 18;7:246.
3 Abrahamsson TR, Jakobsson HE, Andersson AF, et al. Low gut microbiota diversity in early infancy precedes asthma at school age. Clin Exp Allergy. 2014 Jun;44(6):842-50.
4 Stokholm J, Blaser MJ, Thorsen J, et al. Maturation of the gut microbiome and risk of asthma in childhood. Nat Commun. 2018 Jan 10;9(1):141.
5 Coker MO, Juliette C. Madan JC. Chapter 3 - The microbiome and immune system development, The Developing Microbiome. Academic Press. 2020. p 43-66.
6 Murk W, Risnes KR, Bracken MB. Prenatal or early-life exposure to antibiotics and risk of childhood asthma: a systematic review. Pediatrics. 2011 Jun;127(6):1125-38.
7 Patrick DM, Sbihi H, Dai DLY, et al. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children: evidence from population-based and prospective cohort studies. Lancet Respir Med. 2020 Nov;8(11):1094-1105.
9 Millares L, Bermudo G, Pérez-Brocal V, et al. The respiratory microbiome in bronchial mucosa and secretions from severe IgE-mediated asthma patients. BMC Microbiol. 2017 Jan 19;17(1):20.
10 Sullivan A, Hunt E, MacSharry J, et al. 'The Microbiome and the Pathophysiology of Asthma'. Respir Res. 2016 Dec 5;17(1):163.
11 Turturice BA, McGee HS, Oliver B, et al. Atopic asthmatic immune phenotypes associated with airway microbiota and airway obstruction. PLoS One. 2017 Oct 20;12(10):e0184566.
12 Taylor SL, Leong LEX, Choo JM, et al. Inflammatory phenotypes in patients with severe asthma are associated with distinct airway microbiology. J Allergy Clin Immunol. 2018 Jan;141(1):94-103.e15.
13 Kang HM, Kang JH. Effects of nasopharyngeal microbiota in respiratory infections and allergies. Clin Exp Pediatr. 2021 Apr 15.
14 Zhou Y, Jackson D, Bacharier LB, et al. The upper-airway microbiota and loss of asthma control among asthmatic children. Nat Commun. 2019 Dec 16;10(1):5714.
15 Toivonen L, Schuez-Havupalo L, Karppinen S, et al. Antibiotic Treatments During Infancy, Changes in Nasal Microbiota, and Asthma Development: Population-based Cohort Study. Clin Infect Dis. 2021 May 4;72(9):1546-1554.
16 Meirlaen L, Levy EI, Vandenplas Y. Prevention and Management with Pro-, Pre and Synbiotics in Children with Asthma and Allergic Rhinitis: A Narrative Review. Nutrients. 2021 Mar 14;13(3):934.
17 Fonseca VMB, Milani TMS, Prado R, et al. Oral administration of Saccharomyces cerevisiae UFMG A-905 prevents allergic asthma in mice. Respirology. 2017 Jul;22(5):905-912.
18 Chiu CJ, Huang MT. Asthma in the Precision Medicine Era: Biologics and Probiotics. Int J Mol Sci. 2021 Apr 26;22(9):4528. doi: 10.3390/ijms22094528.
19 O'Connor GT, Lynch SV, Bloomberg GR, et al. Early-life home environment and risk of asthma among inner-city children. J Allergy Clin Immunol. 2018 Apr;141(4):1468-1475.
20 Depner M, Taft DH, Kirjavainen PV, et al. Maturation of the gut microbiome during the first year of life contributes to the protective farm effect on childhood asthma. Nat Med. 26(11):1766-1775. 2020 ;
21 Mäki, J.M., Kirjavainen, P.V., Täubel, M. et al. Associations between dog keeping and indoor dust microbiota. Sci Rep. 2021 Mar 5;11(1):5341.

