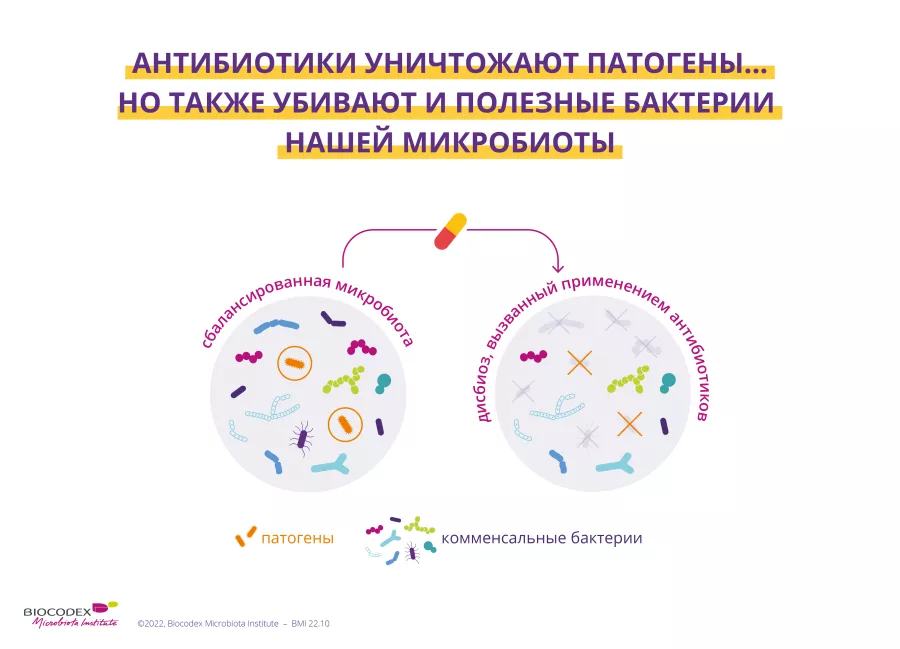
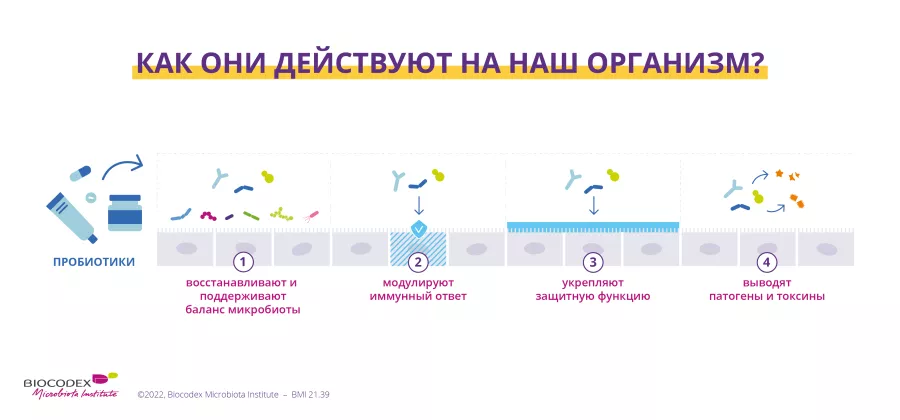
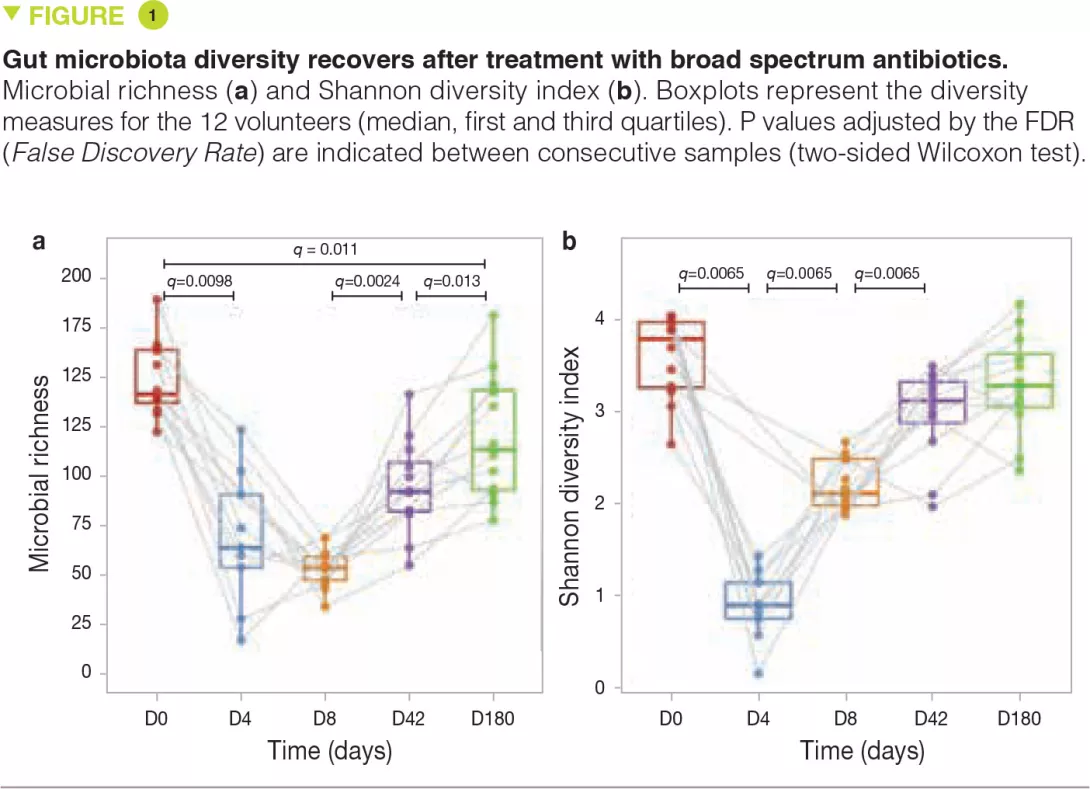
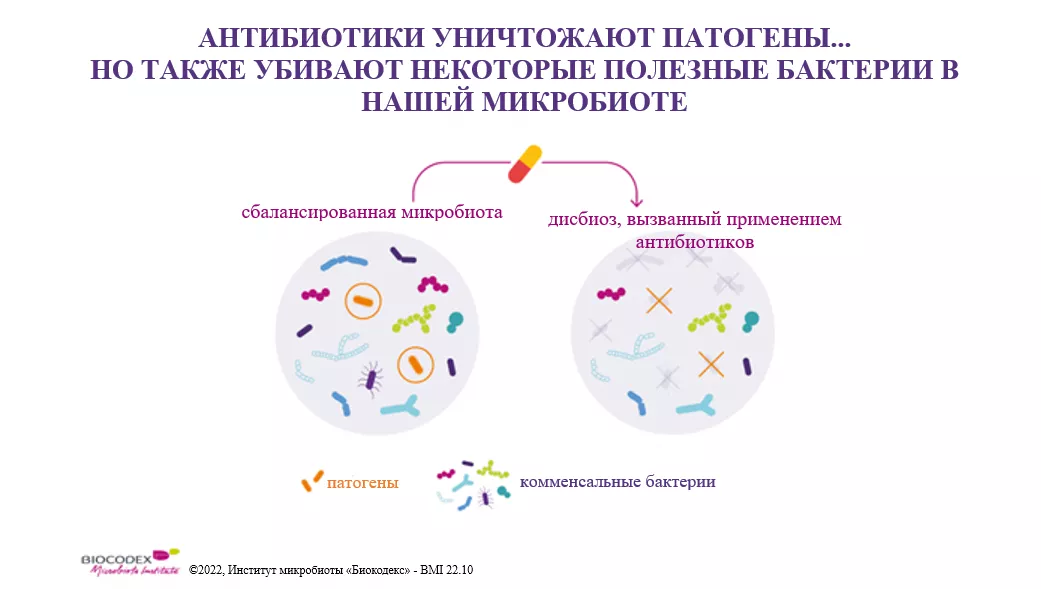
Дополнительные настройки пользовательского интерфейса, дизайна и читаемости:
Настройка шрифта: пользователи могут увеличивать и уменьшать его размер, изменять семейство (тип), регулировать интервалы, выравнивание,
высоту строки и т.д.
Настройка цветов: пользователи могут выбирать различные профили контраста цветов, такие как светлый, темный, инвертированный и монохромный. Кроме того, пользователи могут переключать цветовые схемы заголовков, текстов и фонов, с более чем 7 различными вариантами окраски.
Анимации: эпилептики могут остановить все текущие анимации, нажав на кнопку. Анимации, управляемые интерфейсом, включают видео, GIF и мигающие CSS-переходы.
Выделение содержания: пользователи могут выбирать, какие важные элементы, такие как ссылки и заголовки, выделить. Они также могут выбрать выделение только целевых или наведенных элементов.
Отключение звука: для пользователей слуховых аппаратов, страдающих от головной боли или других проблем из-за автоматического воспроизведения аудио, эта опция позволяет мгновенно отключить звук на всем веб-сайте.
Когнитивные нарушения: AccessiWay использует поисковый движок, связанный с Википедией и Викисловарем, что позволяет людям с когнитивными нарушениями расшифровывать смысл фраз, аббревиатур, жаргона и т.д.
Дополнительные функции: AccessiWay предлагает пользователям возможность изменять цвет и размер курсора, использовать режим печати, активировать виртуальную клавиатуру и множество других функций.