Ротавирусы, норовирусы, саповирусы, астровирусы и аденовирусы: в настоящее время эти пять типов вирусов признаны основными возбудителями вирусной диареи.21
Из более чем 2 миллиардов случаев диарейных заболеваний, регистрируемых ежегодно во всем мире, согласно Глобальному исследованию бремени болезней (GBD) 2016 года, почти 900 миллионов случаев диареи средней и тяжелой степени были вызваны только тремя из этих вирусов: ротавирусом, норовирусом и аденовирусом.22
РОТАВИРУСНАЯ ДИАРЕЯ — УБИЙЦА ДЕТЕЙ НОМЕР ОДИН
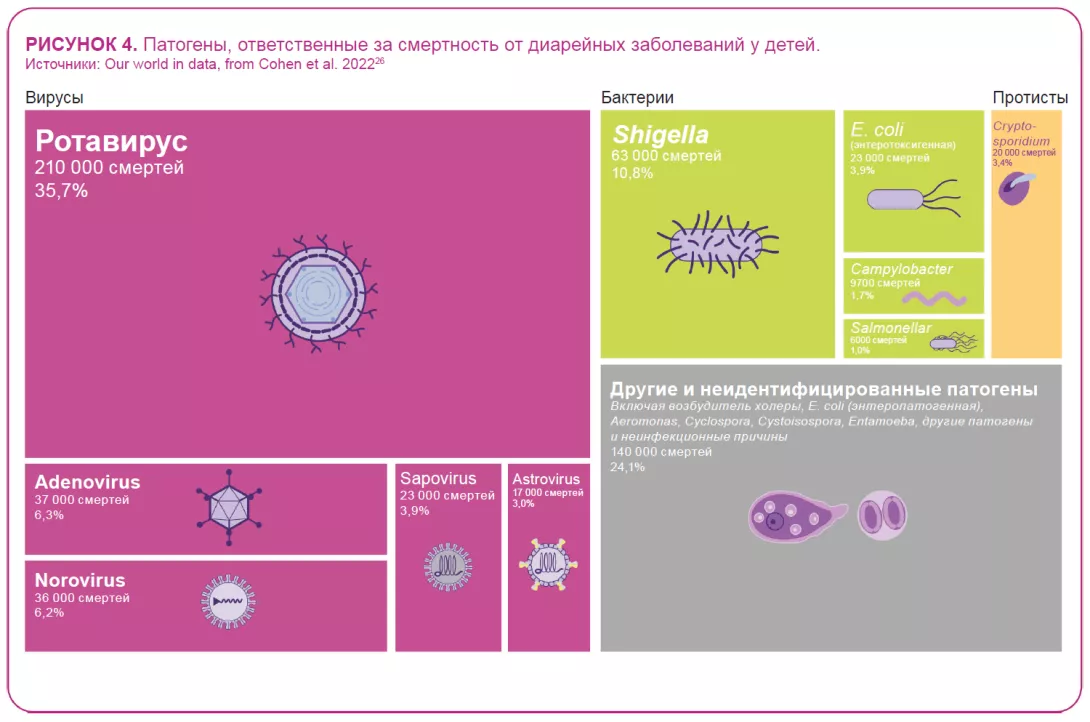
Несмотря на разработку и доступность вакцин против ротавируса с 2006 года 22, этот вирус, вызывающий более тяжелые симптомы, чем большинство других кишечных патогенов 22, по-прежнему был причиной более 228 000 смертей в 2016 году, из которых более 128 000 пришлись на детей в возрасте до 5 лет, что делает ротавирус ведущей причиной смертности от диареи среди этой группы населения (рисунок 4).
ВОДЯНИСТАЯ ДИАРЕЯ
Независимо от того, какой вирус вызывает диарею, процесс заражения в целом одинаков: вирус поражает эпителиальные клетки тонкой кишки и вызывает повреждения, препятствующие всасыванию жидкости.21 Вирусная диарея обычно проявляется в виде водянистой (не кровянистой) диареи. Она может сопровождаться другими симптомами, такими как тошнота, спазмы в животе, рвота и лихорадка,22 что приводит к состоянию, известному как вирусный гастроэнтерит.
РЕГИДРАТАЦИЯ… И ПРОБИОТИКИ
Как и в случаях с другими причинами (бактерии или паразиты) инфекционной диареи, лечение вирусной диареи основано на пероральной или внутривенной регидратационной терапии в зависимости от степени обезвоживания.21 Кроме того, согласно последним рекомендациям комитета ESPGHAN (2023 год),20 медицинские работники могут рекомендовать некоторые пробиотические штаммы (L. rhamnosus, S. boulardii и L. reuteri) для лечения острого гастроэнтерита у детей, ввиду наличия доказательств (достоверность доказательств: низкая; степень рекомендации: слабая) сокращения продолжительности диареи и/или продолжительности госпитализации, и/или частоты стула.
ПОВЫШЕНИЕ ЭФФЕКТИВНОСТИ ВАКЦИНЫ ПРОТИВ РОТАВИРУСА — ЕЩЕ НЕ РЕШЕННАЯ ПРОБЛЕМА
В качестве профилактики применяются обычные профилактические меры (обеспечение безопасной питьевой воды, надлежащая санитария и частое мытье рук, ограничение контактов с инфицированными людьми и т. д.).
Учитывая значительное бремя ротавирусной диареи, вакцины против ротавируса являются еще одной важной профилактической мерой. 22,23
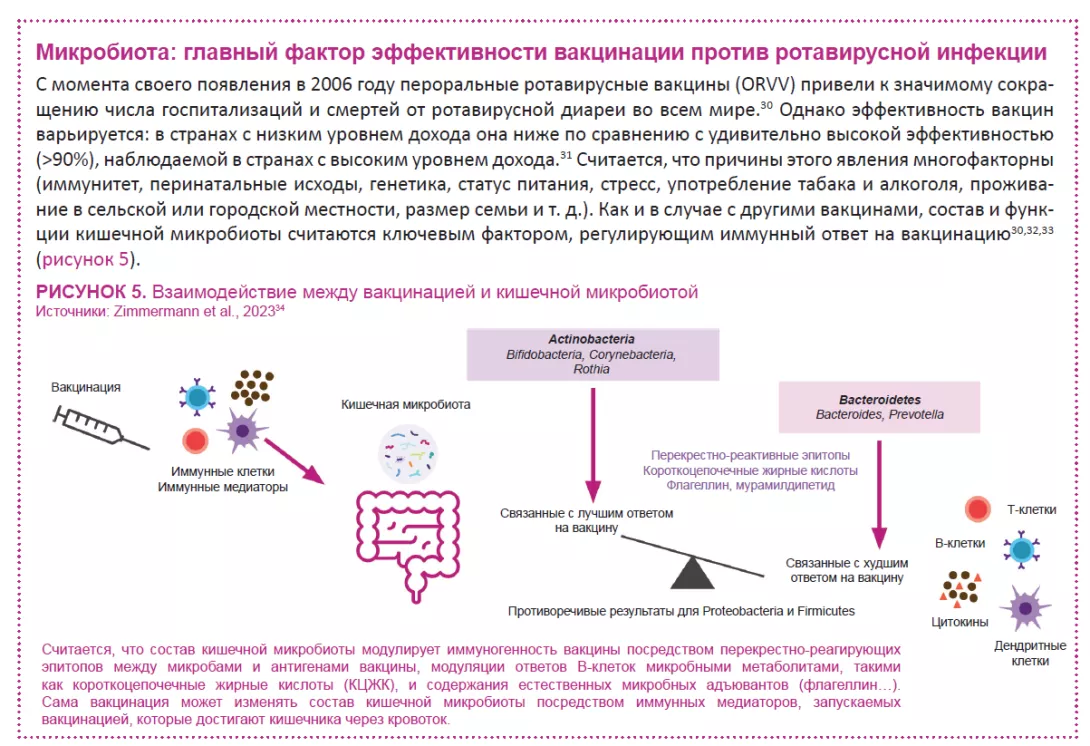
По оценкам, в период с 2006 по 2019 годы вакцинация позволила предотвратить 139 000 случаев смерти от ротавирусной инфекции среди детей в возрасте до пяти лет, а в 2019 году — 15% случаев смерти от ротавируса среди детей этой возрастной группы.24 Однако эффективность вакцины зависит от региона, с низкими показателями сероконверсии в странах с низким и средним уровнем дохода. Данные клинических исследований с участием человека указывают на возможную связь между кишечной микробиотой и реакцией кишечной иммунной системы на ротавирусную вакцину 25 (рисунок 5).
МИКРОБИОТА: ДРУГ ИЛИ ВРАГ В КОНТЕКСТЕ ВИРУСНОЙ ДИАРЕИ?
При вирусной диарее, как и при инфекционной диарее в целом, исход противостояния между патогеном и хозяином зависит от сложного баланса, в котором значительную роль играет микробиота.
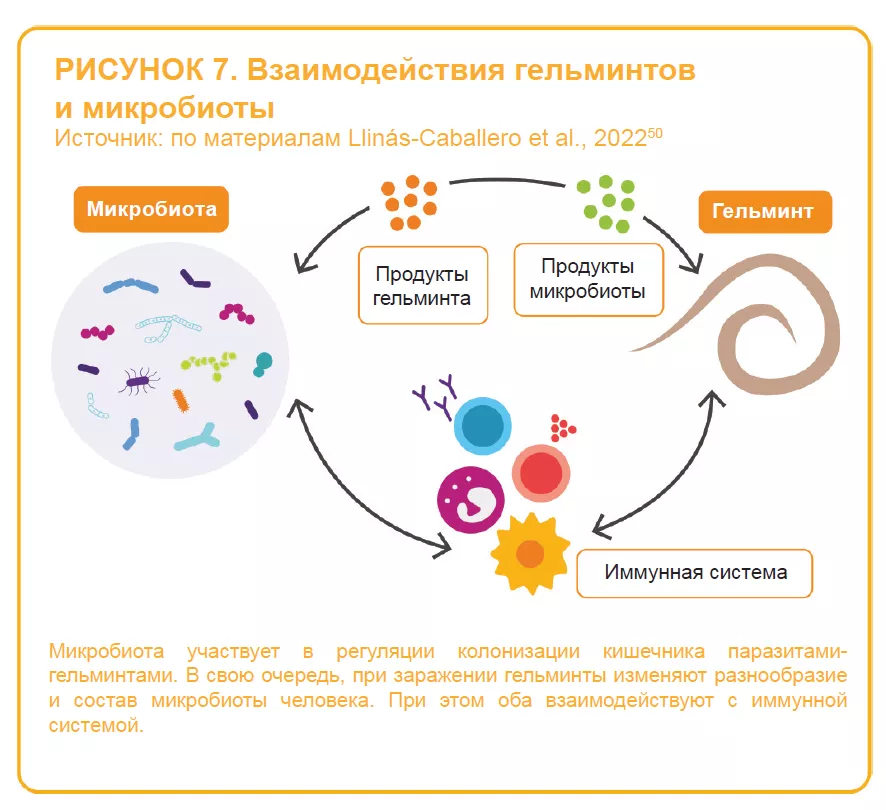
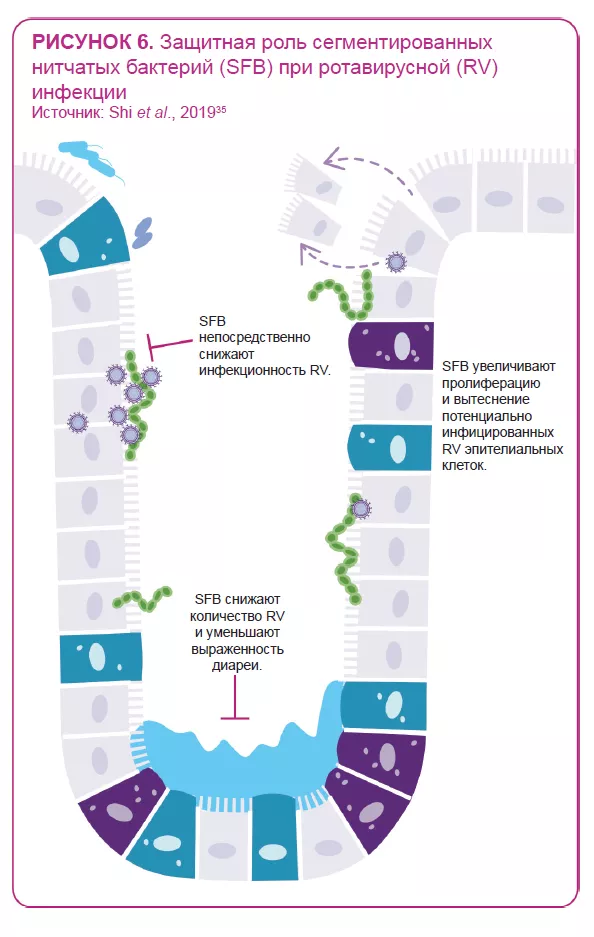
Кишечная микробиота двунаправленно взаимодействует с ротавирусной и норовирусной инфекциями:14 она может как защищать от инфекции, так и предрасполагать к ней; в свою очередь, инфекция может изменять состав кишечной микробиоты. Некоторые бактерии, по-видимому, способны подавлять вирусную инфекцию. Например, одно исследование показало способность сегментированных нитчатых бактерий предотвращать и купировать ротавирусную инфекцию у мышей35 (рисунок 6). С другой стороны, исследования in vitro и in vivo указывают на участие кишечной микробиоты в облегчении вирусной инфекции: некоторые кишечные микробы (например, Enterobacter cloacae) повышают способность человеческого норовируса инфицировать клетки человека in vitro; элиминация микробиоты с помощью антибиотиков задерживает инфицирование, снижает инфекционность и/или вирусный титр норовируса и ротавируса у мышей.8,36
Следовательно, любые инвазивные патогены могут оказывать различное воздействие в зависимости от состояния кишечной микробиоты.3 Оптимальный профиль микробиоты и методы воздействия на нее, которые могли бы предотвратить развитие вирусной диареи, все еще не установлены.37
Что касается влияния вирусной инфекции на состав кишечной микробиоты, многочисленные исследования зафиксировали специфические паттерны дисбиоза у пациентов с вирусной диареей по сравнению со здоровыми людьми.25,38 Часто сообщается о снижении (альфа) разнообразия микробиоты, однако конкретные таксоны, демонстрирующие увеличение или уменьшение, значительно варьируются в разных исследованиях.14 Остается один вопрос: отражает ли дисбиоз, наблюдаемый во время вирусной диареи, уже имеющуюся предрасположенность, которая могла способствовать инфекции, является ли это состояние вирус-индуцированным, или это комбинация обоих факторов?