Что микробы полости рта говорят о вашем здоровье.
Что, если болезни десен вызваны не только плохой гигиеной, но и токсинами бактерий? Новое исследование показывает, как эти соединения провоцируют воспаление и повреждение тканей, меняя подход к лечению заболеваний полости рта.

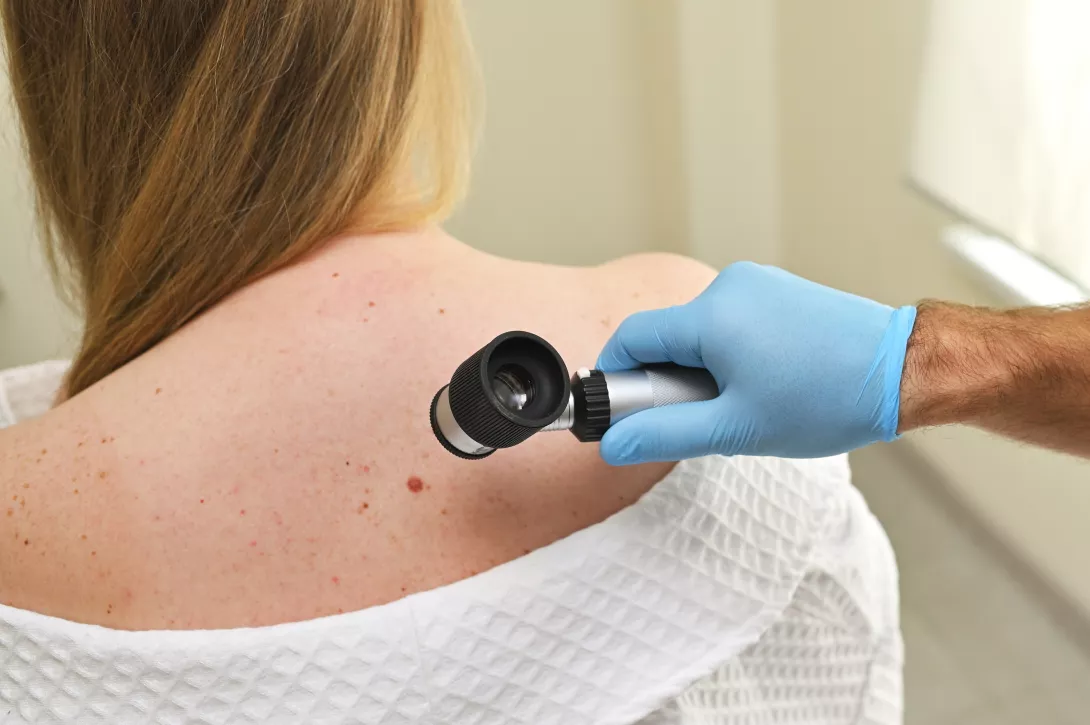
Стоматологи и исследователи годами считали причиной заболеваний десен «плохие» бактерии полости рта, в частности Porphyromonas gingivalis. Но новое исследование, проведенное в Университете Кюсю, Япония, показывает, что реальный вред могут наносить не столько сами бактерии, сколько производимые ими химические вещества 1.
Эти вещества или метаболиты — малые побочные продукты жизнедеятельности микробов. Представьте их как химический след. Некоторые из них токсичны. Исследователи обнаружили, что их накопление раздражает и даже повреждает клетки десен, вызывая воспаление, способствующее пародонтиту.
20-50% Заболевания пародонта поражают 20–50 % населения мира, что делает их серьезной проблемой общественного здравоохранения во всем мире.. ³
Что такое пародонтит?
Пародонтит — это группа воспалительных заболеваний, поражающих ткани вокруг зубов. Начинаясь с гингивита (покраснение, отек и кровоточивость десен), заболевание может перейти в пародонтит, вызывая рецессию десны, потерю костной ткани и расшатывание зубов. Ключевыми виновниками являются бактерии, такие как Porphyromonas gingivalis и Treponema denticola. 2
Важны не сами бактерии, а их функции
Для выявления этих связей исследователи собрали образцы жидкости после полоскания рта у 24 пациентов с заболеваниями десен и 22 здоровых людей. Этот тип образца, как «отпечаток пальца слюны», отражает микробиом полости рта и его активность.
Используя передовые инструменты, они определили доминирующие бактерии и метаболиты у больных. Затем 20 метаболитов были исследованы непосредственно на клетках десны человека in vitro. Клетки эпителия десны — первая линия защиты поддесневого пространства от зубного налета; их используют для моделирования процессов, происходящих в полости рта.
Этот шаг позволил им обнаружить реальные биологические эффекты, а не только корреляции, и определить соединения, способствующие повреждению десен.
Ученые обнаружили, что метаболиты (sidenote: Гомосерин Производное аминокислоты, которое обычно не участвует в метаболизме человека, но вырабатывается определенными бактериями; может оказывать провоспалительное или цитотоксическое действие на ткани, например, на эпителий десен. ) , пропионат, сукцинат и цитруллин, связанные с заболеваниями, подавляют рост клеток и вызывают воспаление, играющее ключевую роль в развитии пародонтита. Эти вещества не только замедляли рост клеток, но и стимулировали выработку (sidenote: Интерлейкин-8 (ИЛ-8) Сигнальный белок (цитокин), выделяемый клетками для привлечения иммунных клеток, таких как нейтрофилы, к месту инфекции или воспаления; повышенный уровень ИЛ-8 часто указывает на хроническое воспаление тканей. ) , ключевого медиатора воспаления.
Еще удивительнее? Гомосерин, ранее не ассоциировавшийся с заболеваниями полости рта, продуцируется некоторыми наиболее опасными бактериальными возбудителями, включая Prevotella intermedia и P. gingivalis. Эти микробы не просто ассоциируются с болезнью; они активно вырабатывают токсины, ухудшающие ее течение. Более того, наличие этих бактериальных метаболитов указывает на (sidenote: Дисбиоз Изменение состава и функции микробиоты, вызванное сочетанием экологических и индивидуальных факторов. Дисбиоз не является четко очерченным состоянием и варьируется в зависимости от состояния здоровья каждого человека. Levy M, Kolodziejczyk AA, Thaiss CA, et al. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17(4):219-232. ) поддесневой микробиоты, где дисбаланс зубного налета способствует началу заболевания.
Что такое пародонтальная микробиота?
Пародонтальная микробиота — это сообщество микроорганизмов, обитающих в поддесневой области. В здоровых деснах поддерживается бактериальный баланс, но при пародонтите доминируют патогенные бактерии. 4
Что это значит для вас и вашего стоматолога?
Это открытие смещает акцент на то, как конкретные виды способствуют воспалению в полости рта не только колонизацией, но и активностью метаболитов в поддесневой среде. Долгое время подход к лечению заболеваний десен был довольно прямолинейным: найти плохие бактерии и избавиться от них. Именно поэтому лечение часто включает в себя глубокую чистку, антисептические ополаскиватели или антибиотики для уничтожения микробов.
Однако это исследование показывает, что ключевая проблема заключается не только в наличии определенных бактерий во рту, но и в их активности.
Микроорганизмы: ключ к здоровью человека
Эти микробы подобны крошечным химическим фабрикам. Некоторые бактерии, даже присутствуя в небольших количествах, вызывают раздражение и воспаление десен, выделяя токсины. И это очень важно. Следовательно, просто уничтожить бактерии недостаточно; возможно, следует воздействовать на производимые ими вредные вещества.
Вскоре стоматологи смогут не только проверять налет, но и анализировать слюну на вредные химические вещества, подбирая лечение исходя из состояния микробиома полости рта. Это новый уровень персонализированной стоматологии, основанной на микробиоме.
Лечение пародонтита.
Лечение предусматривает профессиональную чистку зубов для удаления налета и камня, улучшение гигиены полости рта, а в тяжелых случаях — антибиотики. Восстановление здоровой микрофлоры включает пробиотики и изменение образа жизни. Регулярные визиты к стоматологу необходимы для контроля и поддержания здоровья. 5
Важность образцов слюны и поддесневого налета
Хотя в исследовании использовалась жидкость после полоскания рта, образцы поддесневого налета, по мнению ученых, точнее отражают микробный состав очагов поражения, особенно при пародонтите. В скором будущем комбинированный анализ микробов и метаболитов из поддесневого налета может стать стандартом диагностики здоровья полости рта.