Enterococcus faecium B6 выделенный у детей с ожирением, вызывает неалкогольную жировую болезнь печени через биоактивный метаболит тирамин
КОММЕНТАРИИ К СТАТЬЕ Раздел, посвященный детям
Проф. Эммануэль Мас (Emmanuel Mas)
Отделение гастроэнтерологии и диетологии, Детская больница, Тулуза, Франция

Комментарии к статье Wei et al. (Gut Microbes 2024) [1]
В статье рассматривается взаимосвязь микробиоты кишечника и неалкогольной жировой болезни печени (НАЖБП) у детей с ожирением, учитывая глобальный рост распространенности обоих заболеваний. Методология основана на мультиомном анализе и исследованиях когорт детей в сочетании с экспериментами in vitro и in vivo. Выделенный у детей Enterococcus faecium B6 способствовал развитию НАЖБП через выработку тирамина, вызывая накопление липидов, воспаление и фиброз печени. Эти результаты подтверждают причинно-следственную связь между бактерией и прогрессированием НАЖБП, открывая возможности для микробно- или метаболит-ориентированной терапии.
Что нам уже известно по этой теме?
В условиях пандемии ожирения мета-болически обусловленные заболевания пе-чени, такие как неалкогольная жировая бо-лезнь печени (НАЖБП), стали преоблада-ющей патологией, прогрессирующей от стеатоза до неалкогольного стеатогепатита (НАСГ) и цирроза. НАЖБП все чаще встречается у детей.
Патофизиология НАЖБП сложна, и важную роль в ней, вероятно, играет кишечная микробиота. Эффекты кишечной микроби-оты могут быть опосредованы различными метаболитами, включая тирамин.
Каковы основные выводы этого исследования?
В первой части исследования участ-вовали 156 детей с ожирением в возрасте от 6 до 18 лет, в том числе 78 с НАЖБП и 78 с изолированным ожирением. Две груп-пы различались по печеночным и метабо-лическим параметрам. Альфа-разнообра-зие микробиоты было ниже в группе НАЖБП. При НАЖБП наблюдалось увели-чение численности Enterococcus, Escherichia, Klebsiella, Dialister и Enterobacter и уменьшение численности Faecalibacterium, Eubacterium_eligens_group, Roseburia, Fusicatenibacter, Clostridium, Coprococcus и Parasutterella. Численность Enterococcus кор-релировала с уровнями АЛТ, АСТ, тригли-церидов и общего холестерина в сыво-ротке.
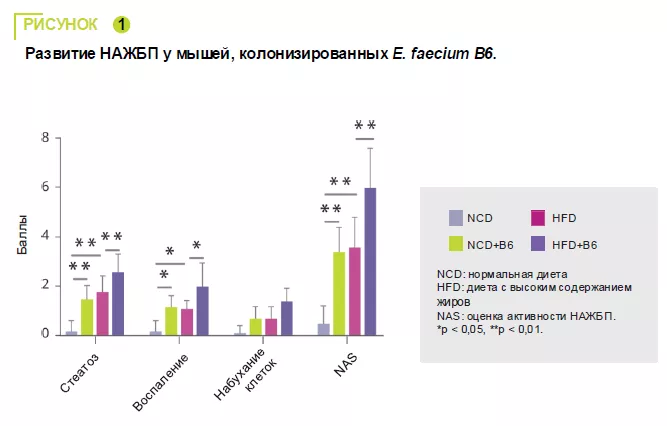
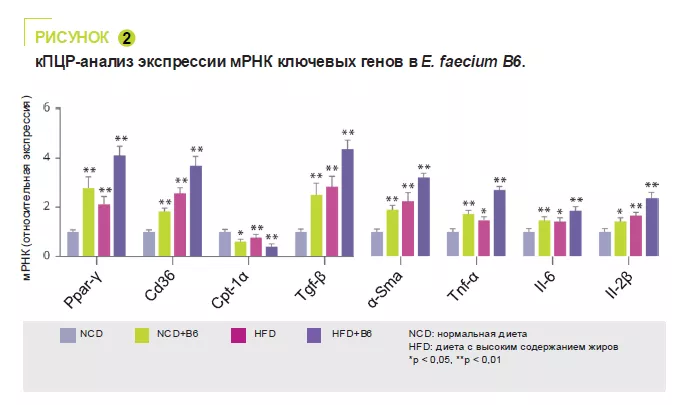
E. faecium B6, выделенный из кишечника детей с НАЖБП и ожирением, продемонс-трировал способность накапливать липиды в клеточной культуре. В 12-недельном исс-ледовании на мышах сравнивали нор-мальную (NCD) или обогащенную жирами (HFD) диету с витамином B6 или без него. E. faecium B6 усугублял повреждение пе-чени, вызванное перегрузкой, на биоло-гическом и гистологическом уровнях, не влияя на массу тела. (рисунок 1). Транс-криптомный анализ выявил, что E. faecium B6 модулирует экспрессию генов, свя-занных с метаболизмом липидов, воспа-лением, фиброзом и метаболизмом лино-левой кислоты, включая сигнальные пути PPAP, хемокинов, NF-kB и TGF-β. В мета-болизме липидов наблюдалось увеличе-ние экспрессии мРНК, белков PPARγ и CD36, и снижение экспрессии CPT-1a. За-фиксировано усиление экспрессии прово-спалительных цитокинов (TNF-α, IL-6, IL-1β) и фибротических белков (TGF-β, α-SMA) (рисунок 2).
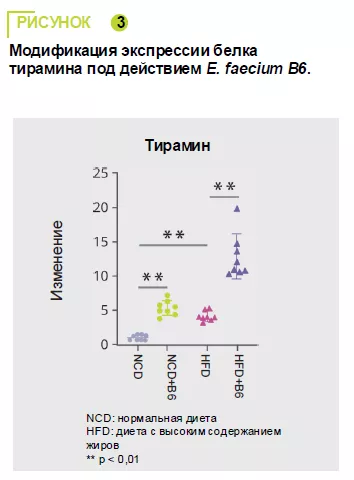
Нецелевой тандемный масс-спектрометри-ческий анализ сыворотки мышей показал, что E. faecium B6 изменял уровни метаболитов при нормальной диете (30 увели-чений и 85 уменьшений) и диете с высоким содержанием жиров (18 увеличений и 45 уменьшений). Наиболее заметным измене-нием было увеличение тирамина (рисунок 3).
Дальнейшие анализы показали, что E. faecium B6 способен продуцировать тирамин. Кроме того, введение мышам на диете NCD или HFD тирамина воспро-изводило развитие НАЖБП без влияния на массу тела, аналогично тому, как это наблюдалось с E. faecium B6, а также изменяло экспрессию генов, кодирующих PPARγ, CD36, CPT-1a, TNF-α, IL-6, IL-1β, TGF-β и α-SMA.
Наконец, авторы подтвердили эти ре-зультаты у 123 детей с НАЖБП и ожи-рением и у 123 человек из контрольной группы. Содержание E. faecium B6 и экс-прессия гена, кодирующего тирамин (mfnA), были выше в группе НАЖБП и кор-релировали с биологическими маркерами НАЖБП (АСТ, АЛАТ, тригли-цериды, об-щий холестерин и ЛПНП) и провоспали-тельными цитокинами (TNF-α, IL-6, IL-1β).
Каковы практические последствия?
Данное исследование подчеркивает роль кишечной микробиоты в развитии НАЖБП и предполагает новые терапев-тические возможности. Помимо Enterococcus faecium B6 и тирамина, PPARγ может играть центральную роль в связывании накопления липидов, воспалении и фиб-розе.
-
E. faecium B6, выделенная у детей с НАЖБП и ожирением, усугубляет заболевание посредством продукции биоактивного метаболита тирамина
-
E. faecium B6 и тирамин вызывают сходное развитие НАЖБП у мышей, как на нормальной, так и на высокожировой диете
ВЫВОДЫ
Enterococcus faecium B6 идентифицирован как штамм, усугубляющий НАЖБП у детей с ожирением. Эта бактерия продуцирует тирамин, биоактивный метаболит, активирующий сигнальный путь PPARγ и опосредующий наблюдаемые эффекты.