Функциональная диспепсия
Несмотря на необычное название, функциональная диспепсия — распространенное расстройство пищеварения. Характерные симптомы включают боли в желудке или изжогу, чувство переполнения и дискомфорт в желудке, тошноту. Хотя это состояние не угрожает жизни, оно снижает ее качество, а в его развитии участвует кишечная микробиота. Симптомы можно облегчить, изменив диету или модифицировав кишечную микрофлору с помощью пробиотиков.

What is functional dyspepsia?
Symptoms and prevalence
Функциональная диспепсия (ФД) — малоизвестное широкой публике, но очень распространенное желудочно-кишечное расстройство, которое недостаточно диагностируется и до сих пор плохо изучено. На ФД приходится от 3% до 5% обращений к врачам общей практики в Северной Америке! 1 !
Термин «диспепсия» происходит от греческих слов «dys» (плохой) и «pepsis» (пищеварение).
Разнообразные симптомы функциональной диспепсии всегда связаны с неприятными ощущениями из-за плохого пищеварения: 2
- чувство переполнения задолго до окончания приема пищи
- ощущение переедания (тяжесть и вздутие живота), несмотря на обычный прием пищи
- боль или жжение в верхней части живота
- потеря аппетита
- отрыжка или икота
- тошнота или даже рвота
Внимание!
Для постановки диагноза «функциональная диспепсия» симптомы должны быть длительными: они должны наблюдаться не менее шести месяцев и присутствовать не менее трех месяцев подряд.
Выделяют два типа функциональной диспепсии:
- постпрандиальный дистресс-синдром, характеризующийся ощущением вздутия живота (постпрандиальное переполнение) после еды или чувством переполнения до окончания приема пищи
- синдром эпигастральной боли (в верхней и средней части живота), при котором симптомы не связаны непосредственно с приемом пищи (изжога и т.д.
Знаете ли вы, что...
Расстройство называется функциональной диспепсией, поскольку оно не сопровождается какими-либо структурными нарушениями в органах и тканях пищеварительной системы. Симптомы не связаны с какой-либо органической или структурной патологией желудка (например, язвенной болезнью), а все обследования (гастроэнтероскопия, УЗИ, КТ и т. д.) дают отрицательный результат.
Насколько распространено заболевание? Кто подвержен наибольшему риску?
Исследования показывают, что 10-30% взрослых и 3-27% детей во всем мире страдают функциональной диспепсией. 2 Женщины, курильщики и люди, принимающие нестероидные противовоспалительные препараты (ибупрофен, кетопрофен), подвержены большему риску 3.
7% взрослых страдают функциональной диспепсией ⁴
3% to 27% детей в мире страдают функциональной диспепсией ⁴
Последствия для пациентов ощутимы: две трети людей с функциональной диспепсией испытывают постоянные и нерегулярные симптомы, которые могут влиять на качество жизни и самочувствие. 1

Какие факторы с нею связаны?
Образ жизни, питание…
Питание
Питание все чаще связывают с симптомами функциональной диспепсии. Виновники? Прежде всего, жирная пища. Но не только она. Углеводсодержащие продукты, молоко и молочные продукты, цитрусовые, острая пища, кофе и алкоголь также могут быть причастны. ⁵ Однако результаты этих исследований еще не окончательные.
Связь между конкретными продуктами и симптомами.
- Чувство переполнения желудка после еды: красное мясо, бананы, хлеб, пшеница, выпечка, макароны, колбасы, жареная пища, бобовые, майонез, молоко, шоколад, яйца, сладости, апельсины и другие цитрусовые
- Отрыжка: газированные напитки, лук, бобовые, молоко и бананы
- Жжение в верхней части живота: кофе, сыр, лук, перец, молоко, шоколад, ананас 5
Психологический фактор также может играть роль: неприятные воспоминания могут усиливать симптомы и их восприятие. Опыт показывает, что когнитивные задачи эффективно отвлекают пациентов от неприятных ощущений. А информация, что содержание жира в йогурте выше, чем есть на самом деле, усиливает тошноту у пациентов
FODMAP и диспепсия
FODMAP (ферментируемые олиго-, ди-, моносахариды и полиолы) — это углеводы, которые плохо перевариваются в человеческом организме. Они ферментируются кишечными бактериями (особенно бифидобактериями), что приводит к образованию газа и, следовательно, вздутию живота. Другие возможные эффекты включают увеличение объема воды в содержимом кишечника и чрезмерное производство (sidenote: КЦЖК короткоцепочечные жирные кислоты являются источником энергии (топливом) для клеток человека. Они взаимодействуют с иммунной системой и участвуют в коммуникации между кишечником и мозгом Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) (пропионата, бутирата и ацетата). Недавние клинические испытания показали, что FODMAP могут быть вовлечены в патогенез функциональной диспепсии. 6
Стресс и тревога
У пациентов с функциональной диспепсией часто наблюдаются стресс и тревога: одно крупное исследование показало четкую связь тревоги с этим заболеванием, в частности с постпрандиальным дистресс-синдромом; другое исследование, проведенное среди 18 000 японцев, показало, что пациенты с симптомами функциональной диспепсии испытывают больший стресс в повседневной жизни, чаще жалуются на недостаток сна и трудности с засыпанием. 5
Недостаток физической активности
Пациенты с функциональной диспепсией, как правило, сообщают о более низком уровне физической активности. Это печально, поскольку занятия спортом могут уменьшить симптомы, улучшить кишечный транзит и отхождение газов у людей, страдающих вздутием живота. 5
Микробиота и спорт: соревнующиеся микроорганизмы
Курение
Исследование, проведенное среди 2560 шведов, показывает, что курильщики подвержены большему риску развития постпрандиального дистресс-синдрома: курение от 10 до 19 сигарет в день увеличивает риск на 42%, а более пачки в день — повышает его больше чем в два раза. 7
Ожирение
Ожирение связано со многими желудочно-кишечными симптомами, включая функциональную диспепсию. Было выдвинуто несколько гипотез: например, у людей с ожирением рецепторы в полости рта и кишечнике, отвечающие за сигнализацию о присутствии жиров, могут быть изменены, усиливая желудочно-кишечные эффекты и повышая чувствительность к пищевым жирам. 5
Некоторые специалисты также указывают на взаимную связь между функциональной диспепсией и метаболическим синдромом, когда одно состояние способствует развитию другого, создавая порочный круг. 1
Бактерия Helicobacter pylori
С 1980-х годов известно, что желудок, несмотря на высокую кислотность, не стерилен. В нем даже обитает сообщество микроорганизмов, включая бактерию H. pylori. Однако инфицирование H. pylori, по-видимому, вызывает функциональную диспепсию: у пациентов с перенесенной инфекцией H. pylori повышен риск возникновения функциональной диспепсии. 2

Какая может быть связь с микробиотой?
Дисбиоз, влияние метаболитов…
Дисбиоз желудочно-кишечного тракта
Пищеварительный тракт является домом для почти 100 миллиардов микроорганизмов более 1000 различных видов, которые вместе известны как желудочно-кишечная микробиота.
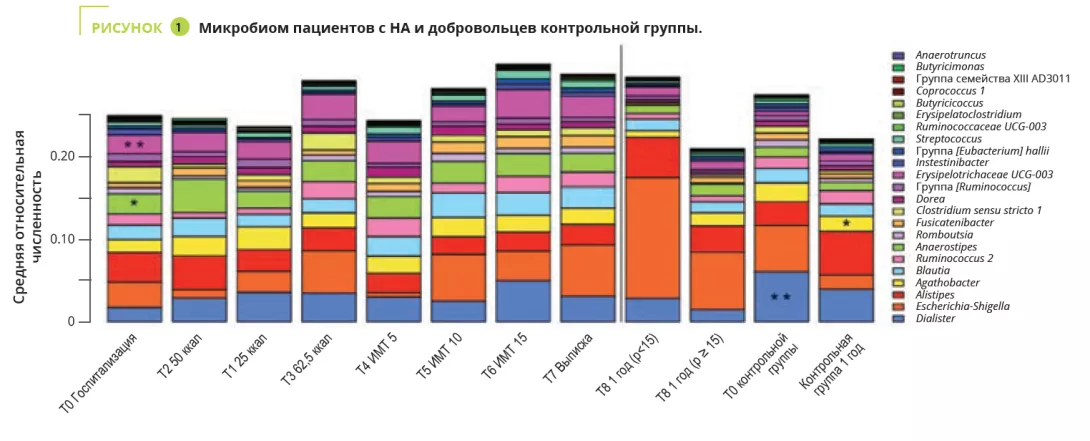
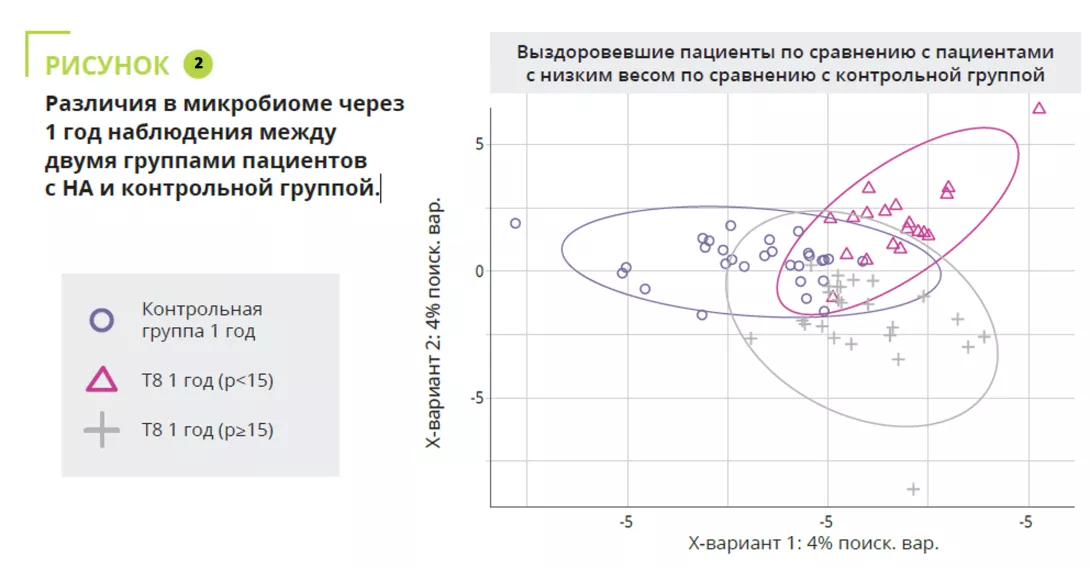
Proteobacteria, Firmicutes, Actinobacteria и Bacteroidetes доминируют в этом сообществе, составляя более 98% кишечной микробиоты; первое место по численности занимают Firmicutes, за которыми следуют Actinobacteria и Bacteroidetes. 2 По крайней мере, у здоровых людей. У пациентов с функциональной диспепсией этот баланс нарушен; вместо этого наблюдается дисбиоз всего желудочно-кишечного тракта, от рта до ануса. 2.
У пациентов с функциональной диспепсией исследования выявили:
- повышенное содержание Firmicutes, Streptococcus (связанных с симптомами в верхней части живота), Bifidobacterium и Clostridium
- меньшее содержание Prevotella (сопровождается более выраженными симптомами дискомфорта после еды)
Знаете ли вы, что такое «дисбиоз»?
Роль микробных метаболитов
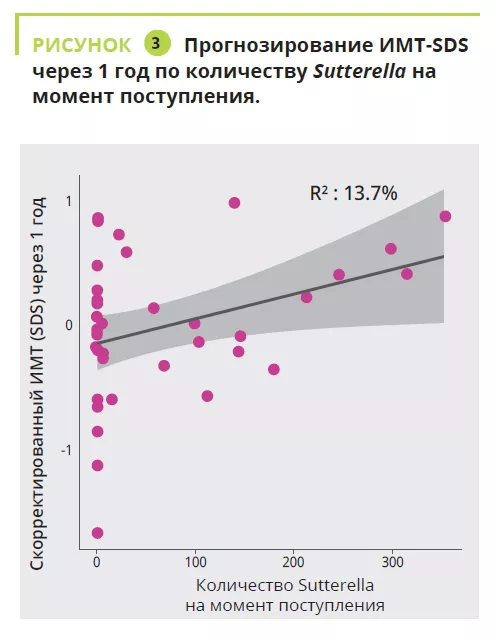
Роль микробиоты при функциональной диспепсии не ограничивается одними бактериями, поскольку каждая из них выделяет различные активные молекулы, как полезные, так и вредные, которые тесно связаны со здоровьем хозяина, а также возникновением и прогрессированием многих заболеваний. 2,3 Например:
- некоторые бактериальные метаболиты оказывают полезные эффекты (например, (sidenote: КЦЖК короткоцепочечные жирные кислоты являются источником энергии (топливом) для клеток человека. Они взаимодействуют с иммунной системой и участвуют в коммуникации между кишечником и мозгом Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) , продуцируемые Firmicutes)
- в то же время другие метаболиты вредны для хозяина (например, провоспалительные сфинголипиды, продуцируемые Bacteroidetes и Prevotellacae) 3
Каковы возможные механизмы?
Иммунитет, ось кишечник — головной мозг…
Хотя еще многое неясно, исследователи полагают, что механизмы, лежащие в основе функциональной диспепсии, многофакторны и варьируются от пациента к пациенту. 8 Таким образом, в развитии функциональной диспепсии участвует ряд механизмов:
Нарушение кишечного барьера
В норме пища, проходящая через желудочно-кишечный тракт, изолирована от организма барьером — слизистой оболочкой кишечника. Это полупроницаемый барьер: он легко пропускает через себя питательные вещества, но задерживает вредные соединения и патогены, попадающие в организм вместе с пищей. 2
У пациентов с функциональной диспепсией слизистая оболочка нарушена и хуже выполняет свою фильтрующую роль
Нарушение кишечного иммунитета
У пациентов с функциональной диспепсией наблюдается чрезмерный иммунный ответ: у 40% пациентов обнаруживаются воспалительные клетки в двенадцатиперстной кишке, а в тонкой кишке часто наблюдается избыток бактерий (особенно происходящих из полости рта)9, что может активировать иммунный ответ. Некоторые исследователи считают, что для лучшего понимания патогенеза функциональной диспепсии необходимо глубже изучить микробиоту тонкой кишки. 9
Избыточный рост бактерий в тонкой кишке (или синдром усиленного бактериального роста в тонкой кишке — SIBO) может играть роль в патогенезе функциональной диспепсии; избыточный рост бактерий чаще встречается у пациентов с функциональной диспепсией, чем у тех, кто не страдает этим расстройством.10,11 У пациентов с функциональной диспепсией, которые применяют ИПП (ингибиторы протонной помпы или препараты для снижения секреции кислоты в желудке), наблюдается повышенный риск развития SIBO.12 Снижая кислотность желудка, ИПП ослабляют химический барьер, призванный уничтожать патогенных микроорганизмов с помощью соляной кислоты, выделяемой стенками желудка. Это может объяснять наличие избытка бактерий в тонкой кишке, расположенной сразу после желудка. Однако доказательства связи между функциональной диспепсией и SIBO остаются слабыми: труднодоступность дуоденальной флоры ограничивает исследования анализом выдыхаемого воздуха у пациентов. Этот тест прост и неинвазивен, но ненадежен. 11
Нарушение регуляции оси кишечник — головной мозг
Кишечная микробиота, пищеварительная и центральная нервные системы тесно взаимосвязаны. Концепция оси микробиота — кишечник — головной мозг объясняет, почему стресс может вызывать боли в желудке или почему изменения кишечной флоры могут изменять моторику кишечника и «информировать» мозг, который, в свою очередь, может регулировать работу кишечника. Показано, что функциональная диспепсия тесно связана с нарушениями моторики желудочно-кишечного тракта (который находится под контролем головного мозга) и повышенной чувствительностью желудочно-кишечного тракта, и все это связано с желудочно-кишечной микробиотой. 2 Отсюда вывод, что все взаимосвязано...
Какую роль микробиота играет в деятельности оси кишечник — головной мозг?
Патологическая реакция на прием пищи
Наличие питательных веществ внутри пищеварительного тракта генерирует сигналы, которые изменяют пищеварение. Например, жирная пища дольше остается в желудке, поскольку опорожнение желудка замедляется. У пациентов с функциональной диспепсией прием пищи может быть связан с усиленным образованием сигналов в желудочно-кишечном тракте. Это вызывает ряд симптомов, не имеющих отношения к реальности, таких как чувство насыщения в самом начале приема пищи, повышенная чувствительность к растяжению желудка и так далее. 5
The presence of nutrients in the interior of the digestive tract produces signals that alter digestion. For example, a high-fat meal emains in the stomach longer, since gastric emptying is delayed. In functional dyspepsia patients, food ingestion may be associated with exaggerated signals from the gastrointestinal tract. This results in a whole series of symptoms which bear no relation to reality, such as feeling full when a meal has only just begun, hypersensitivity to gastric distension, and so on. 5

Имеющиеся и потенциальные методы лечения функциональной диспепсии.
Питание, пробиотики…
Питание
Логично предположить, что, поскольку диета считается одним из факторов, влияющих на функциональную диспепсию, ее коррекция может улучшить симптомы. Однако исследований, подтверждающих эффективность конкретных диет, очень мало. Тем не менее, эксперты считают, что значительной части пациентов может помочь диета с низким содержанием жиров и дробное питание (есть меньше, но чаще). На практике пациенты с функциональной диспепсией уже поступают подобным образом: они немного снижают потребление жиров и склонны есть чаще, но меньшими порциями. 5
Другим пациентам больше помогает отказ от острой или кислой пищи (помидоры, цитрусовые и т. д.), а также продуктов, богатых клетчаткой или FODMAP, которые вызывают вздутие живота. Однако такие ограничения следует вводить с осторожностью, чтобы избежать несбалансированного питания. 2
Рацион питания
Ингибиторы протонной помпы
Ингибиторы протонной помпы (ИПП) — это препараты, снижающие секрецию желудочной кислоты. Их назначают врачи для лечения гастроэзофагеальной рефлюксной болезни (ГЭРБ) и язвенной болезни. В краткосрочной перспективе ИПП могут улучшить симптомы функциональной диспепсии. Однако их длительное применение связано с увеличением количества Streptococcus и, следовательно, с развитием вредного дисбиоза. 13
Антибиотики для эрадикации H. pylori
Согласно рекомендациям Американской коллегии гастроэнтерологов и Канадской ассоциации гастроэнтерологов, пациентам младше 60 лет с функциональной диспепсией в первую очередь следует пройти обследование на наличие H. pylori. Если результаты теста окажутся положительным, необходимо назначить антибиотики для эрадикации (уничтожения) бактерии.
Однако у этой стратегии есть свои ограничения: только у одного из 10 пациентов наблюдается улучшение симптомов, тогда как у остальных симптомы могут ухудшиться. 14
Как антибиотики влияют на микробиоту и здоровье?
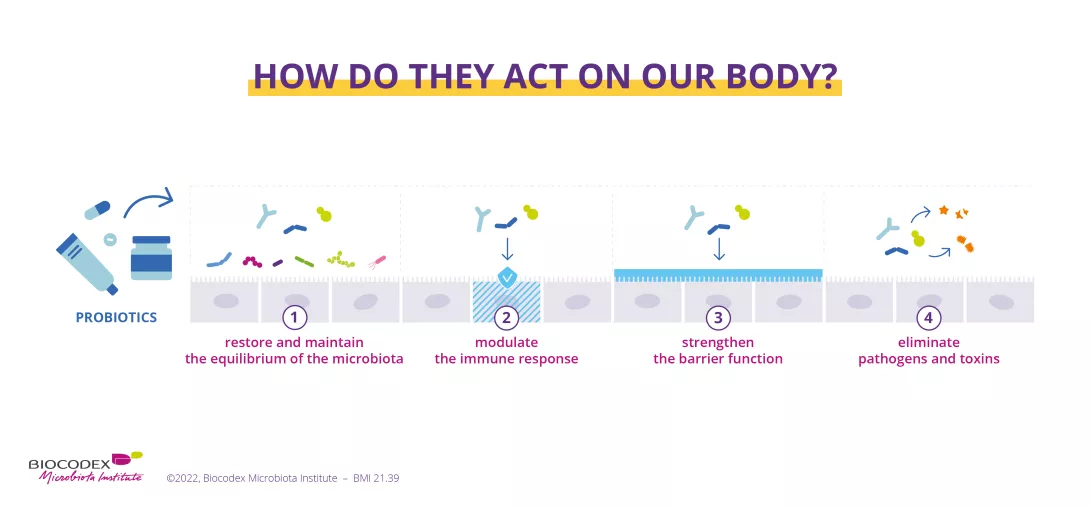
Пробиотики
Регуляция дисбиоза кишечной микробиоты — потенциальный метод лечения функциональной диспепсии, поскольку они тесно связаны. 2 Роль пробиотиков может быть многофакторной: 15
- восстановление комменсальной флоры, нарушенной патогенами
- восстановление проницаемости кишечного барьера
- снижение висцеральной гиперчувствительности
- местное и системное противовоспалительное действие
- регуляция моторики кишечника
Считается, что все эти положительные эффекты способствуют уменьшению симптомов функциональной диспепсии 15.
Многочисленные клинические исследования, похоже, подтверждают «на практике», что пробиотики могут улучшить симптомы у пациентов. 2,15
Однако результатов, опубликованных за последние 15 лет, недостаточно для окончательных выводов, поскольку у них есть ряд недостатков: определение заболевания продолжает меняться; в исследованиях часто путают функциональную диспепсию (длительную) с инфекцией H. pylori (кратковременной); используемые пробиотики сильно различаются от одного исследования к другому; оценка симптомов варьирует из-за отсутствия клинической объективности и т. д. 15 Необходимы дальнейшие исследования.
Альтернативные методы лечения
Различные альтернативные методы лечения признаны безопасными и эффективными при функциональной диспепсии:
- когнитивно-поведенческая терапия, обычно используемая для лечения стресса и тревоги, помогает пациенту определить мысли или поведение, вызывающие появлению или обострение симптомов
- гипнотерапия, при которой пациент в состоянии гипноза более восприимчив к терапевтическим воздействиям
- также исследуются возможности виртуальной реальности. 14
Кишечная микробиота
 Функциональная диспепсия: сложное название часто встречающегося расстройства пищеварения
Функциональная диспепсия: сложное название часто встречающегося расстройства пищеварения
 Функциональные расстройства кишечника: симптомы нарушения пищеварения
Функциональные расстройства кишечника: симптомы нарушения пищеварения