Microbiote intestinal et troubles du sommeil : vers une approche thérapeutique basée sur la modulation microbienne ?
Des recherches montrent que le microbiote intestinal influence le sommeil en modulant la production de butyrate, un métabolite qui affecte l'activité neuronale dans l'hypothalamus. De quoi ouvrir la voie à des traitements basés sur l'équilibre bactérien ?
L’adage « Qui dort dîne » n’a pas tort de sous-entendre un lien entre le système digestif et le cerveau : il semble effectivement exister une relation à double sens entre sommeil et microbiote, impliquant l’axe intestin-cerveau. Par quel mécanismes le microbiote intestinal impacte-t-il le sommeil ? C’est la question à laquelle a tenté de répondre une équipe de chercheurs. 1
Rôles du microbiote et du butyrate chez la souris
Première étape : les chercheurs ont étudié le sommeil de souris dotées d’un microbiote intestinal sans pathogènes, et de souris sans microbiote.
Résultat : l'absence du microbiote intestinal modifie l'architecture du cycle veille-sommeil pendant les phases de lumière et d'obscurité. Réciproquement, les auteurs avaient précédemment montré que la privation de sommeil allait de pair avec une diminution du taux de butyrate (fécal et hypothalamique) chez les souris avec un microbiote sans pathogène, mais pas chez les souris sans microbiote.
Étape suivante : les chercheurs ont montré que le butyrate produit par les bactéries intestinales peut moduler la fonction neuronale et favoriser le sommeil des rongeurs. Comment ? En inhibant l'activité neuronale de l' (sidenote: Orexine Neurotransmetteurs qui régulent une grande variété de fonctions biologiques, notamment le cycle veille-sommeil, le traitement de la récompense et du stress, la vigilance et le fonctionnement cognitif. Les altérations des niveaux centraux et périphériques d'orexine sont liées à des pathologies telles que la narcolepsie, l'anorexie mentale, le déclin cognitif lié à l'âge Approfondir Toor B, Ray LB, Pozzobon A et al. Sleep, Orexin and Cognition. Front Neurol Neu… ) dans la région hypothalamique latérale chez la souris.
40 % L’insomnie est souvent une condition chronique, avec un taux de persistance de 40 % sur une période de 5 ans. ²
10-20 % Environ 10 % de la population adulte souffre d’un trouble de l’insomnie, et 20 % supplémentaires éprouvent des symptômes occasionnels d’insomnie. ²
Insomnie Les femmes, les personnes âgées et celles en situation de précarité socio-économique sont plus vulnérables à l’insomnie. ²
Des résultats confirmés chez l’homme
Puisque l'absence de microbiote intestinal peut influencer le comportement du sommeil via une voie métabolique, restait à confirmer que les patients insomniaques présentent une dysbiose intestinale et des altérations du métabolisme microbien du butyrate. Chose faite dans une nouvelle étape de l’étude, via des prélèvements de selles de patients insomniaques et sains : une moindre (sidenote: Diversité alpha Nombre d'espèces coexistant dans un milieu donné. ) et une diminution significative de 39 bactéries productrices de butyrate sont observées chez les insomniaques. Ce qui explique des taux sériques en butyrate plus faibles chez ces mauvais dormeurs.
Transplantation de flore… et de sommeil
Enfin, pour tenter de démontrer une relation de cause à effet, de la flore digestive d’un patient insomniaque a été transplantée à des souris sans flore. Cette transplantation réduit leur butyrate sanguin, active des neurones de hypothalamus latéral et rend les rongeurs insomniaques à leur tour. L’administration de butyrate de sodium par voie orale améliore le sommeil de ces rongeurs.
Ces travaux montrent un rôle causal de l'axe microbiote intestinal-cerveau dans la modulation du sommeil. L’implication des voies métaboliques microbiennes dans la qualité du sommeil laissent envisager des stratégies thérapeutiques potentielles – via des probiotiques ou du butyrate – pour le traitement des troubles tels que l’insomnie.
 Des bactéries intestinales en cause dans l’apnée du sommeil
Des bactéries intestinales en cause dans l’apnée du sommeil
 Insomnie du senior : un lien avec le microbiote intestinal
Insomnie du senior : un lien avec le microbiote intestinal
Le secret d'un bon sommeil est dans vos intestins !
Et si la clé d’un sommeil réparateur se cachait dans notre intestin ? Pour bien dormir, il ne suffirait plus seulement de compter les moutons, mais aussi de veiller sur nos bactéries intestinales, histoire de valider que l’on possède bien un microbiote de bon dormeur.

L'adage « Qui dort dîne » n'est pas aussi farfelu qu'il y paraît. Votre ventre semble en effet avoir son mot à dire en matière de sommeil… Comment ? Via le microbiote intestinal, ce fameux ensemble de bactéries qui réside dans nos intestins. Et pour le prouver, des chercheurs ont mené une série d'expériences étonnantes. 1
3 à 5 Une bonne nuit de sommeil compte au moins 3 à 5 cycles de sommeil de 90 min. ²
10-20 % Environ 10 % de la population adulte souffre d’un trouble de l’insomnie, et 20 % supplémentaires éprouvent des symptômes occasionnels d’insomnie. ³
40 % L’insomnie est souvent une condition chronique, avec un taux de persistance de 40 % sur une période de 5 ans. ³
Pas de microbiote, pas de bon sommeil pour la souris
D'abord, ces scientifiques se sont intéressés à des souris : certaines avaient un microbiote intestinal « sain », d'autres aucun microbiote intestinal (intestin stérile). Le résultat ? Les souris sans microbiote avaient un sommeil complètement décalé. Le cycle jour-nuit était perturbé, comme si elles avaient oublié de régler leur horloge biologique interne. Mais alors, quel est le rôle précis de ce microbiote sur notre sommeil ?
Eh bien, c'est là qu'intervient un métabolite, le butyrate, produit par nos bactéries intestinales. Ce petit « messager » chimique semble avoir un impact direct sur notre cerveau, en particulier sur une zone clé pour le sommeil : l’hypothalamus latéral, celui qui gère notre vigilance. Le butyrate favorise ainsi l'endormissement en modifiant l’activité de certains neurones.
L’axe intestin-cerveau : Quel est le rôle du microbiote ?
Et chez les hommes ?
Pour aller plus loin, les chercheurs ont voulu vérifier si les humains souffrant d'insomnie avaient une flore intestinale différente de celle des bons dormeurs. Verdict : les insomniaques présentent un déséquilibre de leur microbiote et, en particulier, une réduction des bactéries qui produisent du butyrate. Résultat : moins de butyrate, moins de sommeil réparateur. L’observation chez les souris se confirme donc chez l’homme.
Mais l’histoire ne s’arrête pas là. Les chercheurs ont même transplanté la flore intestinale d'un humain insomniaque à des souris. Et devinez quoi ? Ces souris ont développé des troubles du sommeil similaires à ceux des humains insomniaques. Heureusement, administrer du butyrate de sodium à ces souris suffit à les faire replonger dans les bras de Morphée.
Tout ceci ouvre la voie à de nouvelles pistes thérapeutiques pour les insomniaques. Peut-être qu’un jour, en plus d’une bonne tisane, on nous prescrira une cure de probiotiques pour retrouver le sommeil. En tout cas, une chose est sûre : il semblerait que pour bien dormir, il va falloir aussi chouchouter son microbiote !
 Apnée du sommeil : des bactéries du microbiote intestinal mises en cause
Apnée du sommeil : des bactéries du microbiote intestinal mises en cause
 Insomnie chez les personnes âgées : le microbiote intestinal impliqué ?
Insomnie chez les personnes âgées : le microbiote intestinal impliqué ?
Diversité ou fonction : qu'est-ce qui définit un microbiote sain ?
Nous abritons en nous une communauté microbienne complexe, le microbiote intestinal, qui a un impact considérable sur notre santé. C'est le siège de processus métaboliques cruciaux influencés par notre alimentation, notre âge et notre environnement. Sa force ne s'appuie pas seulement sur la variété des microbes, mais aussi sur les fonctions essentielles qu'ils remplissent ensemble. Étant donné qu'un état sain est un équilibre dynamique entre nous et ces microbes, qu'est-ce qui définit un microbiote sain ?
À l'heure actuelle, nous explorons comme jamais auparavant le monde microscopique qui réside en nous : le microbiote intestinal. Une récente et minutieuse étude scientifique 1 a mis en lumière cet écosystème complexe, révélant à la fois les merveilles et les mystères de nos communautés microbiennes internes.
Cet article remet en question la vision simpliste de la « dysbiose », en soulignant que ce terme, souvent utilisé pour décrire un déséquilibre intestinal, n'est pas assez précis pour bien comprendre les enjeux.
l pose également une question fondamentale : de quoi est réellement constitué un microbiote « sain » ?
Qu’est-ce qui définit un microbiote sain ?
La définition d'un microbiote intestinal « sain » est complexe et va au-delà de la simple absence de maladie. Il s'agit d'évaluer la structure, la fonction et la composition microbienne de l'intestin.
Alors que l'on pensait autrefois qu'une grande diversité d'espèces microbiennes était le principal marqueur d'un intestin en bonne santé, on sait désormais que (sidenote: Diversité fonctionnelle Il s'agit de l'ensemble des activités métaboliques accomplies par le microbiote intestinal. Cet indicateur de la santé intestinale est plus important que la simple diversité taxonomique, car des compositions microbiennes différentes peuvent remplir des fonctions métaboliques similaires. L'évaluation de la diversité fonctionnelle peut fournir une indication plus précise des états physiologiques que la diversité compositionnelle seule. ) , c'est-à-dire l'ensemble des activités métaboliques accomplies par le microbiote, est plus importante. Cela signifie que des compositions microbiennes différentes peuvent remplir des fonctions métaboliques similaires.
-
La (sidenote: Spécificité des souches Cela met en évidence le fait que différentes souches d'une même espèce de bactéries peuvent avoir des effets très différents sur l'hôte. Par exemple, certaines souches E. coli sont pathogènes, tandis que d'autres, comme E. coli Nissle 1917, sont bénéfiques. Il est essentiel de comprendre les effets spécifiques des souches pour développer des thérapies ciblées et interpréter les recherches sur le microbiote intestinal. ) est également essentielle : des souches différentes au sein d'une même espèce peuvent avoir des effets extrêmement différents. Par exemple, certaines souches E. coli sont pathogènes, tandis que d'autres, comme E. coli Nissle 1917, sont bénéfiques.
-
Les metabolites tels que (sidenote: Acides Gras à Chaîne Courte (AGCC) Les acides gras à chaîne courte sont une source d’énergie (carburant) des cellules de l’individu, ils interagissent avec le système immunitaire et sont impliqués dans la communication entre l’intestin et le cerveau. Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) , les acides biliaires (AB) et les métabolites du tryptophane, sont des indicateurs clés d'un microbiote fonctionnel. Les AGCC, notamment le butyrate, sont indispensables pour l'énergie colonocytaire et la modulation immunitaire.
-
Les AB, produits dans le foie et modifiés par les bactéries intestinales, sont importants pour la digestion des graisses, la signalisation et l'action antimicrobienne.
-
Parmi les autres indicateurs, on compte la production de gaz (hydrogène, méthane, sulfure d'hydrogène), le pH intestinal et les marqueurs inflammatoires (calprotectine, lactoferrine).
-
Enfin, (sidenote: Résilience Il s'agit de la capacité du microbiote intestinal à maintenir une composition stable au fil du temps et à résister à des perturbations telles que les antibiotiques ou les changements de régime alimentaire. Un microbiote résilient peut se rétablir rapidement après des perturbations, réduisant ainsi le risque de problèmes de santé à long terme. ) , ou la capacité du microbiote intestinal à résister aux perturbations, est un marqueur capital d'un intestin sain.
La couche de mucus est également un élément clé d'un intestin en bonne santé.
Cette couche, principalement composée d'eau, d'électrolytes, de lipides et de mucines, agit comme une barrière physique qui empêche les bactéries d'entrer directement en contact avec les cellules épithéliales de l'intestin.
Un intestin sain se caractérise par un mucus suffisamment épais et difficilement pénétrable par les bactéries. Le renouvellement de la (sidenote: Couche de mucus Il s'agit d'une barrière complexe et dynamique qui tapisse l'intestin, principalement composée d'eau, d'électrolytes, de lipides et de mucines. Elle sépare physiquement les bactéries de l'épithélium intestinal, empêchant ainsi tout contact direct et préservant l'intégrité de la barrière intestinale. L'épaisseur et le renouvellement de la couche de mucus sont essentiels à la bonne santé de l'intestin. ) , qui comprend la synthèse, la sécrétion et la dégradation, est un processus subtilement réglé, nécessaire au maintien d'une fonction de barrière appropriée.
Des facteurs comme les prébiotiques, par exemple les fructo-oligosaccharides (FOS) et le 2'-fucosyllactose (2'FL), peuvent influencer la production, la composition et la dégradation du mucus, renforçant ainsi l'intégrité de la barrière intestinale et contribuant à la protection contre les troubles métaboliques.
La perturbation de la couche de mucus, constatée entre autres avec certains émulsifiants alimentaires, peut entraîner une augmentation de la perméabilité intestinale ainsi qu'une inflammation.
90 à 95 % le mucus est principalement constitué de divers composants, dont 90 à 95 % d'eau, d'électrolytes, de lipides (1 à 2 %), de protéines et d'autres substances. ¹
45 % environ 45 % des espèces de bactéries sont similaires entre deux individus ; leur microbiote partage 82 % de voies métaboliques communes.¹
L'axe intestin-foie : une communication à double sens
L'intestin et le foie interagissent étroitement et de manière bidirectionnelle via l'axe intestin-foie. Le foie, en tant qu'organe principal de détoxification et de régulation métabolique, traite et neutralise un grand nombre de toxines environnementales, de médicaments et de sous-produits métaboliques provenant de l'intestin.
Le foie produit des AB, qui sont essentiels à la digestion des graisses et qui influencent également la composition et la fonction du microbiote intestinal. Les bactéries intestinales métabolisent ensuite les AB primaires en AB secondaires, qui ont des fonctions différentes et dont certains sont même associés à la longévité.
Bien que le foie soit exposé à des antigènes bactériens d'origine intestinale, il ne produit généralement pas de cytokines pro-inflammatoires. Cependant, un foie sain produit des molécules anti-inflammatoires telles que l'antagoniste du récepteur de l'IL-1 (IL-1Ra), afin d'atténuer l'inflammation, mais aussi des macrophages immunosuppresseurs spécifiques, qui dépendent du microbiote intestinal, pour contrôler l'inflammation excessive.
Facteurs influençant l'écosystème microbien
Le microbiote intestinal est dynamique et influencé par l'âge, le mode d'accouchement à notre naissance, l'alimentation et le mode de vie.
-
L'âge et le mode d'accouchement sont fondamentaux. Les nourrissons nés par voie basse ont tendance à avoir un microbiote intestinal plus diversifié et plus équilibré, tout comme les bébés allaités, qui possèdent davantage de bactéries bénéfiques, telles que Bifidobacterium spp.
-
L'alimentation iest d'une importance capitale. Les fibres alimentaires, les prébiotiques, les polyphénols et les oligosaccharides du lait maternel (HMO) favorisent les microbes bénéfiques. En revanche, les graisses saturées, les édulcorants artificiels et les émulsifiants peuvent perturber l'équilibre microbien et altérer la fonction de la barrière intestinale.
-
Les émulsifiants courants, comme la carboxyméthylcellulose (CMC) et le polysorbate 80 (P80), perturbent la couche de mucus protectrice de l'intestin, ce qui entraîne une augmentation de la perméabilité intestinale ainsi qu'une inflammation.
-
Les lipides bioactifs jouent également un rôle crucial et bidirectionnel. Les lipides de l'hôte influencent le microbiote intestinal, et les microbes intestinaux produisent des lipides (par exemple, des AGCC, des AB secondaires et d'autres molécules de signalisation) qui ont un impact sur la régulation immunitaire et la santé métabolique.
Un microbiote intestinal sain : bien plus que des bactéries
Il devient de plus en plus difficile de s'accorder sur une définition unanime d'un microbiote intestinal « sain ». L'immense variabilité individuelle du microbiote intestinal, influencée par la génétique, l'alimentation, l'environnement et le mode de vie, ainsi que sa nature dynamique, compliquent l'instauration de normes universelles.
L'interaction entre le microbiote intestinal, le système immunitaire et les processus métaboliques représente un défi aux multiples facettes. Des études longitudinales sont essentielles pour comprendre pleinement les changements dynamiques qui interviennent au sein du microbiote intestinal et leurs effets à long terme sur la santé. Ce domaine de recherche complexe nécessite une approche pluridisciplinaire, intégrant la microbiologie, la génomique, la bio-informatique, la recherche clinique et la médecine personnalisée.
 De la ferme à l’intestin : les étonnants effets des fruits et légumes sur le microbiote intestinal
De la ferme à l’intestin : les étonnants effets des fruits et légumes sur le microbiote intestinal
 Tout ce que vous devez savoir sur la dysbiose
Tout ce que vous devez savoir sur la dysbiose
Au-delà de la diversité : percer les secrets d'un microbiote intestinal sain
La vision conventionnelle d'un intestin sain a longtemps été dominée par l'idée que la diversité était reine. On pensait qu'une grande variété d'espèces microbiennes était le principal indicateur d'un bon fonctionnement de l'intestin. Cependant, nos sources suggèrent que cela est beaucoup trop simpliste. Alors, qu'est-ce qui définit un « microbiote sain » ?

Dans notre corps, il existe un monde invisible d'une étonnante complexité : le microbiote intestinal. Cette communauté très vivante de microbes, semblable à une forêt tropicale cachée à l'intérieur de chacun d'entre nous, agit profondément sur notre santé. Pendant des années, les scientifiques ont cru qu'un mélange diversifié de ces minuscules organismes était la clé d'un intestin en bonne santé. Toutefois, comme dans tout écosystème complexe, ce n'est pas seulement le nombre d'espèces qui compte, mais aussi ce qu'elles font. On évoque désormais (sidenote: Diversité fonctionnelle Il s'agit de l'ensemble des activités métaboliques accomplies par le microbiote intestinal. Cet indicateur de la santé intestinale est plus important que la simple diversité taxonomique, car des compositions microbiennes différentes peuvent remplir des fonctions métaboliques similaires. L'évaluation de la diversité fonctionnelle peut fournir une indication plus précise des états physiologiques que la diversité compositionnelle seule. ) , c'est-à-dire l'ensemble des tâches accomplies par ces microbes. Outre le fait d'être variés, ces microbes doivent travailler en harmonie. 1
Microorganismes : de précieux microbes pour la santé humaine
Une main-d'œuvre invisible
Puisqu'une forêt tropicale abrite une faune diversifiée, il en va de même pour notre intestin. Ces habitants microbiens ne sont pas paresseux, ce sont des travailleurs indispensables. Ils produisent des substances vitales appelées (sidenote: Acides Gras à Chaîne Courte (AGCC) Les acides gras à chaîne courte sont une source d’énergie (carburant) des cellules de l’individu, ils interagissent avec le système immunitaire et sont impliqués dans la communication entre l’intestin et le cerveau. Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25. ) (AGCC), qui agissent comme un carburant pour notre muqueuse intestinale et maintiennent notre système immunitaire en état de marche. L'un de ces AGCC, le butyrate, est une sorte de super-héros qui fournit de l'énergie aux cellules de notre côlon.
Il y a ensuite les acides biliaires, initialement fabriqués par le foie puis transformés par les bactéries intestinales. Agissant tel un détergent du système digestif, ils sont essentiels à la digestion des graisses. Le foie et l'intestin sont en constante conversation ; ils s'influencent mutuellement. L'intestin produit des molécules qui apportent des messages au foie, et le foie lui renvoie des acides biliaires.
Une barrière protectrice
Notre intestin n'est pas seulement un lieu propice aux microbes, c'est aussi une remarquable barrière. (sidenote: Couche de mucus Il s'agit d'une barrière complexe et dynamique qui tapisse l'intestin, principalement composée d'eau, d'électrolytes, de lipides et de mucines. Elle sépare physiquement les bactéries de l'épithélium intestinal, empêchant ainsi tout contact direct et préservant l'intégrité de la barrière intestinale. L'épaisseur et le renouvellement de la couche de mucus sont essentiels à la bonne santé de l'intestin. ) , une substance brillante et gélatineuse, agit à la manière d'un garde du corps qui empêche les bactéries de toucher directement la délicate paroi de nos intestins. Pour maintenir la protection, cette couche est constamment renouvelée grâce à un processus méticuleusement géré, semblable au système d'assainissement d'une ville. Étonnamment, elle est également influencée par ce que nous mangeons.
Certaines fibres et certains prébiotiques peuvent contribuer à protéger la couche de mucus, en veillant à ce qu'elle reste robuste. Mais certains aliments transformés contenant des émulsifiants peuvent perturber cette couche et rendre la barrière intestinale plus perméable, à l'image d'une ville dont les défenses auraient été percées.
Quelle est la différence entre les prébiotiques, les probiotiques et les postbiotiques ?
La résilience est essentielle
À l'instar d'une forêt tropicale qui résiste aux tempêtes, un microbiote sain doit être (sidenote: Résilience Il s'agit de la capacité du microbiote intestinal à maintenir une composition stable au fil du temps et à résister à des perturbations telles que les antibiotiques ou les changements de régime alimentaire. Un microbiote résilient peut se rétablir rapidement après des perturbations, réduisant ainsi le risque de problèmes de santé à long terme. ) . Il doit pouvoir rebondir rapidement après des perturbations, comme une maladie ou des antibiotiques, ayant rompu son délicat équilibre. Nous commençons à comprendre qu'un intestin en bonne santé n'est pas une entité fixe. Le microbiote intestinal est dynamique et propre à chaque personne. De plus, il est influencé par notre naissance, notre environnement, notre mode de vie et notre alimentation. Définir un intestin « sain » est donc une tâche complexe, qui nécessite une exploration scientifique beaucoup plus poussée.
Il ne s'agit pas simplement de bonnes ou de mauvaises bactéries, mais de la fonction globale et de la capacité du microbiote à faire face aux changements. Il semblerait que la clé soit l'équilibre et la capacité à jouer parfaitement sa partition, davantage comme un orchestre que comme un soliste. Cette nouvelle façon de voir le microbiote changera notre approche des soins de santé et nous aidera à protéger ces alliés microscopiques qui vivent en nous.
Le microbiote intestinal
Observatoire international des microbiotes 2nd édition
Par Biocodex Microbiota Institute et IPSOS
Un début de prise de conscience de l’importance du microbiote pour la santé mais le chemin est encore long : les professionnels de santé ont un rôle clé à jouer dans l’éducation et l’information !
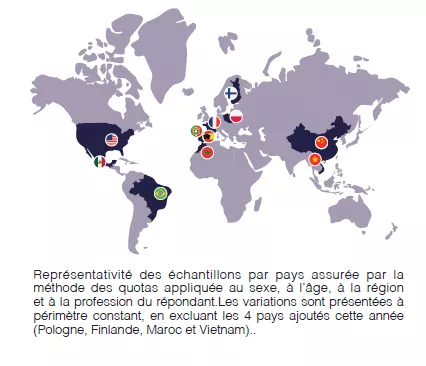
Pour la deuxième année consécutive, le Biocodex Microbiota Institute a confié à Ipsos la réalisation d’une grande enquête internationale sur le microbiote : l’Observatoire International des Microbiotes. L’enquête a été menée par Ipsos auprès de 7 500 personnes dans 11 pays (France, Espagne, Portugal, Pologne, Finlande, Maroc, États-Unis, Brésil, Mexique, Chine et Vietnam). Dans chaque pays, l’échantillon interrogé est représentatif de la population du pays âgée de 18 ans et plus en termes de sexe, d’âge, de profession et de région. L’enquête a été réalisée par Internet, du 26 janvier au 26 février 2024. Voici les principaux enseignements.
11 PAYS
7,500 PARTICIPANTS
Les connaissances concernant le microbiote et son rôle progressent dans le monde mais il demeure un organe encore trop souvent méconnu
- Cette année encore, seulement 1 personne sur 5 déclare savoir exactement ce que signifie le terme « microbiote » (23 %) mais la notoriété de ce terme tend à progresser (+3 points vs 2023). Au total, ce sont 7 personnes sur 10 qui ont déjà entendu parler du microbiote (+7 points vs 2023).
- La connaissance de la diversité des microbiotes reste limitée, mais progresse également par rapport à l’an passé. Le microbiote intestinal reste le microbiote le plus connu : 26 % savent précisément ce que c’est (+2 points vs 2023). Viennent ensuite le microbiote vaginal (20 %, +3 points vs 2023), le microbiote oral (20 %, +2 points vs 2023), le microbiote cutané (17 % ; +1 point vs 2023) et le microbiote urinaire (16 %, +2 points vs 2023).
- Le rôle et les fonctions du microbiote sont aussi mieux connus par rapport à l’année dernière : 78 % savent que leur alimentation a des conséquences sur l’équilibre de leur microbiote (+2 points vs 2023).
- Cependant, il reste beaucoup de chemin à parcourir, notamment sur les connaissances concernant les caractéristiques et la composition du microbiote. Moins d’1 personne sur 2 sait que le microbiote n’est pas localisé exclusivement dans l’intestin (46 %, +1 point vs 2023), et seule la moitié des répondants sait que le microbiote permet à l’intestin de délivrer au cerveau des informations essentielles pour leur santé (53 %, identique à 2023).

Pour maintenir leur microbiote équilibré, les populations commencent à changer leurs comportements
- Plus de la moitié de la population interrogée (58 %) déclare avoir déjà changé ses comportements afin de protéger au mieux l’équilibre et le bon fonctionnement de son microbiote. Cette prise de conscience est cependant à relativiser : ils ne sont que 17 % à le faire « beaucoup », 2 personnes sur 5 disant le faire uniquement « un peu » (41 %).
- La grande majorité des répondants déclare avoir adopté des comportements appropriés, même s’ils avouent souvent ne le faire que partiellement. Ils sont ainsi une grande majorité à déclarer manger équilibré et varié (84 %, mais seulement 33 % le font tout à fait), pratiquer une activité physique (78%, mais seulement 35 % déclarent le faire tout à fait), éviter de fumer (76 %) ou limiter les aliments transformés (75 %, mais seulement 26 % disent le faire tout à fait) pour limiter le risque de déséquilibre du microbiote.
- En revanche, certains comportements plus spécifiquement liés à la protection du microbiote sont encore insuffisamment adoptés. 59 % déclarent se laver plusieurs fois par jour, une pratique susceptible de provoquer une dysbiose (un déséquilibre dans la composition du microbiote qui peut provoquer de nombreux problèmes de santé) et 42 % des femmes prennent des douches vaginales, bien que ce soit nocif pour leur microbiote vaginal.
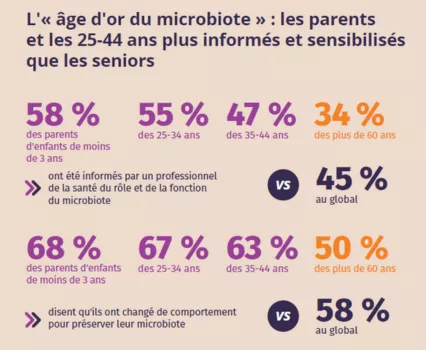
Un « âge d’or du microbiote » ? Les parents et les 25-44 ans, les meilleurs connaisseurs du microbiote contrairement aux seniors
- Les parents d’enfants de moins de 3 ans et les 25-44 ans sont plus sensibilisés et informés : c’est « l’âge d’or du microbiote ».
- On retrouve parmi ces populations une plus forte connaissance du microbiote : 76 % des parents d’enfants de moins de 3 ans, 78 % des 25-34 ans et 75 % des 35-44 ans ont déjà entendu parler du terme « microbiote » (vs 70 % au global).
- Les parents de jeunes enfants (68 %), les 25-34 ans (67 %) et les 35-44 ans (63 %) sont aussi ceux qui déclarent le plus avoir modifié leurs comportements pour protéger l’équilibre et le bon fonctionnement de leur microbiote (vs 58 % au global).
- Cela s’explique en partie par le rôle des professionnels de santé en termes de sensibilisation. Ainsi, 58 % des parents d’enfants de moins de 3 ans, 55 % des 25-34 ans et 47 % de 35-44 ans ont reçu des explications des professionnels de santé qui les suivent sur ce qu’est le microbiote, son rôle et ses fonctions (vs 45 % au global).
- En revanche, alors même que leur âge les expose à des problèmes de santé récurrents, les seniors sont les grands oubliés du microbiote.
- Leur connaissance du microbiote est plus faible : seulement 61 % des 60 ans et plus ont déjà entendu parler du microbiote (vs 70 % au global).
- Avec les professionnels de santé, le sujet est peu abordé : seulement un tiers des seniors ont reçu des informations de leur part sur le microbiote, son rôle et ses fonctions (34 %, vs 45 % au global).
Reconnue par la population mondiale comme la source d’information la plus fiable sur le microbiote, les professionnels de santé ont un rôle crucial à jouer : ils encouragent l’adoption de bons comportements chez leurs patients
- Les professionnels de santé, l’interlocuteur le plus crédible pour transmettre l’information : plus de 3 répondants sur 4 considèrent les professionnels de santé comme la source d’information la plus fiable sur le microbiote (78 % ; première source mentionnée).
- Par rapport à l’année dernière, les populations ont été plus sensibilisées sur le microbiote par leurs professionnels de santé, une évolution encourageante. Ainsi, 45 % ont eu des explications sur ce qu’est le microbiote, un indicateur qui progresse de 6 points par rapport à 2023.
- Cette sensibilisation faite par les professionnels de santé est d’autant plus importante qu’elle a un impact majeur sur les connaissances et comportements des patients. En effet, les individus ayant reçu de manière répétée des informations de la part d’un professionnel de santé sur le microbiote ont une meilleure connaissance du microbiote (53 % savent précisément ce que c’est, vs 23 % au global). Ils sont aussi plus susceptibles d’avoir changé leurs comportements pour maintenir leur microbiote équilibré (95 %, vs 58 % au global).

Découvrir tous les résultats
Microbiote vaginal #22
Par la Pr. Satu. Pekkala
Chercheuse à l’Académie de Finlande, Faculté des sciences
du sport et de la santé, Université de Jyväskylä, Finlande

Ménopause : le déséquilibre du microbiote vaginal favoriserait l’inflammation
Lors de la préménopause (la période qui précède la disparition définitive des règles), la chute du taux d’oestrogènes entraîne une diminution de la teneur des cellules de la muqueuse en glycogène qui est la nourriture préférée des Lactobacillus. Moins bien nourries, ces dernières vont devenir moins abondantes et perdre leur position dominante au sein de la flore, ce qui peut entraîner des déséquilibres du microbiote vaginal. La diminution des hormones sexuelles est également associée à une augmentation néfaste de la diversité microbienne.
Plusieurs travaux ont montré que la perte de dominance des Lactobacillus et l’augmentation de la diversité bactérienne sont associées à l’inflammation de la muqueuse vaginale. Les inflammations augmentent le risque d’infection, notamment d’IST (infection sexuellement transmissible), mais aussi de lésion précancéreuse du col de l’utérus. Si le lien entre modifications du microbiote vaginal et inflammation a été mis en évidence chez les femmes préménopausées, aucune étude n’avait jusqu’à ce jour été menée pour savoir s’il persistait lors de la post-ménopause.
Afin de documenter ce sujet, une équipe de chercheurs américains a utilisé les données concernant 119 femmes post-ménopausées (61 ans en moyenne) qui avaient participé à un essai clinique comparant les effets, sur la flore vaginale, des oestrogènes à ceux d’une crème hydratante. Ils ont analysé, dans les fluides vaginaux des volontaires, d’une part les populations bactériennes et d’autre part les marqueurs de l’inflammation (cytokines), afin de savoir si ces deux paramètres étaient liés. Ils ont découvert que les femmes dont le microbiote vaginal est le plus diversifié ou le plus appauvri en Lactobacillus sont celles qui présentent les concentrations les plus élevées de cytokines. Ces deux caractéristiques du microbiote vaginal sont donc associées à l’inflammation, comme chez les femmes préménopausées.
Ces résultats sont intéressants puisqu’ils suggèrent qu’il pourrait être un jour possible, en modulant le microbiote vaginal des femmes après la ménopause, de limiter l’inflammation de la muqueuse vaginale, et donc d’agir de manière préventive pour préserver leur santé.
Microbiote intestinal #22
Par le Pr. Satu. Pekkala
Chercheuse à l'Académie de Finlande, Faculté des sciences du sport et de la santé, Université de Jyväskylä, Finlande

Liens entre le microbiote et l’apparition future de troubles du neurodéveloppement
Les troubles du neurodéveloppement (TND) tels que les troubles du spectre de l’autisme (TSA) ont des répercussions majeures sur le système nerveux central. Il est fréquent que les personnes atteintes d’un TSA souffrent également de symptômes gastro-intestinaux (GI), un phénomène qui pourrait s’expliquer par un dysfonctionnement au niveau de l’axe intestin-cerveau. On ne sait néanmoins pas exactement en quoi le microbiote pourrait affecter le développement de TND. Cette étude a suivi une cohorte de naissance suédoise (n = 16 440) pendant plus de 20 ans et a analysé les associations entre différents biomarqueurs, dont le microbiote, et un diagnostic futur de TND. Parmi les facteurs de risque de TND présents en début de vie, ont été aux antibiotiques, en particulier chez les personnes atteintes d’un TSA. Par ailleurs, plusieurs espèces composant le microbiote intestinal, notamment celles appartenant au phylum Firmicutes, étaient associées à des problèmes GI. Les enfants ayant connu des épisodes fréquents d’otite étaient davantage susceptibles de développer un TSA, tandis que l’exposition à des substances chimiques nocives prédisposait à l’apparition d’un trouble déficit de l’attention/ hyperactivité (TDAH). Concernant les TSA, le métabolome et le lipidome du sérum du cordon ombilical ainsi que le métabolome des selles ont été analysés à la naissance et à l’âge de 1 an. Chez les nouveau-nés développant ultérieurement un TSA, on a détecté une diminution de lipides essentiels, comme l’acide α-linolénique et les acides biliaires, qui pourrait indiquer une inflammation. La dysbiose du microbiote intestinal est intervenue tôt dans la vie et était associée notamment aux acides gras et aux précurseurs de neurotransmetteurs. La bactérie Akkermansia muciniphila, qui présente des propriétés bénéfiques pour la santé et immunomodulatrices, était absente chez les nourrissons à qui on a diagnostiqué ultérieurement un TSA, mais elle n’était pas associée au développement futur d’un TDAH. Les genres Akkermansia et Coprococcus, qui étaient réduits chez les nourrissons développant plus tard un TND, étaient associés positivement avec les vitamines essentielles et les précurseurs de neurotransmetteurs fécaux.
Pour conclure, les résultats de cette étude suggèrent que le microbiote intestinal joue un rôle dans les origines précoces des TND. Ces données établissent les bases d’interventions précoces visant les TND et pourraient être utiles pour prédire ces troubles en début de vie.
Lien de causalité entre microbiote intestinal et maladies cutanées immunitaires
Un nombre croissant d’études indiquent que de nombreuses maladies de la peau sont liées à l’équilibre général régnant au sein de l’organisme, y compris l’homéostasie du microbiote intestinal. Le psoriasis (PSO), la dermatite atopique (DA), l’acné et le lichen plan sont les dermatoses les plus courantes. Le PSO et la DA ont été reliés à la santé gastro-intestinale et de nombreuses études ont mis en évidence des associations entre l’acné et un déséquilibre du microbiote intestinal. On ne sait néanmoins pas exactement si ces associations reflètent un lien de causalité.
Dans cette étude, les données résumées d’associations génétiques complètes concernant le microbiote intestinal, le psoriasis, la dermatite atopique, l’acné et le lichen plan ont été extraites des bases de données publiques par les auteurs. Ils ont ensuite utilisé une analyse par randomisation mendélienne (RM) bidirectionnelle à deux échantillons pour étudier le lien de causalité éventuel entre le microbiote intestinal et les maladies cutanées. En tout, 18 340 personnes ont été incluses dans l’étude, et les polymorphismes mononucléotidiques (single nucleotide polymorphisms, SNP) significatifs sur l’ensemble du génome associés aux taxa du MI ont été identifiés.
Les auteurs ont retrouvé cinq genres associés dans le groupe PSO, sept genres associés dans le groupe DA, dix genres associés dans le groupe acné et quatre genres associés dans le groupe lichen plan. Cependant, lorsque les résultats ont été corrigés pour tenir compte du taux de fausses découvertes, seul le lien de causalité entre le groupe Eubacterium fissicatena et le PSO est resté significatif. Concernant la validation croisée avec les premiers résultats, l’analyse par RM inversée n’a pas donné les mêmes résultats que l’analyse initiale. Les auteurs concluent que leurs résultats ont montré une relation de causalité entre le microbiote intestinal et les maladies cutanées immunitaires et apportent une nouvelle perspective thérapeutique pour l’étude des maladies immunitaires. Néanmoins, seul le groupe Eubacterium fissicatena a montré un lien significatif avec l’une des dermatoses étudiées.
Modifications longitudinales du microbiote intestinal dans le mélanome avancé traité par blocage des points de contrôle immunitaire
Le blocage des points de contrôle immunitaire (BCI) allonge la survie des patients souffrant de différents cancers à un stade avancé. Cependant, seul un sous-groupe de patients répond au BCI, phénomène qui pourrait être lié au microbiote intestinal, mais les études transversales conduites dans ce domaine donnent des résultats contradictoires. Des études longitudinales doivent donc être menées.
Dans cette étude, 175 patients ont été traités par BCI pour un mélanome avancé et le microbiome a été analysé par séquençage « shotgun » pendant les 12 premières semaines de traitement. En fin de compte, la survie sans progression (SSP) a été définie comme le délai écoulé entre l’immunothérapie initiale et la progression de la maladie ou le décès, et les patients présentant une SSP de 12 mois ou plus ont été comparés à ceux dont la SSP était inférieure à 12 mois.
Les résultats montrent que les patients présentant une SSP < 12 mois avaient une abondance supérieure de taxa associés à des maladies inflammatoires. Par contre, plusieurs taxa considérés comme « pro-inflammatoires » étaient enrichis chez les patients dont la SSP était ≥ 12 mois. Point intéressant, cinq taxa étaient systématiquement plus abondants chez les patients présentant une SSP ≥ 12 mois. En effet, le groupe A. butyriciproducens, I. bartlettii, Dorea sp. AF24 7LB, le groupe L. gasseri et L. celerecrescens étaient plus abondants en cas de SSP ≥ 12 mois, alors que quatre autres taxa étaient systématiquement plus abondants chez les patients dont la SSP était < 12 mois (R. lactatiformans, groupe R. non classé SGB15265, P. copri clade A et une espèce non identifiée
du phylum Bacteroidetes). Ensuite, les auteurs ont testé la généralisabilité des résultats à l’aide de six cohortes indépendantes de patients atteints de mélanome. Seule la cohorte comportant un nombre raisonnablement important de patients (N = 112) leur a permis de faire la distinction entre les patients présentant une SSP ≥ 12 mois et ceux avec une SSP < 12 mois.
Les auteurs concluent que leur étude met en évidence la nature dynamique du microbiote intestinal ainsi que le caractère essentiel du profilage longitudinal pour guider les interventions ciblant le microbiote en vue d’améliorer les résultats du traitement dans le mélanome avancé.
Les 1 000 premiers jours : une période cruciale pour le microbiote
Par le Dr. Marta Ardila Jimenez
Coordinatrice, service de pédiatrie et de néonatalogie,
Clínica de Marly Jorge Cavelier Gaviria, Bogota, Colombie,

Le microbiote était l’un des principaux protagonistes du 56e congrès de l’ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology and Nutrition), à Milan. Il y a en effet de plus en plus d’études conduites sur le sujet, motivées par l’impérative nécessité d’en apprendre chaque jour davantage. Nous vivons une nouvelle ère dans laquelle le microbiote joue un rôle fondamental dans nos efforts pour réduire la fréquence des maladies chez les générations futures. Mais en tant que médecins, comment pouvons-nous enseigner ces informations à nos patients pour prévenir les maladies chroniques ?
Dans le cadre des réflexions menées sur les stratégies qui pourraient influer sur l’évolution du poids des maladies pesant sur la population générale, de nombreux travaux ont montré que les 1 000 premiers jours de la vie sont une période critique, qui constitue une opportunité pour exercer un impact positif et prévenir le développement futur de maladies non transmissibles. Mais pourquoi cette période est-elle si importante ? En fait, cette période est fondamentale pour la colonisation intestinale et, par conséquent, pour l’établissement du microbiote. Un contrôle important est ainsi exercé sur la maturation intestinale et la programmation métabolique et immunologique. La colonisation microbienne du tube digestif est fondamentalement liée à la programmation métabolique et à la maturation immunologique, et les perturbations de la colonisation durant la petite enfance ont été associées à un risque accru de développer de multiples affections, notamment l’asthme, la dermatite atopique, les allergies alimentaires, le diabète, les maladies inflammatoires chroniques de l’intestin et l’obésité 1.
Dès le début de la phase embryonnaire, les processus de développement et de croissance sont déterminés non seulement par la charge génétique mais également par les facteurs environnementaux auxquels l’enfant va être exposé. Des mécanismes épigénétiques tels que la modification des histones, l’ARN non codant et la méthylation de l’ADN sont lourdement impactés par ces facteurs critiques, notamment la consommation de substances spécifiques, certains aliments et le stress excessif. Chaque étape de la croissance et du développement est cruciale pour déterminer les effets positifs que le microbiote peut avoir sur un patient, à la manière d’un puzzle où chaque pièce est indispensable.

Les études menées sur le microbiote pendant la période gestationnelle mettent en évidence des modifications de la composition microbiotique de la mère dans différentes parties du corps, notamment l’endomètre, le vagin et les intestins, pouvant même parfois provoquer des complications lors de la grossesse. Au cours du premier trimestre de la grossesse, la constitution du microbiote intestinal est similaire à celle d’une femme non enceinte en bonne santé 2. Durant le troisième trimestre, la diversité du microbiote augmente de manière exponentielle, entraînant une prise de poids, une insensibilité à l’insuline et une concentration plus élevée de cytokines foetales, se traduisant par une inflammation. On retrouvera également des taux plus importants de Bacteroides
et de Staphylococcus dans les selles des femmes enceintes en surpoids que chez celles de poids normal. La transmission verticale des bactéries de la mère au nouveau-né contribue au développement du microbiote dans le tractus intestinal et peut affecter le fonctionnement et la croissance de ce système immunitaire spécifique. Il y a des différences notables entre le microbiote de la mère et du nouveau-né lorsque celui-ci nait par césarienne ou par voie naturelle. Étonnamment, plusieurs études montrent que les enfants nés par césarienne ont davantage de risques de développer des troubles immunitaires tels que les allergies et l’asthme. C’est au moment du premier contact peau à peau que l’allaitement joue un rôle crucial pour apporter au nouveau-né les différents nutriments qui l’aideront à préserver son système immunitaire 3, 4.
L’introduction des aliments solides influe également sur la composition du microbiote intestinal. Chez les prématurés, le développement du microbiote intestinal est influencé par de multiples facteurs, notamment le délai écoulé depuis la naissance et la prise de lait maternel, et des interventions telles que la supplémentation en probiotiques et en prébiotiques montrent des résultats prometteurs pour réduire la morbi–mortalité dans cette population.
Avec une idée claire de l’impact de ces 1 000 premiers jours sur la vie d’adulte des nouveau-nés, notre mission sera de conduire des politiques publiques pour
renforcer le microbiote. Pour atteindre cet objectif, il nous faut prendre des mesures, notamment en renforçant la prise en charge des mères allaitantes, en incitant à la pratique de l’allaitement et surtout en informant tous nos patients sur les habitudes alimentaires saines à adopter.