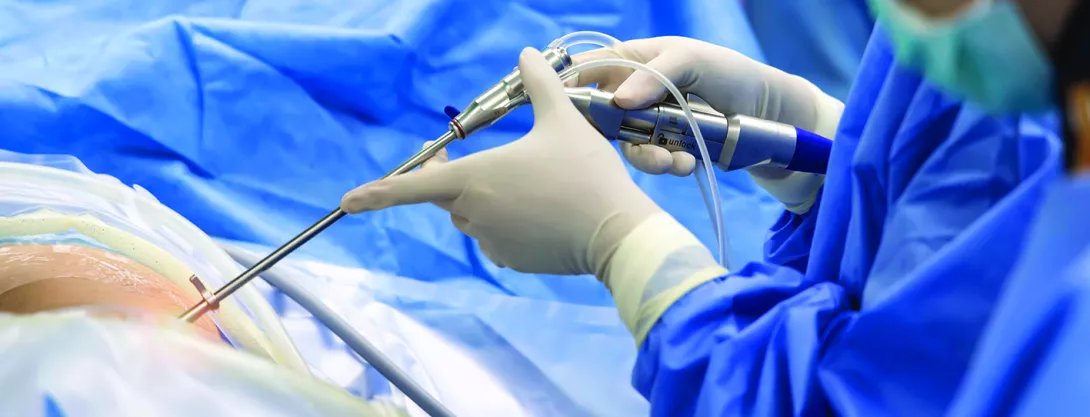
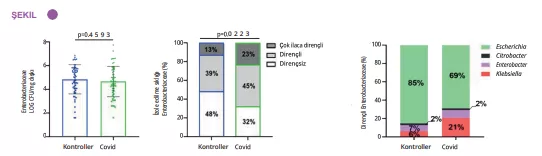
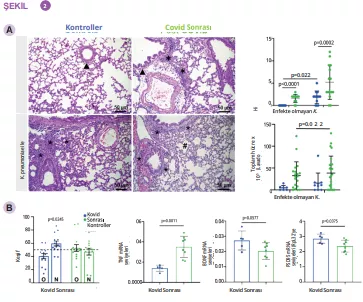
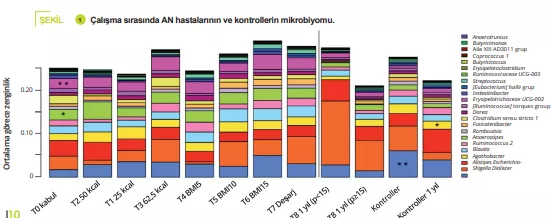
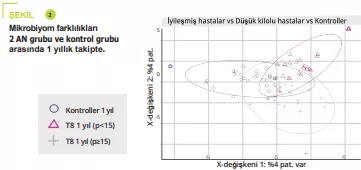
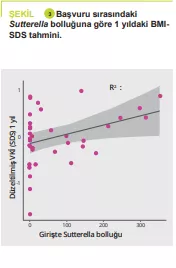
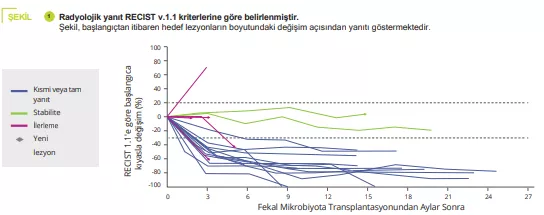
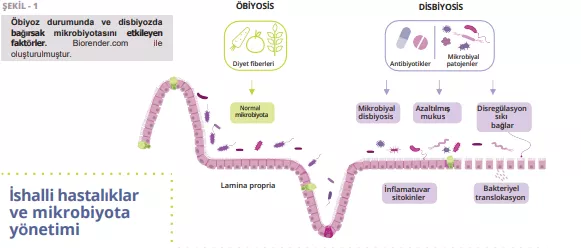
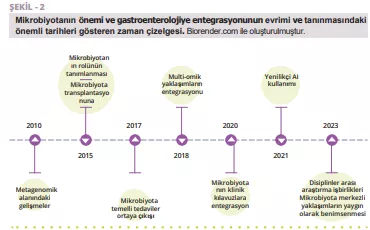
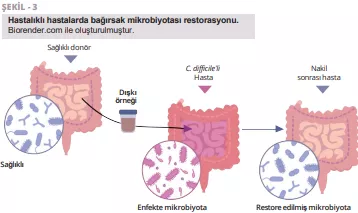
APDW özeti
Yazan: A/Pr. Dao Viet Hang, MD, PhD

Aralık 2023'te Bangkok'ta düzenlenen Asya Pasifik Sindirim Haftasına 60'tan fazla ülkeyi temsilen 3.000'den fazla hekim katıldı. Etkinlik, hepatoloji, endoskopi dahil olmak üzere çeşitli alanları kapsayan birçok güncel konferansla zengin ve çeşitli bir program sağladı, gastrointestinal (GI) hastalıklar ve motilite/cerrahi. Yeni yayınlanan kılavuzlarla ilgili derslerin yanı sıra, birçok yeni konu çeşitli formatlarla programa entegre edilmiştir - vaka bazlı tartışma ile interaktif oturumlar, farklı yönler ve yaklaşımlar üzerine tartışma oturumları, ve dünya çapında tanınmış panelistlerden açılış konuşmaları.
Gastrointestinal motilite ve fonksiyonel bozukluklar
Bu yılki etkinliğin en önemli noktalarından biri, fonksiyonel hastalıklara odaklanan GI motilitesine adanmış çok sayıda oturumdur. Açılış töreninde, Yerel Organizasyon Komitesi Başkanı Prof Somchai Leelakusolvong tarafından refrakter gastroözofageal reflü hastalığına (GÖRH) ilişkin bir güncelleme başkanlık konuşması olarak sunuldu. Prof Somchai, endoskopik bulgu kriterlerini Asya ülkelerinde daha pratik olan Los Angeles reflü özofajit derece B'yi içerecek şekilde genişleten Lyon konsensüs versiyon 2.0'ın önemini vurguladı. Etkinlikte ayrıca, çeşitli mekanizmalara dayalı refrakter GÖRH tedavisinin optimize edilmesine ilişkin birçok güncel veri de tanıtıldı. Alt özofagus sfinkter (LES) basıncını hedefleyen ilaçların kullanımı, özofagus kontraksiyonları, endoskopik müdahaleler ve elektrik stimülasyonu da dahil olmak üzere tedavi stratejilerindeki gelişmeler de vurgulandı. Geçici alt özofageal sfinkter gevşemeleri GÖRH'nin temel mekanizmalarından biri olarak kabul edilmiştir. Bu durum, istirahat LES basıncını artırarak baklofen ile iyileştirilebilir. Böylece reflü atakları azalır. Küçük bir hasta grubunda elde edilen ön veriler, elektrik stimülasyonunun LES basıncını iyileştirebileceğini göstermiştir; ancak bu müdahalenin gelecekte pratik olarak uygulanması hala tartışılmaktadır.
Etkinlikte ayrıca, hedef popülasyon erozif özofajit hastaları olmak üzere, farklı çalışmalarda proton pompası inhibitörleri (PPI) ve potasyum rekabetçi asit blokerleri (PKAB) arasındaki karşılaştırmaya büyük önem verilmiştir. Mevcut kanıtlar, kabul edilebilir yan etkilerle birlikte şiddetli erozif özofajit tedavisinde PPI'a kıyasla PKAB'ın daha yüksek bir etkinliğe sahip olduğunu göstermiştir.
En ilgi çekici oturumlardan biri, 8 Aralık' ta Prof Somchai Leelakusolvong ve Prof Kwang-Jae Lee başkanlığında düzenlenen "GÖRH hakkında her şey" oturumuydu. Bu oturumda öncelikli olarak modern Lyon konsensüsünün güncellemeleri, asit dışı reflü yönetimi ve fonksiyonel mide ekşimesi tedavisinin optimize edilmesi konularına odaklanıldı.
Tayvan'dan Dr. Ping-Huei Tseng, Los Angeles derece B özofajit için endoskopik bulgulardaki genişletilmiş kriterlere açıklık getirerek Lyon konsensüsü 2.0'ın ayrıntılı değişikliklerini sundu. Taklit özofagus bozukluklarını dışlamak ve düşük LES basıncı, hiatal herni veya zayıf özofagus kasılması gibi GÖRH risk faktörlerini belirlemek için yüksek çözünürlüklü manometrinin rolünü aydınlatmak adına vaka örnekleri ile açıklanmıştır. Ortalama nokturnal bazal empedans (MNBI) ve reflü sonrası yutma ilişkili peristalsis (PPSW) indeksi gibi 24 saatlik pH empedansı ile ilgili bazı umut verici ölçümler hala tartışılmaktadır ve daha fazla klinik veri gerektirmektedir.
Asit dışı reflü yönetimi için Hong Kong' dan Prof. Justin Wu, refrakter GÖRH tanımı ile refrakter GÖRH semptomları arasındaki farkları vurgulamıştır; bunlardan ikincisi çeşitli hastalıklardan kaynaklanabilir. Yüksek çözünürlüklü manometri (HRM), endoskopi ve 24 saatlik pH empedansının bu durumların tanı ve yönetimindeki rolleri ESNM/ASNM kılavuzunda ayrıntılı olarak açıklanmıştır. PPI kullanırken veya kullanmadan 24 saatlik pH empedansı uygulama kararı, önceden tanı konmamış hastalarda GÖRH'yi doğrulamak veya refrakter GÖRH'yi doğrulamak gibi tanısal amaca bağlıdır. Aşamalı bir değerlendirme yapmak yararlı olacaktır. Refrakter GÖRH hastaları için endoskopik girişimler veya cerrahi için en uygun zamanı belirlemek üzere aşamalı bir stratejiye sahip olmak faydalı olacaktır. Asit dışı reflü tedavisi, reflü ataklarının özellikleri, özofageal motilite paternleri ve örtüşen semptom-lar dahil olmak üzere olası mekanizmalar açısından kapsamlı bir şekilde değerlendirilmelidir. Ayrıca Prof Wu, Asya popülasyonu için GÖRH tanısında aside maruz kalma süresi (AET) için Lyon konsensüsü ile karşılaştırıldığında tartışmalı bir nokta olabilecek bir cut-off belirleme ihtiyacını vurgulamıştır.
Fonksiyonel mide yanması, diğer fonksiyonel gastrointestinal bozukluklarla benzerlik göstermesi, “bağırsak-beyin aksı” mekanizması kapsamında ruhsal bozukluklarla (anksiyete, depresyon, stres) birlikte görülmesi ve dışlama için kapsamlı testler gerektirmesi gibi çeşitli faktörler nedeniyle karmaşık bir durumdur. Son verilere göre, fonksiyonel semptomları olan hastaların %70'i normal endoskopik bulgulara sahipti. Bu popülasyonun %50'sinin 24 saatlik pH impedans sonuçları normaldi ve %60'ı semptomların ortaya çıkmasıyla korelasyon göstermedi, yani sadece %21'i fonksiyonel mide yanması olarak sınıflandırıldı. Bu nedenle PPI'ın yanı sıra nöromodülatörler de önemli bir rol oynamaktadır. Trisiklik antidepresanlar (TCA'lar) ve seçici serotonin alım inhibitörleri (SSRI'lar) fonksiyonel mide ekşimesi tedavisinde etkinlik göstermiştir. Ancak, potansiyel yan etkileri dikkatle değerlendirilmelidir. Önleme için, tedaviye düşük dozla başlanması ve tedavi sırasında takibin sürdürülmesi önerilir.
Endoskopide yapay zeka: ASPDE - WEO Sempozyu- munda Öne Çıkanlar
Yapay zeka (AI) da birçok davetli konuşmacının ilgi gösterdiği güncel bir konudur. APDW'nin son günü olan 9 Aralık'ta ASPDE, WEO ile birlikte “ASPDEWEO Uluslararası Klinik Sempozyumu Endoskopide Yapay Zeka: Asya Pasifik ve Dünyada Uygulama” başlıklı bir oturum düzenledi. Bu oturum Prof Hisao Tajiri, Prof Yuichi Mori ve Doç Dr. Nonthalee Pausawasdi tarafından yönetildi. Prof Yuichi Mori, WEO AI komitesine devam etmekte olan iki projeyi tanıtmak üzere ilk sunumu yaptı. Projelerden biri, endoskopistlerin ve hastaların endoskopide AI kullanımına ilişkin algılarını değerlendirmeyi amaçlayan uluslararası bir çalışmadır. Diğeri ise gerçek yaşamda AI'nın rolü üzerine uzun dönem bir çalışmadır. WEO AI komitesi, doğruluk, maliyet etkinliği, doktormakine etkileşimleri, eğitim programları ve etik hususlar gibi farklı yönleri göz önünde bulundurarak AI'nin kliniklerde kullanımını araştırmaktadır.
Prof Han-Mo Chiu, Prof Rungsun Rerknimitr ve Prof Kherk-Yu (Lawrence) Ho, kolorektal kanser taraması, mide kanseri taraması ve biliyer endoskopi dahil olmak üzere çeşitli alanlarda AI'nin geliştirilmesi ve etkili bir şekilde kullanılması üzerine farklı konular sundu. Sunumlar, klinisyenlere ve endoskopistlere yakın gelecekte AI uygulamayı düşünmeleri için ilham veren birçok güncel veri gösterdi.
Doç Dr. Dao Viet Hang, özellikle kısıtlı kaynaklara sahip ortamlarda endoskopi eğitiminde AI kullanımının bir başka yönünü sundu. Endoskopi eğitiminde minimum vaka sayısına veya uygulama süresine dayanan geleneksel ölçütlerin, becerileri ve zaman içindeki kişisel gelişimi yansıtmadığını ve daha etkileşimli bir yaklaşım gerektirdiğini vurguladı. E-öğrenme eğitim programları ve simülasyonla entegre faaliyetler, genç endoskopistlerin bilgi ve lezyon tespit becerilerini geliştirmede umut verici sonuçlar göstermiştir. Şimdiye kadar AI, klinik uygulamada giderek daha fazla veri ile lezyon tespitini iyileştirme konusunda umut verici sonuçlar sergilemiştir; ancak endoskopi eğitimine entegrasyonu hala eksiktir. Endoskopi eğitiminde AI uygulamak için bazı temel hususlar arasında ekonomik fizibilite, güvenlik ve hesap verebilirlik, teknik endişeler ve doğrulama ve klinisyenlerin dijitalleşmedeki rolü yer almaktadır. Bu çerçevede, endoskopi eğitiminde AI'nın benimsenmesinin kullanıcı faktörlerini, teknoloji faktörlerini, sosyal faktörleri ve bağlamsal faktörleri (eğitim ortamı ve standartlar) dengelemesi gerektiği öne sürülmüştür. Eğitim ihtiyaçlarının ana hatlarını belirlemek ve Al'ın teknoloji seçimini bilgilendirmek için net eğitim hedefleri oluşturmak adına bir ihtiyaç değerlendirmesi gereklidir. Al, en iyi kanıtlara dayanarak ve bir müfredat dahilinde hem kursiyerler hem de eğitmenler için kullanıcı eğitimini de içerecek şekilde eğitime entegre edilmelidir.
Bu çerçevede, endoskopi eğitiminde AI'nın benimsenmesinin kullanıcı faktörlerini, teknoloji faktörlerini, sosyal faktörleri ve bağlamsal faktörleri (eğitim ortamı ve standartlar) dengelemesi gerektiği öne sürülmüştür. Eğitim ihtiyaçlarının ana hatlarını belirlemek ve Al'ın teknoloji seçimini bilgilendirmek için net eğitim hedefleri oluşturmak adına bir ihtiyaç değerlendirmesi gereklidir. Al, en iyi kanıtlara dayanarak ve bir müfredat dahilinde hem kursiyerler hem de eğitmenler için kullanıcı eğitimini de içerecek şekilde eğitime entegre edilmelidir.