ЧТО МЫ УЖЕ ЗНАЕМ?
Грудное молоко (ГМ) признано лучшим вариантом для кормления младенцев, особенно с очень низкой массой тела при рождении (ОНМТ), т. е. <1250 г. В отделениях интенсивной терапии, когда грудное вскармливание невозможно, рекомендуется использовать пастеризованное человеческое грудное молоко (ПЧГМ) из банка грудного молока. ГМ или ПЧГМ часто требуют обогащения для обеспечения оптимального роста. Для этого обычно используют обогатители на основе коровьего молока (BMBF); однако в последнее время появилась альтернатива в виде обогатителей на основе человеческого молока (HMBF). У детей с ОНМТ присутствуют нарушения со стороны микробиоты кишечника. Пока неизвестно, как можно улучшить состав микробиоты кишечника с помощью пищевых добавок, используемых у детей с ОНМТ.
Необходимы клинические исследования, чтобы определить влияние различных обогатителей грудного молока на кишечную микробиоту младенцев с ОНМТ.
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
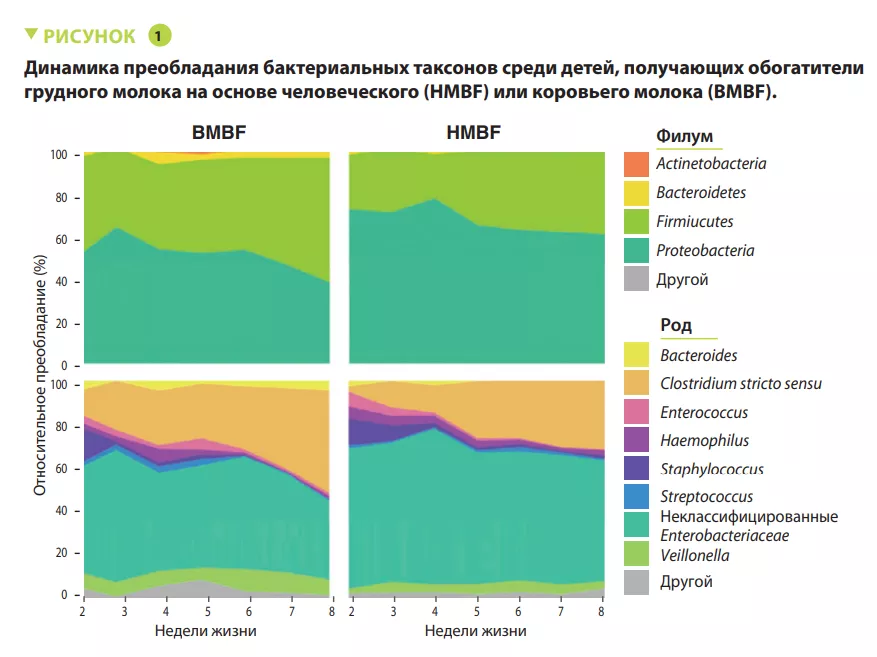
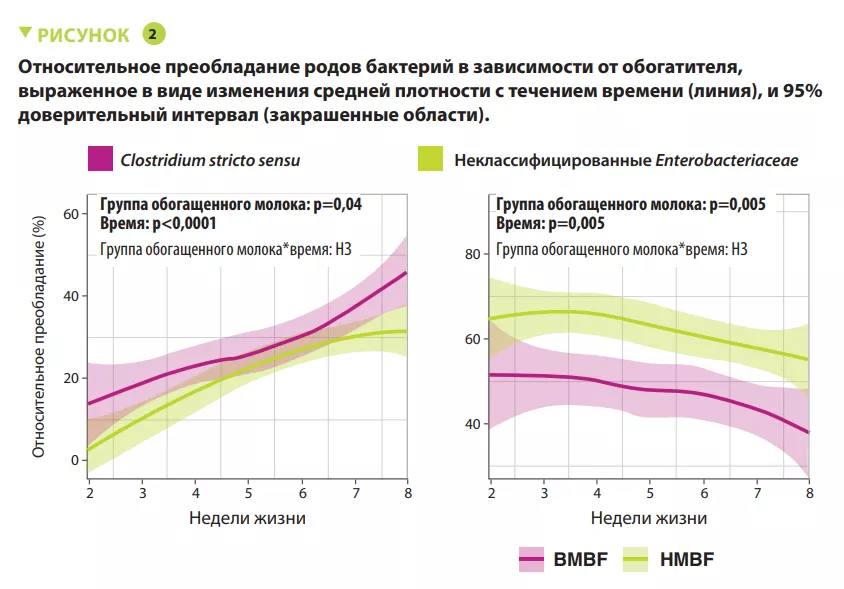
В рандомизированное контролируемое исследование OptiMom было включено 119 младенцев с массой тела при рождении <1250 г (56 в группе BMBF и 63 в группе HMBF). Медиана срока беременности и масса тела при рождении составили 880 г и 27,9 недели, без различий по любому из параметров между двумя группами. Младенцы в группе HMBF имели меньшее микробное разнообразие (индекс Шеннона) (p < 0,005). Преобладание Proteobacteria и Firmicutes было отмечено в обеих группах, с более высокой относительной распространенностью Proteobacteria (p = 0,0003), включая неклассифицированные Enterobacteriaceae (p = 0,005), и более низкой распространенностью Firmicutes (p = 0,001), включая Clostridium stricto sensu (p = 0,04) в группе HMBF по сравнению с группой BMBF (рисунок 1). Количество бактерий неуклонно возрастало с течением времени в группе BMBF, но мало изменялось в группе HMBF (p = 0,03). У младенцев в группе BMBF отмечалось более высокое относительное преобладание Clostridium stricto sensu (р = 0,04) и более низкое — неклассифицированных Enterobacteriaceae (р = 0,005) по сравнению с группой HMBF (рисунок 2). После нормализации численности таксонов появились другие различия на уровне рода, включая более высокое содержание неклассифицированных Eubacteriaceae (р < 0,0001), Streptococcus (р = 0,0002) и Staphylococcus (р = 0,002) и более низкое — Clostridium stricto sensu (р = 0,04) у младенцев группы HMBF по сравнению с группой BMBF. Эти изменения численности бактерий ассоциировались с изменениями микробной функции. Наконец, можно было предсказать тип обогатителя на основании микробного преобладания в каловых массах.
Авторов также интересовало влияние объема молока. В обеих группах потребление больших объемов ГМ в течение трех дней ассоциировалось с более высоким альфаразнообразием, но не общей плотностью бактерий. На фоне потребления больших объемов ГМ наблюдалось более высокое относительное и нормализованное преобладание Veillonella в обеих группах и Streptococcus в группе BMBF. Была отмечена положительная связь между объемами ГМ и концентрацией Staphylococсus в группе HMBF, неклассифицированными Eubacteriaceae в группе BMBF. Объемы ПЧГМ ассоциировались только с более высоким разнообразием в группе BMBF и плотностью бактерий. Сходным образом были отмечены меньшее относительное и стандартизированное содержание неклассифицированных Eubacteriaceae, Streptococcus и более высокое содержание Clostridium stricto sensu у младенцев в группе BMBF с более высокими объемами потребления ПЧГМ.
Более высокие объемы потребления ПЧГМ положительно коррелировали с бактериальным разнообразием и плотностью в группе BMBF, но не в группе HMBF. Объемы потребления BMBF положительно коррелировали с относительным и стандартизированным преобладанием Firmicutes и Clostridium stricto sensu, а объемы потребления HMBF положительно коррелировали с относительным и стандартизированным преобладанием Clostridium stricto sensu и отрицательно — со Staphylococcus.
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Это исследование показывает важность понимания того, как различные виды пищи влияют на кишечную микробиоту детей с ОНМТ, и состояние их здоровья в к р а т к о с р о ч н о й и д о л г о с р о ч н о й перспективе.