ВЛИЯНИЕ БЕЗАЛКОГОЛЬНОГО И ТРАДИЦИОННОГО ПИВА НА МИКРОБИОТУ КИШЕЧНИКА
Проф. Бернд Шнабль (Bernd Schnabl)
Отделение гастроэнтерологии, Исследовательский центр заболеваний пищеварительной системы Сан-Диего (SDDRC), Калифорнийский университет в Сан-Диего, США

Алкоголь влияет на микробиоту кишечника. Употребление его в большом количестве (например, более 2 бокалов в день для мужчин и более 1 бокала в день для женщин) негативно сказывается на микробиоте кишечника, сопровождаясь уменьшением бактериального разнообразия и увеличением количества потенциально вредных микроорганизмов. Однако влияние умеренного потребления алкоголя на микробиоту кишечника изучено мало.
Как вы думаете, увеличивает ли безалк ольное и алк ольное пиво разнообразие микробиоты кишечника, которое полезно для здоровья? Означает ли это, что можно рекомендовать пациентам выпивать по 330 мл пива ежедневно?
В недавнем рандомизированном клиническом исследовании изучали влияние ежедневного употребления обычного (содержание алкоголя 5,2%) или безалкогольного (0,0%) пива (330 мл в день) в течение 4-недельного периода [1]. В нем приняли участие 22 добровольца (здоровые мужчины), у которых оценивали характеристики фекальной микробиоты. Через 4 недели в обеих группах отмечалось увеличение бактериального разнообразия по сравнению с исходным уровнем. Однако характеристики разнообразия не различались между участниками, потребляющими алкогольное или безалкогольное пиво. Поскольку единственным, что отличало два напитка, было содержание алкоголя, их влияние на микробиоту следует объяснять другими веществами. Биологически активные соединения, такие как полифенолы и фенольные кислоты, содержащиеся в пиве, могут приносить пользу благодаря увеличению бактериального разнообразия. Некоторые из этих биологически активных соединений образуются в процессе пивоварения или происходят из хмеля или солода. Известно, что бактерии в нашем кишечнике метаболизируют компоненты пищи и могут использовать их для собственного метаболизма. Необходимы дополнительные исследования для определения влияния этих биологически активных соединений на кишечные бактерии. В идеале такие исследования должны проводиться на большем количестве участников, ранее не употреблявших алкоголь.
Прежде чем рекомендовать ежедневное употребление пива, следует досконально изучить вопрос. Лучше отдавать предпочтение безалкогольному пиву, так как употребление алкоголя даже в малых количествах вредит здоровью.
Ежедневное употребление безалкогольного или алкогольного пива в течение 4 недель не вы зывало увеличения массы тела и содержания жира в организме и не влияло на кардиометаболические биомаркеры сыворотки. Как это объяснить?
Результаты сравнения показателей 9 участников в группе безалкогольного пива и 10 участников в группе алкогольного пива не показали различий в функции печени, воспалительных или метаболических маркерах. Можно выделить ряд причин, по которым увеличение бактериального разнообразия не приводит к улучшению этих маркеров. Продолжительность исследования могла быть слишком короткой, а количество участников в каждой группе — слишком маленьким. Хотя все участники обеих групп имели избыточный вес, большинство других маркеров находилось в пределах нормы. Поэтому было бы интересно оценить эффекты у пациентов с метаболическим синдромом с точки зрения влияния уменьшения дисбиоза кишечника и увеличения бактериального разнообразия на улучшение метаболических параметров.
КИШЕЧНАЯ МИКРОБИОТА #17
Проф. Сату Пеккала (Satu Pekkala)
Научный сотрудник Академии Финляндии, Факультет спорта и здравоохранения, Университет Ювяскюля, Финляндия

СВЯЗЬ МИКРОБИОТЫ ЖЕЛУДОЧНОКИШЕЧНОГО ТРАКТА И ДИНАМИКИ МЕТАБОЛОМА С КЛИНИЧЕСКИМИ ИСХОДАМИ ПРИ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У ДЕТЕЙ
Трансплантация гемопоэтических стволовых клеток (ТГСК) используется для лечения многих заболеваний. Реакция «трансплантат против хозяина» и инфекции, которые могут развиться после ТГСК, являются основными причинами смерти таких пациентов. На данный момент мы мало знаем о роли микробиоты кишечника (МК) в развитии неблагоприятных исходов у детей после ТГСК. В продольном исследовании Vaitkute и соавт. изучили связь МК и фекального метаболома с клиническими исходами у 64 детей после ТГСК (длительность пребывания в стационаре ~66 дней). После ТГСК отмечалось уменьшение альфаразнообразия МК. Изменялся состав МК, при этом микробиота большинства пациентов не возвращалась к своему первоначальному составу. Авторы сгруппировали КМ по типам сообществ (ТС). Первый тип обычно выявлялся до ТГСК и характеризовался преобладанием Clostridium XIVa, Bacteroides и Lachnospiraceae. Этот тип ассоциировался с отсутствием полного парентерального питания. Второй тип был распространен после ТГСК, характеризовался преобладанием Streptococcus и Staphylococcus и ассоциировался с применением ванкомицина и метронидазола. Третий тип также был распространен после ТГСК, но характеризовался преобладанием Enterococcus, Enterobacteriaceae и Escherichia, а также ассоциировался с более высокой вероятностью виремии, полного парентерального питания и применения различных противомикробных препаратов. Метаболомические анализы показали ассоциацию между содержанием фекального бутирата на исходном уровне и более низким риском виремии. Со временем после ТГСК отмечалось уменьшение содержания ацетата и бутирата и увеличение содержания глюкозы. Выявленные таксоны и метаболиты КМ могут быть полезными биомаркерами для прогнозирования риска осложнений после ТГСК. Однако необходимы более крупные продольные исследования.
ПРОСПЕКТИВНОЕ ИССЛЕДОВАНИЕ МИКРОБИОМА КИШЕЧНИКА МЛАДЕНЦЕВ В КОНТЕКСТЕ ОТВЕТА НА ВАКЦИНАЦИЮ
Формирование микробиоты кишечника (МК) в раннем возрасте имеет важное значение для развития иммунной системы. Кроме того, МК способствует развитию иммунного ответа на введение вакцин, например, против полиомиелита. Тем не менее, исследований в этой области все еще очень мало. Moroishi и соавт. провели исследование с участием 83 младенцев, у которых изучили состав и функции МК в первые 6 недель жизни, которые соотнесли с характеристиками гуморального ответа на капсульный полисахарид пневмококка (КПК) и столбнячный анатоксин (СА) в 1-летнем возрасте. Анализ PERMANOVA парных образцов МК показал слабую связь с гуморальным ответом на КПК и СА. Проведя метагеномный анализ, авторы обнаружили отрицательную связь между ответом на СА и Aeriscardovia aeriphila, и положительную — с Staphylococcus aureus, Escherichia coli, Streptococcus thermophilus и Anaerococcus vaginalis. Тем не менее, только связь с A. aeriphila осталась значимой после коррекции с учетом ложных отклонений. Менее выраженный ответ на вакцины с КПК ассоциировался с девятью путями, такими как биосинтез фенилаланина и пиримидиновых дезоксирибонуклеотидов de novo. Напротив, биосинтез пантотената и кофермента А, деградация пиримидиновых рибонуклеозидов, деградация метилфосфоната и пути биосинтеза пиримидиновых рибонуклеотидов de novo были связаны с более высоким ответом на КПК. Пять путей были положительно связаны с ответом на СА, в частности биосинтез ЦДФдиацилглицерола. Таким образом, A. aeriphila может быть использована в качестве биомаркера ответа на СА. Кроме того, функции МК в раннем возрасте могут влиять на результаты вакцинации.
РЕЗУЛЬТАТЫ МЕТААНАЛИЗА ИССЛЕДОВАНИЙ МИКРОБИОТЫ СЛИЗИСТЫХ ОБОЛОЧЕК ВЫЯВИЛИ УНИВЕРСАЛЬНЫЕ МИКРОБНЫЕ СИГНАТУРЫ И ДИСБИОЗ ПРИ КАНЦЕРОГЕНЕЗЕ В ЖЕЛУДКЕ
Рак желудка (РЖ) является 4-й по значимости причиной смерти от онкологических заболеваний. Стадии развития РЖ включают поверхностный гастрит (ПГ), атрофический гастрит (АГ), кишечную метаплазию (КМ), дисплазию и собственно рак. Известно, что инфекция, вызванная Helicobacter pylori, вовлечена в развитие РЖ за счет уменьшения секреции соляной кислоты, способствуя чрезмерному росту микробов, не относящихся к H. pylori. Исследования связей между микробиотой желудка и РЖ давали противоречивые результаты. Liu и соавт. провели метаанализ шести независимых исследований микробиоты желудка для выявления микробных сигнатур при РЖ. Альфа-разнообразие было ниже при РЖ, чем при ПГ, АГ и КМ. Veillonella, Dialister, Granulicatella, Herbaspirillum, Comamonas, Chryseobacterium, Shewanella и Helicobacter были впервые идентифицированы в этом исследовании как универсальные биомаркеры, отличающие РЖ от ПГ. Кроме того, оппортунистические патобионты Fusobacterium, Parvimonas, Veillonella, Prevotella и Peptostreptococcus были более распространены при РЖ, чем при ПГ. Преобладание Bifidobacterium, Bacillus и Blautia, напротив, было ниже. Микробные функции оценивали с помощью PICRUSt2. По сравнению с ПГ, наиболее активными метаболическими путями при РЖ были биосинтез и созревание пептидогликанов. Наименее активным путем при РЖ был специфический для Helicobacter цикл трикарбоновых кислот, что согласуется с очень низким преобладанием Helicobacter у пациентов с РЖ. Авторы также предполагают, что Helicobacter влияет на микробиоту желудка, поскольку у H. pylori-отрицательных пациентов отмечалось более высокое микробное разнообразие, чем у H. pylori-положительных. Таким образом, микробиом желудка может быть биомаркером, который позволяет различать пациентов по стадиям заболевания.
ОСНОВНЫЕ НОВОСТИ UEGW
Д-р Лукас Уотерс (Lucas Wauters)
Отделение гастроэнтерологии и гепатологии, университетские больницы Левена, Левен, Бельгия
Впервые за последние 2 года конгресс UEG Week 2022 прошел в Вене в очном и гибридном форматах. Участие приняли более 10 000 человек, из которых 19% — в режиме онлайн. По мнению участников, мероприятие стало крупнейшим в Европе и «лучшим гастроэнтерологическим конгрессом в мире». Многие доклады были посвящены микробиому, в этой статье собраны некоторые из них.
ВЗГЛЯД НА ЗДОРОВЫЙ МИКРОБИОМ
Несмотря на ограничения по времени в последний день, многие проявили интерес к популярной сессии «Микробиом как модулятор функции кишечника», во многом благодаря выбору докладчиков. Под председательством проф. Гарри Сокола (Париж, Франция) и проф. Тима Вануйцеля (Лёвен, Бельгия), первая лекция проф. Йерун Раес из Центра микробиологии VIB (Лёвен, Бельгия) была посвящена здоровому микробиому кишечника. Знание нормальных вариаций микробиоты важно для точной диагностики, однако даже сейчас мы не знаем, что такое здоровая микрофлора. Результаты популяционного анализа кишечной флоры жителей Фландрии показали, что менее 10% случаев вариации микробиоты можно объяснить внутренними и внешними факторами [1]. Многие оценки этого анализа были представлены в голландском проекте по изучению микробиома, данные которого недавно подтвердили важные эффекты окружающей среды и социальных факторов [2].
Помимо высокой межиндивидуальной вариабельности, были получены данные о значительных внутрииндивидуальных вариациях количественного присутствия микробных родов [3]. Время кишечного транзита — не только основной фактор, влияющий на состав микробиоты, но и движущая сила временных изменений микробиоты у здоровых людей. С позиций учения об энтеротипах (относительно стабильные микробные сообщества), докладчик привел много данных о дисбиотической природе недавно выделенного В2-энтеротипа, для которого характерно высокое содержание Bacteroides и низкая микробная нагрузка. Помимо диагностического значения этого маркера при различных заболеваниях, он представил удивительные данные о модулирующем влиянии статинов на микробиом. В заключении, автор подчеркнул необходимость дополнительной работы по изучению экологии микроорганизмов in vitro , поскольку идентификация и выделение видов и их взаимодействий имеют решающее значение длясовершенствования методов лечения, основанных на применении пробиотиков и трансплантации фекальной микробиоты (ТФМ).
АКЦЕНТ НА МИКРОБНЫХ ШТАММАХ И МЕТАБОЛИТАХ
В качестве альтернативы исследованиям in vitro итальянские ученые сообщили о возможностях усовершенствованных методов метагеномики в идентификации подтипов видов микроорганизмов в контексте ТФМ. Один из тезисов на сессии «Кишечный микробиом как звено патогенеза и мишень для лечения заболеваний» был посвящен вопросам приживления и обмена штаммами у доноров и реципиентов в контексте ТФМ при различных заболеваниях. Интересно, что клинический успех ТФМ ассоциировался с приживлением большего количества донорских штаммов и еще больше возрастал при нескольких путях доставки, а также после антибиотикотерапии инфекционных заболеваний [4]. Исходя из этих результатов, в будущем отбор доноров и разработка специфических протоколов для различных заболеваний может позволить не только оптимизировать состав микробиоты, но и улучшить результаты ТФМ.
На основной сессии по микробиому проф. Николя Сенак (Nicolas Cenac) (Тулуза, Франция) подробно описал роль бактериальных липопептидов при синдроме раздраженного кишечника (СРК) , одном из наиболее частых желудочно-кишечных расстройств. После открытия анальгезирующих свойств этих метаболитов его группа изучила связь между дисбиозом на фоне стресса во время беременности и развитием висцеральной гиперчувствительности (ВГЧ) толстой кишки, которая характерна для СРК. У мышей пренатальный стресс может вызывать симптомы, подобные таковым при СРК и ассоциирующиеся с ВГЧ, наряду с низким содержанием Ligilactobacillus murinus. Это сопровождается уменьшением выработки липопептидов, содержащих γ-аминомасляную кислоту (ГАМК), введение которых в толстую кишку купирует симптомы ВГЧ. Пр. Сенак отметил необходимость изучения данного вопроса у человека и привел данные о выявлении более низких концентраций ГАМК-липопептидов в кале пациентов с СРК. Таким образом, микробные метаболиты стали новым интересным объектом изучения при СРК и после конгресса по этой теме появилось много публикаций [5].
МИКРОБИОМ, СРЕДИЗЕМНОМОРСКАЯ ДИЕТА И ИММУНОТЕРАПИЯ
Важные тезисы UEG Week касались потенциальных факторов, улучшающих результаты иммунотерапии при злокачественном новообразовании кожи — меланоме. Д-р Йоханнес Р. Бьорк (Johannes R. Björk) (Гронинген, Нидерланды) представил данные об изменении микробиома кишечника в ответ на иммунотерапию. На правах одного из лауреатов конкурса аннотаций, он начал вторую часть вступительной сессии с доклада о микробных биомаркерах кишечника, позволяющих предсказать ответ на лечение до его начала. Однако он уточнил, что динамика микробиоты в течение курса лечения до сих пор не изучена. В рамках многоцентрового когортного исследования был выполнен продольный анализ последовательно забираемых образцов стула, показавший у пациентов с ответом на лечение увеличение содержания видов из семейства Lachnospiraceae, в то время как у тех, кто не ответил на лечение, в кишечнике было больше видов из с е мейств а Bacteroides. В будущем на основе этих данных могут быть созданы новые подходы к направленной терапии (например, ТФМ), а изучение микробиоты у пациентов с колитом на фоне иммунотерапии может выявить новые диагностические маркеры. Интересно, что увеличение содержания продуцентов бутирата у пациентов, ответивших на лечение, указывает, что в этом могут быть задействованы процессы деградации пищевых волокон. Поэтому те же группы исследователей из Нидерландов и Великобритании провели дополнительный анализ с целью изучения роли питания. Они показали, что пациенты, ответившие на иммунотерапию, чаще придерживались средиземноморской диеты с высоким содержанием мононенасыщенных жирных кислот, полифенолов и клетчатки. Кроме того, употребление цельнозерновых или бобовых продуктов ассоциировалось с меньшей частотой иммуноопосредованных побочных эффектов, чем употребление красного и обработанного мяса. Будущие клинические исследования покажут, можно ли это использовать для улучшения результатов лечения различных типов опухолей, включая новообразования желудочно-кишечного тракта.
В заключение, важные и новые данные о микробных штаммах, метаболитах и роли диеты расширили знания о микробиоме кишечника в условиях заболеваний, а также действия различных вмешивающихся факторов (даже в здоровом микробиоме).
1. Falony G, Joossens M, Vieira-Silva S, et al. Population-level analysis of gut microbiome variation. Science (80) 2016; 352: 560-4.
2. Gacesa R, Kurilshikov A, Vich Vila A, et al. Environmental factors shaping the gut microbiome in a Dutch population. Nature 2022; 604: 732-9.
3. Vandeputte D, De Commer L, Tito RY, et al. Temporal variability in quantitative human gut microbiome profiles and implications for clinical research. Nat Commun 2021; 12.
4. Ianiro G, Punčochář M, Karcher N, et al. Variability of strain engraftment and predictability of microbiome composition after fecal microbiota transplantation across different diseases. Nat Med 2022; 28.
5. Petitfils C, Maurel S, Payros G, et al. Identification of bacterial lipopeptides as key players in IBS. Gut 2022; Online ahead of print.
ОСЬ КИШЕЧНИК — ГОЛОВНОЙ МОЗГ
Проф. Саркис К. Мазманян, Джон В. Бостик, Надя Сурьявината (Sarkis K. Mazmanian, John W. Bostick, Nadia Suryawinata)
Кафедра биологии и биоинженерии, Калифорнийский технологический институт, Пасадена, Калифорния, США
Комментарии к статье Gabanyi и соавт. Science 2022 [1]
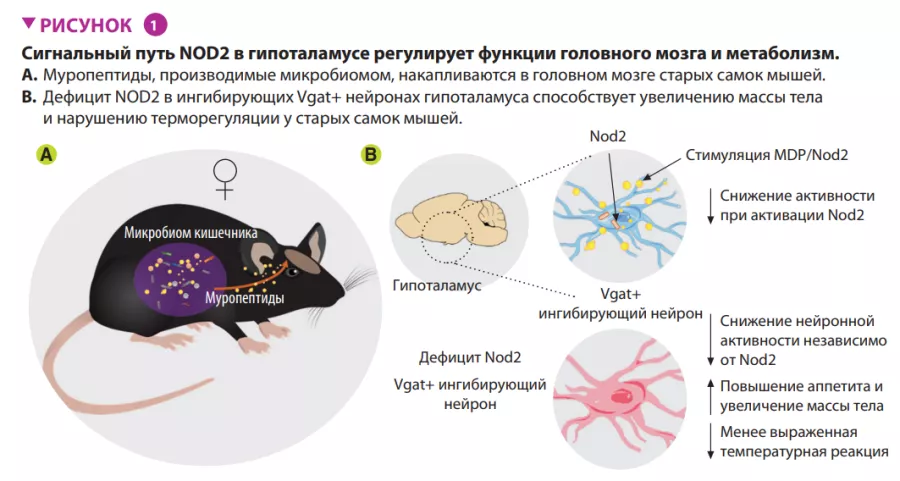
Микробиота влияет на метаболизм, и недавно было показано влияние кишечных бактерий на пищевое поведение мышей. Задача в этой области — определить сигнальные пути между кишечником и мозгом, которые связывают микробные соединения с нейронными процессами, влияющими на аппетит. Gabanyi и его коллеги определили функциональную роль Nod2, паттерн-распознающего рецептора бактериальных муропептидов и компонентов бактериальной клеточной стенки, в регуляции аппетита и терморегуляции у старых самок мышей. Обнаружено, что в головном мозге старых мышей накапливаются муропептиды, которые регулируют активность ингибирующих нейронов дугообразного ядра гипоталамуса. Индуцированный дефицит Nod2 в этих нейронах вызывает увеличение аппетита, повышение массы и снижение температуры тела зависимым от микробиоты образом. Это означает, что регулирование активности нейронов с помощью передачи сигналов Nod2 в мозге может влиять на сложные виды поведения у мышей, что требует дальнейших исследований.
ЧТО МЫ УЖЕ ЗНАЕМ?
Питание необходимо для выживания животных, а неправильное пищевое поведение ведет к серьезным метаболическим и психическим нарушениям, таким как ожирение и анорексия. Питание включает в себя сложные процессы, начиная от переработки и всасывания питательных веществ в кишечнике, заканчивая процессами в центральной нервной системе, которые регулируют аппетит и пищевое поведение. Внимание в области биологии аппетита сосредоточено на изучении нейронных цепей, участвующих в формировании пищевого поведения, например, нейронов, экспрессирующих агути-подобныйпептид (AgRP) в дугообразном ядре гипоталамуса, которые необходимы для поддержания пищевого гомеостаза [3]. Совсем недавно было показано, что кишечник и его резидентная микрофлора способны регулировать метаболизм [4] и различные аспекты пищевого поведения [5]. Однако вопрос о том, влияют ли соединения, продуцируемые микробами, на аппетит, остается открытым. Короткоцепочечные жирные кислоты, как побочный продукт микробной ферментации, уменьшают потребление пищи у мышей [6].
Однако, ранее не было известно о существовании сигнального пути «кишечник — головной мозг», который связывает микробные соединения с нейронными процессами, регулирующими аппетит и пищевое поведение. Предполагается участие рецептора распознавания микробных паттернов Nod2 в формировании пищевого поведения, поскольку у мышей, нокаутных по Nod2, отмечается ускоренный набор массы тела при кормлении пищей с высоким содержанием жиров [7]. Кроме того, один из компонентов сигнального пути Nod2, ядерный фактор kB (NFkB), экспрессируется в нейронах гипоталамуса, выступая в качестве регулятора энергетического баланса [8]. Можно предположить, что гипоталамус представляет собой уникальный «процессор», интегрирующий сигналы, поступающие от микробиома, и пищевые сигналы.
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
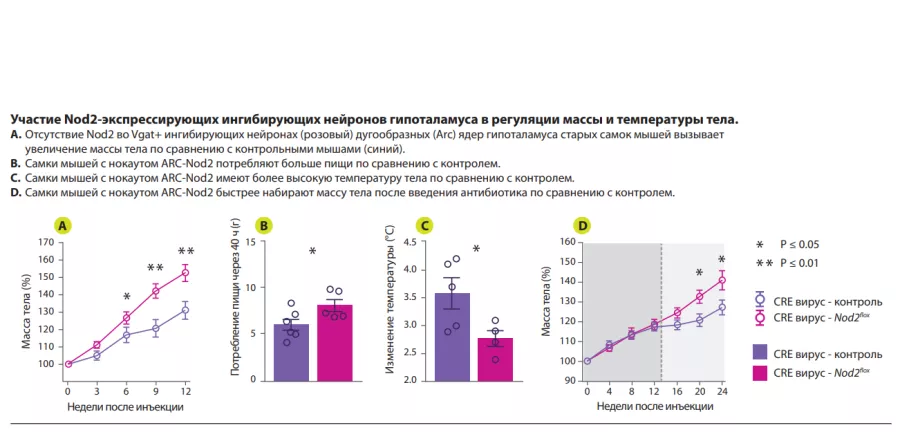
Авторы показали, что активация сигнального пути Nod2 в гипоталамусе влияет на пищевое поведение и терморегуляцию у мышей (рисунок 1). Nod2 экспрессируется в нейронах различных областей мозга мыши, включая полосатое тело, таламус и гипоталамус. Затем авторы изучили проникновение радиоактивно меченных муропептидов в головной мозг в зависимости от их способа поступления в организм: непосредственно с пищей или из радиоактивно меченных бактерий. В обоих случаях происходило накопление муропептидов в головном мозге. Результаты изучения функций Nod2 в нейронах на стандартной модели нокаутных (по Nod2) мышей, показали, что у старых самок мышей с отсутствием Nod2 в ингибирующих нейронах, экспрессирующих везикулярный транспортер ГАМК (Vgat/ Slc32a1), наблюдалось увеличение массы тела и нарушение терморегуляции. Измерения экспрессии Fos в головном мозге старых самок мышей показали более высокую активность нейронов дугообразных и дорсомедиальных ядер гипоталамуса. Вводя Cre-экспрессирующие аденоассоциированные вирусы (AAV) мышам с флоксированным геном Nod2, чтобы локально подавить экспрессию Nod2 в ингибирующих нейронах дугообразного ядра гипоталамуса, авторы показали, что дефицита Nod2 в гипоталамических нейронах достаточно, чтобы вызвать изменения массы тела и нарушения терморегуляции (рисунок 2).
Наконец, чтобы изучить роль микробиоты в Nod2-зависимых механизмах регуляции аппетита и температуры тела, мышам с избирательным отсутствием Nod2 в нейронах гипоталамуса вводили антибиотики широкого спектра действия. На фоне получения антибиотика мыши с дефицитом Nod2 в гипоталамусе демонстрировали нормальные аппетит и профиль набора массы тела. После прекращения введения антибиотика у этих же мышей отмечались повышенный аппетит и ускоренный набор массы тела по сравнению с контрольными животными с нормальным содержанием Nod2. Эти данные указывают на способность микробных продуктов модулировать аппетит у самок мышей посредством Nod2- зависимого механизма.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Nod2 экспрессируется в нейронах различных областей мозга мыши, включая полосатое тело, таламус и гипоталамус
- Лиганды Nod2, такие как муропептиды, накапливаются в мозге стареющих мышей
- Активность гипоталамических ингибирующих нейронов регулируется экспрессией Nod2
- У старых самок мышей с дефицитом Nod2 нарушается регуляция аппетита и температуры тела
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Gabanyi и соавт. определили функциональную роль экспрессии Nod2 в нейронах гипоталамуса в регулировании аппетита и температуры тела у стареющих самок мышей, но не у самцов. Клеточные и молекулярные механизмы, определяющие эти эффекты, еще предстоит выяснить. Половые различия в составе микробиома могут играть роль в различиях в ответ на дефицит Nod2 в нейронах; однако авторы не исследовали состав микроорганизмов. Кроме того, помимо муропептидов, другие микробные продукты и эндогенные стимулы, которые не рассматривались в этом исследовании, могут регулировать экспрессию или активацию Nod2 [9]. Необходимы дополнительные данные, чтобы отличить активность и вклад этих альтернативных стимулов от таковых муропептидов. Другие возможные факторы, вызывающие эффекты, описанные в статье, могут включать увеличение проницаемости кишечного и гематоэнцефалического барьеров, которое нарастает с возрастом, позволяя большему количеству микробных молекул поступать из кишечника в кровоток и накапливаться в головном мозге. Необходимы дальнейшие исследования для установления влияния пола и возраста на наблюдаемые процессы.
ЗАКЛЮЧЕНИЕ
В этом исследовании сообщается, что дефицита Nod2 в гипоталамических нейронах достаточно, чтобы вызвать изменения аппетита и регуляции температуры у старых самок мышей. Полученные результаты требуют подтверждения в дальнейших исследованиях на мышах и с участием человека.
1. Gabanyi I, Lepousez G, Wheeler R, et al. Bacterial sensing via neuronal Nod2 regulates appetite and body temperature. Science 2022; 376: eabj3986.
2. Gautron L, Elmquist JK, Williams KW. Neural control of energy balance: translating circuits to therapies. Cell 2015; 161: 133-45.
3. Chen Y, Lin YC, Kuo TW, Knight ZA. Sensory detection of food rapidly modulates arcuate feeding circuits. Cell 2015; 160: 829-41.
4. Zarrinpar A, Chaix A, Xu ZZ, et al. Antibiotic-induced microbiome depletion alters metabolic homeostasis by affecting gut signaling and colonic metabolism. Nat Commun 2018; 9: 2872.
5. Yu KB, Hsiao EY. Roles for the gut microbiota in regulating neuronal feeding circuits. J Clin Invest 2021; 131: 143772.
6. Frost G, Sleeth ML, Sahuri-Arisoylu M, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism. Nat Commun 2014; 5: 3611.
7. Rodriguez-Nunez I, Caluag T, Kirby K, Rudick CN, Dziarski R, Gupta D. Nod2 and Nod2-regulated microbiota protect BALB/c mice from diet-induced obesity and metabolic dysfunction. Sci Rep 2017; 7: 548.
8. Zhang X, Zhang G, Zhang H, Karin M, Bai H, Cai D. Hypothalamic IKKbeta/NF-kappaB and ER stress link overnutrition to energy imbalance and obesity. Cell 2008; 135: 61-73.
9. Kuss-Duerkop SK, Keestra-Gounder AM. NOD1 and NOD2 Activation by Diverse Stimuli: a Possible Role for Sensing Pathogen-Induced Endoplasmic Reticulum Stress. Infect Immun 2020; 88: e00898-19.
10. Mossad O, Batut B, Yilmaz B, et al. Gut microbiota drives age-related oxidative stress and mitochondrial damage in microglia via the metabolite N6-carboxymethyllysine. Nat Neurosci 2022; 25: 295-305.
ПРОИЗВОДСИВО ГИСТАМИНА МИКРОБИОТОЙ КИШЕЧНИКА ВЫЗЫВАЕТ ВИСЦЕРАЛЬНУЮ ГИПЕРАЛГЕЗИЮ ПОСРЕДСТВОМ СИГНАЛЬНОГО ПУТИ РЕЦЕПТОРА ГИСТАМИНА 4 У МЫШЕЙ
КОММЕНТАРИИ К СТАТЬЕ РАЗДЕЛ, ПОСВЯЩЕННЫЙ ВЗРОСЛЫМ
Проф. Гарри Сокол (Harry Sokol)
Отделение гастроэнтерологии и нутрициологии, больница Сен-Антуан, Париж, Франция

52% 1 из 2 человек, страдавших расстройством пищеварения, связанным с микробиотой, был осведомлен о наличии этой связи
Comment on the article by De Palma et al. Science Translational Medicine 2022 [1]
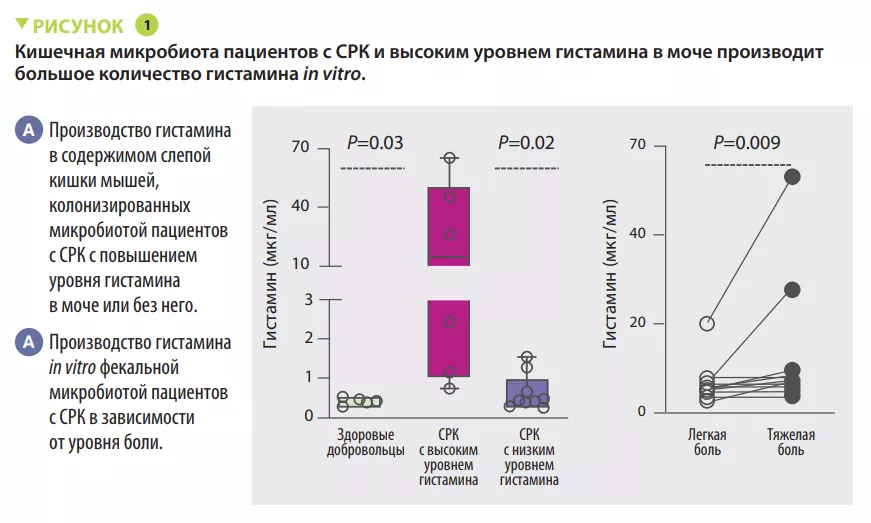
Кишечная микробиота связана с хроническими болевыми расстройствами, такими как синдром раздраженного кишечника (СРК), однако конкретные патофизиологические механизмы такой связи остаются неясными. Авторы статьи сообщают, что снижение потребления ферментируемых углеводов уменьшало боль в животе у пациентов с СРК, что сопровождалось изменениями микробиоты кишечника и снижением концентрации гистамина в моче. Для изучения роли кишечных бактерий и нейроактивного медиатора гистамина в висцеральной гиперчувствительности использовали микробиологически стерильных мышей, которых колонизировали фекальной микробиотой от пациентов с СРК. У микробиологически стерильных мышей, колонизированных фекальной микробиотой пациентов с СРК, у которых был высокий уровень гистамина в моче, развилась висцеральная гипералгезия наряду с активацией тучных клеток. Когда эти мыши получали рацион с уменьшенным содержанием ферментируемых углеводов, у них отмечалось снижение висцеральной гиперчувствительности и накопления тучных клеток в толстой кишке. Авторы установили, что фекальная микробиота от пациентов с СРК с высоким содержанием гистамина в моче продуцировала большое количество гистамина in vitro. Был идентифицирован штамм Klebsiella aerogenes, несущий вариант гена гистидиндекарбоксилазы, основного производителя этого гистамина. Этот бактериальный штамм был очень распространен в фекальной микробиоте трех независимых когорт пациентов с СРК по сравнению со здоровыми добровольцами. Фармакологическая блокада рецептора гистамина Н4 in vivo ингибировала висцеральную гиперчувствительность и уменьшала накопление тучных клеток в толстой кишке микробиологически стерильных мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина. Эти результаты предполагают, что терапевтические стратегии, направленные против бактериального гистамина, могут помочь в лечении висцеральной гипералгезии у части пациентов с СРК с хронической болью в животе.
ЧТО МЫ УЖЕ ЗНАЕМ?
Микробиота кишечника участвует в патофизиологии некоторых хронических болевых расстройств, включаяболь при синдроме раздраженного кишечника (СРК) и фибромиалгии [2]. В основу этого предположения легли результаты исследований, сообщающие о связи между выраженностью боли и изменениями в составе микробиоты кишечника, различиями болевых порогов у обычных мышей и мышей, организм которых не содержит микроорганизмов, подвергнутых бактериальной колонизации, и способности бактерий продуцировать нейроактивные метаболиты in vitro [3]. Еще не удалось получить данные, убедительно доказывающие существование причинноследственной связи, установить механизмы висцеральной боли, обусловленной микробиотой кишечника, или выявить конкретные связанные с этим виды бактерий. Авторы ранее сообщали об уменьшении боли в животе у пациентов с СРК после ограничения потребления ферментируемых углеводов. Э т о улучшение ассоциировалось с изменениями профилей микробиоты кишечника и более низким содержанием в моче гистамина [2], известного медиатора, связанного с висцеральной гиперчувствительностью [4]. В этой статье авторы исследовали ф у н к ц и и м и к р о б и о т ы к и ш е ч н и к а , вызывающие выработку гистамина и висцеральную гиперчувствительность, на микробиологически стерильных мышах, которых колонизировали фекальной микробиотой пациентов с СРК или здоровых людей.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Микробиота кишечника вовлечена в патофизиологию хронической боли у пациентов с СРК
- На фоне диеты, богатой ферментируемыми углеводами, некоторые бактерии в микробиоте, включая Klebsiella aerogenes, способствуют выработке гистамина
- Гистамин, продуцируемый микробиотой, играет роль в развитии висцеральной гиперчувствительности, стимулируя рекрутинг тучных клеток путем активации рецептора H4.
- Фармакологическая блокада рецептора гистамина Н4 in vivo ингибирует висцеральную гиперчувствительность и уменьшает накопление тучных клеток в толстой кишке микробиологически стерильных мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина. Эти результаты предполагают, что терапевтические стратегии, направленные против бактериального гистамина, могут помочь в лечении висцеральной гипералгезии у части пациентов с СРК с хронической болью в животе.
ЧТО ГЛАВНОЕ В ЭТОМ ИССЛЕДОВАНИИ?
Впервые была отмечена положительная корреляция между выраженностью висцеральной боли и концентрацией гистамина в моче в когорте пациентов с СРК.
Висцеральная гиперчувствительность и механическая чувствительность кишечника, оцениваемые по изменению потенциала действия в афферентных нервах толстой кишки, были выше у микробиологически стерильных мышей, колонизированных ЗАКЛЮЧЕНИЕ Микробиота кишечника вовлечена в патофизиологию висцеральной боли у пациентов с СРК. У некоторых пациентов она связана с производством гистамина на фоне диеты, богатой ферментируемыми углеводами. Нацеленное воздействие на гистаминпродуцирующие бактерии или блокада рецептора H4 может стать действенной терапевтической стратегией для таких пациентов. фекальной микробиотой пациентов с СРК с более высоким уровнем гистамина в моче по сравнению с мышами, колонизированными микробиотой от пациентов с СРК с низким уровнем гистамина в моче. Было показано, что микробиота отвечает за выработку гистамина у пациентов с СРК с высоким уровнем этого метаболита в моче (рисунок 1). Кроме того, диета с низким содержанием ферментируемых углеводов снижала гистамин-опосредованную висцеральную гиперчувствительность.
С помощью методов культуромики удалось идентифицировать бактерии рода Klebsiella в качестве основного продуцента гистамина у пациентов с СРК с повышенным уровнем этого соединения в моче.
В отличие от здоровых добровольцев, у пациентов с СРК отмечались более высокое преобладание K. aerogenes и более высокая относительная распространенность гена гистидиндекарбоксилазы (hdc), ответственной за выработку гистамина. С механических позиций, гистамин, продуцируемый K. aerogenes, участвует в рекрутинге тучных клеток, влияя на болевой фенотип у мышей. Экспрессия H4 R (гистаминовый рецептор 4) была повышена в толстой кишке мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина в моче. Блокада H4R in vitro блокировала хемотаксис тучных клеток. Наконец, блокада H4 R in vivo снижала висцерально-моторные реакции на растяжение колоректального сегмента у мышей, колонизированных фекальной микробиотой пациентов с СРК с высоким уровнем гистамина в моче.
КАКОВЫ ПРАКТИЧЕСКИЕ ПОСЛЕДСТВИЯ?
Исследование показывает, что производство гистамина некоторыми бактериями в микробиоте кишечника оказывает особое влияние на болевые симптомы у части пациентов с СРК, потребляющих большое количество ферментируемых углеводов. Можно предположить, что вздутие кишечника, связанное с выработкой газа, не является основным ноцицептивным триггером у этих пациентов. Идентификация K. aerogenes или других гистаминпродуцирующих бактерий может помочь в разработке диетических рекомендаций и методов лечения, нацеленных на микробиоту, или использование антагонистов рецепторов H4 в этой подгруппе пациентов с СРК.
ЗАКЛЮЧЕНИЕ
Микробиота кишечника вовлечена в патофизиологию висцеральной боли у пациентов с СРК. У некоторых пациентов она связана с производством гистамина на фоне диеты, богатой ферментируемыми углеводами. Нацеленное воздействие на гистаминпродуцирующие бактерии или блокада рецептора H4 может стать действенной терапевтической стратегией для таких пациентов.
1. De Palma G, Shimbori C, Reed DE, et al. Histamine production by the gut microbiota induces visceral hyperalgesia through histamine 4 receptor signaling in mice. Sci Transl Med 2022 ; 14 : eabj1895.
2. McIntosh K, Reed DE, Schneider T, et al. FODMAPs alter symptoms and the metabolome of patients with IBS: A randomised controlled trial. Gut 2017 ; 66 : 1241-51.
3. Lyte M. Microbial endocrinology: Host-microbiota neuroendocrine interactions influencing brain and behavior. Gut Microbes 2014 ; 5 : 381–9.
4. Cenac N, Andrews CN, Holzhausen M, et al. Role for protease activity in visceral pain in irritable bowel syndrome. J Clin Invest 2007 ; 117 : 636-47.
МИКРОБНАЯ КОЛОНИЗАЦИЯ КАК ОПРЕДЕЛЯЮЩИЙ ФАКТОР СОСТОЯНИЯ ЗДОРОВЬЯ В ПЕРВЫЕ 1000 ДНЕЙ ЖИЗНИ
Проф. Мари-Клэр Арриета (Marie-Claire Arrieta)
Кафедры физиологии, фармакологии и педиатрии, медицинский факультет Камминга, университет Калгари, исследовательский инновационный центр здравоохранения, Калгари, Альберта, Канада
Кишечник младенца — фундамент иммунитета
Эпидемиологические и механистические исследования за последние 20 лет продемонстрировали влияние характеристик микробиома в раннем периоде жизни на патогенез ряда неинфекционных заболеваний. Это триллионы микроорганизмов, обитающих в основном в кишечнике, которые вовлечены в постоянный «диалог» с клетками нашего тела. Именно благодаря этой связи микробные метаболиты и структуры на ранних этапах жизни способствуют программированию иммунных, неврологических, метаболических и эндокринных механизмов, обусловливающих правильное развитие. Связь сохраняется в течение всей жизни, но существует особый период в раннем развитии, известный как «окно возможностей», в течение которого взаимное общение между микробами и организмом способствует формированию стабильного или нарушенного гомеостаза. Именно этот период, длящийся около 1000 дней и включающий время роста плода и первые два года жизни человека, привлекает все больше внимания ученых.
СОСТАВ И ФУНКЦИИ МИКРОБИОМА В РАННЕМ ПЕРИОДЕ ЖИЗНИ
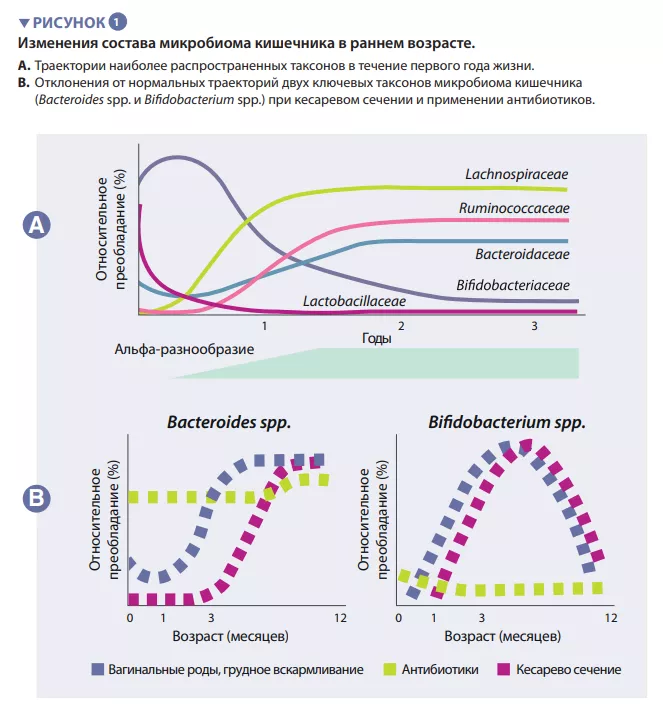
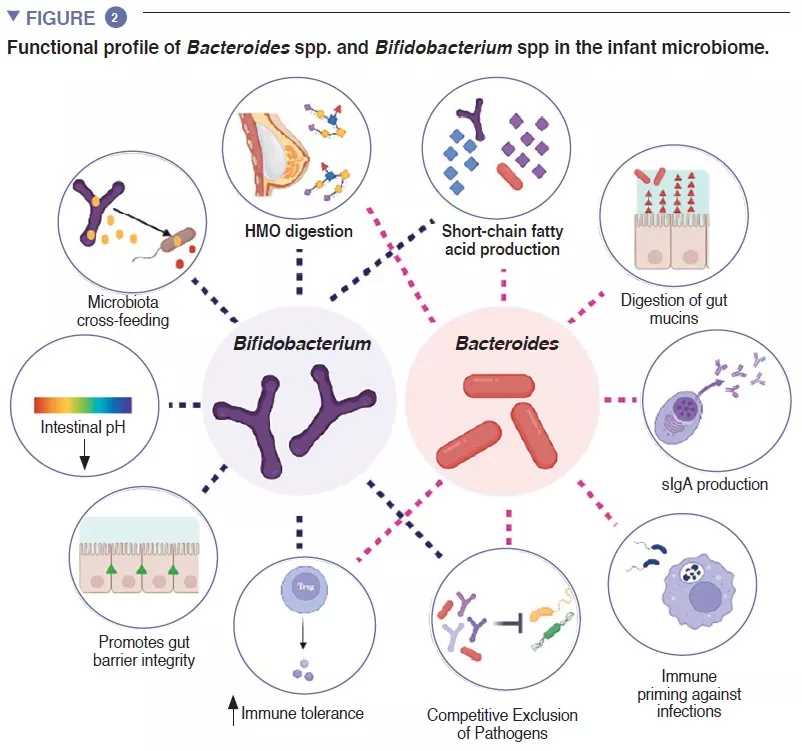
Кишечный микробиом человека начинает развиваться с момента рождения. Вначале это очень простая экосистема, которая через 2-3 года приобретает видовое разнообразие (вставка 1). Этот процесс происходит в несколько этапов, подчиняясь общим закономерностям, с некоторыми популяционными вариациями (рисунок 1). Первые виды, начинающие колонизацию, в основном происходят из родовых путей и фекалий или кожи матери, в зависимости от того, рождается ли ребенок естественным вагинальным путем или с помощью кесарева сечения. В первом случае доминируют Lactobacillus, Prevotella и Sneathia, у рожденных же с помощью кесарева сечения первые колонизаторы — это Staphylococcus, Propionibacterium и Corynebacterium . В организме младенцев на грудном вскармливании содержится больше Bifidobacterium sp. и Lactobacillus sp., а у получающих смесь — Bacteroides, Enterobacteriaceae и Clostridiaceae. По мере введения твердой пищи микробиом кишечника становится все более разнообразным, в нем начинают доминировать Bacteroidaceae, Lachnospiraceae и Ruminococcaceae, что сохраняется и во взрослом возрасте (рисунок 1) [1].
В кишечнике младенца происходят важные метаболические процессы, связанные сищеварением, энергетическим обменом и формированием иммунитета. Перерабатывая компоненты грудного молока, виды Bifidobacterium снижают рН в кишечнике за счет производства молочной (лактат) и уксусной (ацетат) кислот, значительно облегчая всасывание питательных веществ в кишечнике. Ацетат необходим для образования большинства короткоцепочечных жирных кислот (КЦЖК) в кишечнике ребенка и защиты от энтеропатогеных микроорганизмов [2]. Бифидобактерии также участвуют в процессе перекрестного кормления, в котором производимые ацетат и лактат служат субстратами для роста других видов, таких как Roseburia, Eubacterium, Faecalibacterium и Anaeroestipes , способствуя поддержанию разнообразия микробиома. Виды Bacteroides могут ферментировать грудное молоко, это важные продуценты КЦЖК пропионата. Они обладают уникальной способностью метаболизировать олигосахариды, полученные из муцина [3]. Метаболическая пластичность улучшает способность переносить изменения кишечной среды между приемами пищи, а также после прекращения грудного вскармливания и введения в рацион твердой пищи. Виды Bacteroides необходимы для созревания иммунной системы, являясь важным источником микробного липополисахарида, они стимулируют процессы развития иммунной толерантности в кишечнике [4]. Учитывая их особую приспособляемость к среде кишечника младенца, передачу от матери к ребенку, доминирование в кишечнике младенца, важность для других компонентов микробной экосистемы и пользу для организма, представители Bacteroides spp. и Bifidobacterium spp. представляют собой ключевые составляющие детского микробиома (рисунок 2).
ФАКТОРЫ, ПОДДЕРЖИВАЮЩИЕ МИКРОБИОМ В РАННЕМ ПЕРИОДЕ ЖИЗНИ
Первые виды-колонизаторы могут влиять в долгосрочной перспективе на траектории развития микробиома кишечника у детей. Этот экологический процесс определяет фундаментальную роль в формировании сообщества раннего контакта с новой экосистемой. Он объясняет влияние способа рождения на исходный состав микробиома ребенка. Большие когортные исследования в ыявили различия в микробиоме, связанные с кесаревым сечением, которые сохранялись в течение нескольких месяцев после рождения, вероятно, влияя на этот критический период развития организма [5]. К ним относятся меньшее содержание Bacteroides и Bifidobacterium spp., а также большее количество условно-патогенных видов.
Помимо способа рождения, характеристики микробиома в раннем возрасте определяют доступность и обилие питательных субстратов. Грудное молоко содержит более 10 г/л олигосахаридов человеческого молока (ОЧМ), из которых наиболее представлены 2’фукозиллактоза (2’FL) и трифукозиллактоN-гексаоза (TF-LNH) [6]. Большинство ОЧМ превращаются в КЦЖК благодаря бифидобактериям и Bacteroides spp. Бифидобактерии содержат большой набор генов для переваривания ОЧМ. В кишечнике младенца содержится несколько подвидов B. longum , из которых B. longum subsp. infantis (B. infantis), B. longum subsp. longum (B. longum) и B. longum subsp. breve (B. breve) обычно выделяют у здоровых детей на грудном вскармливании, а B. adolescentis — у получающих молочную смесь. Из этих подвидов B. infantis имеет самый большой набор генов для переваривания всех структур ОЧМ в грудном молоке. Грудное молоко также влияет на состав детского микробиома через иммунные факторы, такие как антимикробные соединения (лактоферрин и лизоцим), иммунны эффекторы (sIgA, иммунные клетки и цитокины), которые имеют решающее значение для подавления роста патогенных микробов [1]. Примечательно, что уменьшение содержания Bifidobacterium у детей, вскармливаемых смесью, ассоциируется с более низкой концентрацией лактата, sIgA и более высоким рН в кишечнике по сравнению с детьми, получающими грудное молоко.
Помимо способа рождения и питания, на микробиом в раннем возрасте могут влиять курение матери, индекс массы тела матери, гестационный сахарный диабет, семейная бронхиальная астма и стресс [8]. Механизмы, связывающие эти факторы и микробиом ребенка, остаются неясными, но, вероятно, включают изменения материнского микробиома и их вертикальную передачу новорожденному, а также повышенный риск кесарева сечения и меньшую вероятность успешного грудного вскармливания. В целом, влияние отдельных факторов, таких как способ рождения, применение антибиотиков и грудное вскармливание, изучено относительно хорошо. Тем не менее, о сочетанном влиянии этих факторов известно мало.
Возможна ли внутриутробная колонизация?
- Микробная ДНК была обнаружена в плаценте, амниотической жидкости и меконии, что вызвало предположение о возможности внутриутробной колонизации.
- • Неспособность выделить культуру микроорганизмов из этих структур, последовательное влияние способа рождения на микробиом и возможность производства микробиологических стерильных животных из эмбрионов привели к пониманию того, что в норме микробная колонизация начинается при рождении [15].
ДИСБАКТЕРИОЗ В РАННЕМ ВОЗРАСТЕ — ПРИЧИНА НЕИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Как молодая экосистема, микробиом в раннем периоде жизни менее устойчив. Экологическая устойчивость означает способность экосистемы возвращаться к своему первоначальному состоянию после вынужденного изменения. Это повышает риск того, что микробиом младенца будет постоянно менять свою траекторию во время критических стадий развития. Пери- и постнатальное применение антибиотиков вызывает резкие изменения состава и разнообразия микробиома у младенцев, известные как дисбиоз, уменьшая преобладание бифидобактерий и общее разнообразие микробиома, а также увеличивая количество патогенных видов. Этот эффект наблюдается даже тогда, когда антибиотики получает только мать Возможна ли внутриутробная колонизация? • Микробная ДНК была обнаружена в плаценте, амниотической жидкости и меконии, что вызвало предположение о возможности внутриутробной колонизации. • Неспособность выделить культуру микроорганизмов из этих структур, последовательное влияние способа рождения на микробиом и возможность производства микробиологических стерильных животных из эмбрионов привели к пониманию того, что в норме микробная колонизация начинается при рождении [15]. во время вагинальных родов (с целью профилактики инфекций, вызванных стрептококком группы В), и усиливается дозозависимым образом, если ребенок получает антибиотики в течение первого года жизни [9]. Примечательно, что даже один курс амоксициллина, полученный ребенком, уменьшал количество бифидобактерий в течение нескольких месяцев, подчеркивая восприимчивость важной группы бактерий к широко используемому препарату [10].
Введение антибиотиков во время беременности или до отъема у грызунов может усугубить аллергические иммунные реакции (связанных с IgE, лимфоцитами Th2 и Th17), ожирение, аутоиммунные реакции и хронический колит [1]. Эти системные ответы на дисбиоз в раннем возрасте согласуются с эпидемиологическими данными, связывающими применение антибиотиков в раннем возрасте с рядом неинфекционных заболеваний. Например, систематический обзор и метаанализ 13 исследований показал связь «дозаответ» между применением антибиотиков и ожирением, когда вероятность развития заболевания варьировалась от 11% для младенцев, получивших только одну дозу, до 24% при получении более одной дозы [9]. Совсем недавно систематический обзор и метаанализ 160 исследований, охватывающих более 22 миллионов детей, выявил связь между применением антибиотиков у детей и атопическим дерматитом, пищевой аллергией , аллергическим риноконъюнктивитом, бронхиальной астмой, ювенильным артритом, псориазом и расстройствами аутистического спектра [11].
Установить направленность и причинноследственную связь из эпидемиологических исследований очень сложно. Тем не менее, результаты доклинических исследований и данные о дозозависимой связи между применением антибиотиков и возникновением бронхиальной астмы и ожирения показывают необходимость более строгого контроля использования антибиотиков. В недавнем исследовании с участием детей из Канады отмечено параллельное снижение заболеваемости бронхиальной астмой после уменьшения назначений антибиотиков в общей популяции между 2000 и 2014 гг. Важно отметить, что состав микробиома в возрасте 1 года влиял на связь между применением антибиотиков и выявлением бронхиальной астмы в возрасте 5 лет [12]. Результаты исследования убедительно доказывают существование причинно-следственной связи между применением антибиотиков и развитием бронхиальной астмы у людей, подчеркивая необходимость разумного использования антибиотиков в качестве стратегии снижения заболеваемости бронхиальной астмой.
МОЖНО ЛИ ВЫЛЕЧИТЬ ДИСБИОЗ?
Вредные последствия дисбиоза в раннем возрасте требуют не только дальнейшего изучения, но и практических действий. Такие меры, как уменьшение частоты кесарева сечения, использования смесей для кормления и назначения антибиотиков, хотя и являются достойной целью, имеют ограниченный потенциал в качестве успешных стратегий соответствия социальным потребностям. Было предложено несколько методов восстановления микробиома, показавших неоднозначные результаты. Два из них — вагинальный посев и трансплантация фекальной микробиоты (ТФМ) — изучали в условиях планового кесарева сечения. Вагинальный посев подразумевает нанесение на кожу и/или введение в полость рта новорожденного вагинального секрета матери. Результаты трех исследований этого метода показали, что он не восстанавливает микробиоту детей, родившихся путем кесарева сечения, до состояния, как после вагинальных родов [8]. Напротив, ТФМ от матери к ребенку (однократная процедура во время первого кормления) было достаточно для коррекции микробиома после кесарева сечения [13]. Хотя авторы проводили скрининг образцов для ТФМ на патогены, эта спорная практика содержит риск инфицирования для здорового новорожденного, поэтому вероятно не найдет широкое распространение.
Использование пре- и пробиотиков может обеспечить более практичный и осуществимый подход к восстановлению микробиома, особенно при поддержке информации из исследований, обобщенных выше. Недавнее исследование показало, что восстановления популяции бифидобактерий и генов метаболизма ОЧМ можно добиться, комбинируя введение штамма B. infantis и грудное вскармливание [14]. Эта стратегия позволяла ослабить провоспалительные реакции, способствующие развитию аллергии в течение 1 года жизни, показав долгосрочные полезные эффекты в отношении иммунной системы. Тем не менее, нет убедительных доказательств того, что нынешние стратегии восстановления микробиома помогут изменить тревожную ситуацию с заболеваемостью неинфекционными болезнями у детей.
ЗАКЛЮЧЕНИЕ
Микробиом в раннем возрасте — важнейшая составная часть здоровья ребенка. Наши знания о составе и функциях раннего микробиома, а также о факторах, поддерживающих или нарушающих микробиом, значительно расширились. Однако механизмы, объясняющие, как дисбактериоз способствует развитию заболеваний, изучены мало. Эффективными могут оказаться экологически обоснованные меры по восполнению ключевых видов младенческого микробиома, утраченных в результате применения антибиотиков, кесарева сечения и кормления смесью, а также использование питательных субстратов. Но нынешние стратегии восстановления микробиома все еще недостаточно эффективны, в том числе с точки зрения профилактики неинфекционных заболеваний. Все это показывает необходимость ускорить изменения в медицинской политике и практике.
1. Laforest-Lapointe I, Arrieta MC. Patterns of Early-Life Gut Microbial Colonization during Human Immune Development: An Ecological Perspective. Front Immunol 2017; 8: 788.
2. Fukuda S, Toh H, Hase K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate. Nature 2011; 469: 543-7.
3. Sonnenburg JL, Xu J, Leip DD, et al. Glycan foraging in vivo by an intestine-adapted bacterial symbiont. Science 2005; 307: 1955-9.
4. Telesford KM, Yan W, Ochoa-Reparaz J, et al. A commensal symbiotic factor derived from Bacteroides fragilis promotes human CD39(+)Foxp3(+) T cells and Treg function. Gut Microbes 2015; 6: 234-42.
5. Penders J, Thijs C, Vink C, et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118: 511-21.
6. Thurl S, Munzert M, Boehm G, et al. Systematic review of the concentrations of oligosaccharides in human milk. Nutr Rev 2017; 75: 920-33.
7. Underwood MA, German JB, Lebrilla CB, et al. Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res 2015; 77: 229-35.
8. Korpela K, de Vos WM. Infant gut microbiota restoration: state of the art. Gut Microbes 2022; 14: 2118811.
9. Mc- Donnell L, Gilkes A, Ashworth M, et al. Association between antibiotics and gut microbiome dysbiosis in children: systematic review and meta-analysis. Gut Microbes 2021; 13: 1-18.
10. Korpela K, Salonen A, Saxen H, et al. Antibiotics in early life associate with specific gut microbiota signatures in a prospective longitudinal infant cohort. Pediatr Res 2020; 88: 438-43.
11. Duong QA, Pittet LF, Curtis N, et al. Antibiotic exposure and adverse long-term health outcomes in children: A systematic review and meta-analysis. J Infect 2022; 85: 213-300.
12. Patrick DM, Sbihi H, Dai DLY, et al. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children: evidence from population-based and prospective cohort studies. Lancet Respir Med 2020; 8: 1094-105.
13. Korpela K, Helve O, Kolho KL, et al. Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study. Cell 2020; 183: 324-34.e5.
14. Henrick BM, Rodriguez L, Lakshmikanth T, et al. Bifidobacteria-mediated immune system imprinting early in life. Cell 2021; 184: 3884-98.e11.
15. Perez-Muñoz ME, Arrieta MC, Ramer-Tait AE, et al. A critical assessment of the “sterile womb” and “in utero colonization” hypotheses: implications for research on the pioneer infant microbiome. Microbiome 2017; 5: 48.
Смягчение последствий недоедания с помощью биотиков.
Могут ли некоторые пробиотические бактерии или даже компоненты их клеточных стенок (постбиотики) смягчить последствия недоедания? Исследование, проведенное со штаммом Lactiplantibacillus plantarum, показало интересные результаты.
Питание — не единственное, что влияет на рост… Важную роль играет и микробиота кишечника. Группа ученых ранее показала на мышиной модели, что микробиота кишечника может смягчать вредные эффекты хронического недоедания, снижая резистентность организма к гормону роста (ГР) и повышая циркулирующие уровни фактора роста IGF-1. В результате замедление роста было менее выраженным. Исследователи сосредоточили внимание на штамме Lactiplantibacillus plantarum из-за его способности усиливать рост в модели недостаточности питания с использованием плодовых мух (Drosophila). На этот раз ученые попыталась расшифровать механизмы, лежащие в основе этого явления.1
45% Приблизительно 45% случаев гибели детей в возрасте до 5 лет связаны с недоеданием. В основном это происходит в странах с низким и средним уровнем дохода.
Положительные эффекты Lactiplantibacillus plantarum при хроническом недоедании
Ученые поместили недавно отлученных мышей на диету с пониженным содержанием белка, где ежедневное потребление белка было на 75% ниже по сравнению с нормой. Мышей разделили на две группы, где одна получала бактерии, а другая — плацебо в течение 56 дней. В конце эксперимента мыши, получавшие бактерии, были больше и тяжелее, чем животные в группе плацебо, даже с задержкой роста, вызванной недоеданием. У мышей, получающих бактерии, также были выявлены метаболические и гормональные изменения, включая улучшение циркулирующих уровней и активности IGF-1 и инсулина. Эти изменения были опосредованы компонентами клеточной стенки бактерий, в частности, мурамилдипептидом.
149 миллионов детей в возрасте По оценкам, в 2020 г. 149 миллионов детей в возрасте до 5 лет страдали задержкой роста (недостаточный рост для своего возраста).
Увеличение всасывания питательных веществ
Хроническое недоедание ведет к уменьшению содержания стволовых клеток в кишечнике, из-за чего уменьшается количество эпителиальных клеток, которые также имеют более короткие ворсинки, что нарушает усвоение питательных веществ. Авторы предполагают, что после употребления Lactiplantibacillus plantarum из их клеточной стенки высвобождается ряд бактериальных соединений, включая мурамилдипептид. Рецепторы NOD2 в стенке кишечника связывают мурамилдипептид и активируются, что запускает каскад реакций клеточной сигнализации, ведущий к увеличению пролиферации и более полному созреванию клеток кишечника, что улучшает всасывание питательных веществ. Это, в свою очередь, стимулирует активность чувствительной к питательным веществам оси GH/IGF-1/инсулин, улучшая постнатальный рост у мышей.
Три способа борьбы с последствиями недоедания
Эти результаты предполагают, что в сочетании с адекватным питанием некоторые стратегии могут смягчить последствия задержки роста, вызванной недоеданием:
-пробиотические добавки (содержащие Lactiplantibacillus plantarum)
- (sidenote: Postbiotics Препарат из неживых микроорганизмов и (или) их компонентов, приносящий пользу здоровью организма носителя Salminen S, Collado MC, Endo A, et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics. Nat Rev Gastroenterol Hepatol. 2021 Sep;18(9):649-667. ) добавки (компоненты клеточной стенки бактерий или очищенные лиганды NOD2). Это может помочь 149 миллионам детей в возрасте до пяти лет, страдающих от недоедания 2.
Xpeer course: The rationale behind why and how to choose a probiotic
1. Schwarzer M, Gautam UK, Makki K et al. Microbe-mediated intestinal NOD2 stimulation improves linear growth of undernourished infant mice. Science. 2023 Feb 24;379(6634):826-833.
2. V. Mannar, R. Micha, “Global Nutrition Report 2020: Action on equity to end malnutrition” (Development Initiatives Poverty Research, 2020);
 Факторы, влияющие на развитие микробиоты и созревание иммунной системы в раннем возрасте
Факторы, влияющие на развитие микробиоты и созревание иммунной системы в раннем возрасте
«Супербактерия», которая борется с последствиями недоедания?
Бактерия Lactiplantibacillus plantarum, по-видимому, обладает суперспособностями: она смягчает влияние недоедания на рост (масса тела и размеры) у молодых мышей. Может ли это помочь голодающим детям?
Кишечная микробиота
Мышам, которых только что отлучили от грудного вскармливания, добавляли в пищу Lactiplantibacillus plantarum, бактерию, которая стимулирует рост у недоедающих плодовых мух. Такие же мыши из контрольной группы получали плацебо. Мышей недокармливали и в течение определенного периода наблюдали за их ростом. У мышей, не получавших бактерий, через 56 дней наблюдались характерные признаки недоедания, а их масса тела и размеры на 10% и 3-4%, соответственно, отличались от этих же показателей у других животных. У мышей, которые получали Lactiplantibacillus plantarum, последствия недоедания были выражены значительно меньше, несмотря на отставание в показателях от мышей, получавших нормальную диету.
45% смертей Приблизительно 45% случаев гибели детей в возрасте до 5 лет связаны с недоеданием. В основном это происходит в странах с низким и средним уровнем дохода.
Lactiplantibacillus plantarum — бактерия со сверхспособностями
Результаты эксперимента ничего не говорят нам о причинах этих различий. Тем не менее, это исследование дает понять 1, что диета — не единственный ключевой фактор нормального роста детенышей мыши: важную роль играют и бактерии микробиоты кишечника. Какие механизмы наделяют эту супербактерию такими уникальными свойствами при недоедании? По мнению ученых, компоненты клеточной стенки этой бактерии связываются в организме с определенными рецепторами кишечника, способствуя созреванию пищеварительного тракта у мышей. Более зрелый пищеварительный тракт позволяет молодым мышам более эффективно поглощать питательные вещества из пищи, частично компенсируя недоедание и снижая резистентность к гормону роста. Вот как это делается!
Надежда для 149 миллионов недоедающих детей
Если подобные эффекты будут обнаружены и у человека, открытие может подарить надежду миллионам детей. Предполагается, что в сочетании со стратегией адекватного питания удастся смягчить последствия задержки роста, связанной с длительным недоеданием, назначая недоедающим детям пробиотики, содержащие Lactiplantibacillus plantarum, или просто компоненты клеточной стенки этой бактерии (т. е. (sidenote: Postbiotics Препарат из неживых микроорганизмов и (или) их компонентов, приносящий пользу здоровью организма носителя Salminen S, Collado MC, Endo A, et al. The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics. Nat Rev Gastroenterol Hepatol. 2021 Sep;18(9):649-667. ) ). Это может помочь 149 миллионам детей в возрасте до пяти лет, страдающим от недоедания 2.
149 По оценкам, в 2020 г. 149 миллионов детей в возрасте до 5 лет страдали задержкой роста (недостаточный рост для своего возраста).
Кишечная микробиота
Роль социальных взаимодействий в формировании нашей микробиоты
Межличностные отношения — основной фактор формирования микробиоты и, следовательно, соответствующего метаболизма. Например, у людей, живущих вместе, имеется около 12% общих видов в составе микробиоты кишечника и 32% штаммов – в микробиоте полости рта.

В отличие от генома, который наследуется от родителей и остается стабильным, микробиота заселяет наш организм при рождении и со временем изменяется под влиянием питания, образа жизни, и, что удивительно, людей, с которыми мы контактируем. О последнем говорят результаты исследования на основе большого количества метагеномных данных, охватившего четыре континента1. Было изучено в общей сложности 9715 образцов микробиоты, из которых 7646 пришлись на фекальную микробиоту и 2069 — на микробиоту слюны.
Чем дальше друг от друга, тем больше различия в микробиоте
Согласно первому выводу, вероятность обмена штаммами микробиоты между людьми пропорционально меняется в зависимости от географического расстояния, общего окружения и степени родства. В целом, для микробиоты кишечника самые высокие показатели сходства отмечены между матерями и их детьми в возрасте 0-3 лет (34%), членами (≥4 лет) одного домохозяйства (12%), взрослыми близнецами (8%) и, наконец, взрослыми людьми, живущими в одном городе, но не в одном доме (8%). По мнению авторов, такое сходство микробных профилей между жителями одного города обусловлено физическим взаимодействием между людьми и их общей средой. Напротив, у людей, живущих в разных домах и в разных городах, очень мало общего с точки зрения микробиоты.
38% Партнеры имеют общие 38% микробиоты полости рта.
Особенности передачи микроорганизмов от матери к ребенку
Чтобы лучше понять особенности передачи микроорганизмов от матери к ребенку, было проанализировано 3598 биологических образцов от 711 пар мать-ребенок. Было установлено прогрессирующее снижение доли общих кишечных штаммов: от 65% в День 1, до 50% - через 1 неделю, 47% - через 1 год, 27% - в период с 1 до 3 лет, 19% - до 18 лет и 14% - до 30 лет. Это постепенное уменьшение доли общих штаммов в кишечной микробиоте можно объяснить снижением физической близости и контактом с новым окружением. Тем не менее, общность штаммов оставалась значительной и в более позднем возрасте. Так, люди в возрасте 50-85 лет и их матери все еще имели 16% общих штаммов микробиоты кишечника, несмотря на длительное раздельное проживание.
65% Мать и новорожденный в день рождения имеют общие 65% кишечной микробиоты.
В отношении микробиоты полости рта данные из США и Фиджи показали следующее: доля общих микроорганизмов у матери и ребенка растет по мере взросления последнего, особенно после 3 лет, совпадая с увеличением видового разнообразия микробиоты полости рта. Однако доля общих штаммов у маленьких детей и их матерей (30%) или отцов (24%) не превышала таковой между партнерами (38%), что можно объяснить более высокой степенью интимной близости между последними.
Микробиота Лор-Органов
Низкое влияние различий образа жизни на передачу микробиоты
Наконец, образ жизни (западный или другой) оказывал гораздо меньшее, чем ожидалось, влияние на динамику передачи микробиоты, при этом доли общих штаммов между людьми были удивительно похожи в разных странах. Более высокое богатство микрофлоры, наблюдаемое в общинах, не придерживающихся «западного» образа жизни, не было связано с близкими контактами с другими членами домохозяйства. Вместо этого, главными факторами, которые способствовали высокому микробному разнообразию, были взаимодействие с окружающей средой, питание и образ жизни.
 Все, что вам нужно знать о микробиоте и иммунитете
Все, что вам нужно знать о микробиоте и иммунитете