Microbiote et maladie d’Alzheimer
Par le Pr. Pascal Derkinderen
Service de neurologie, Nantes Université et Inserm U1235, Nantes, France

Commentaire de l’article de Ferreiro et al. Gut microbiome composition may be an indicator of preclinical Alzheimer’s disease. Sci Transl Med 2023; 15(700): eabo2984
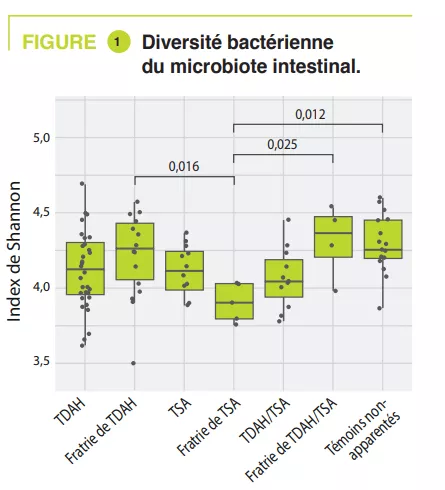
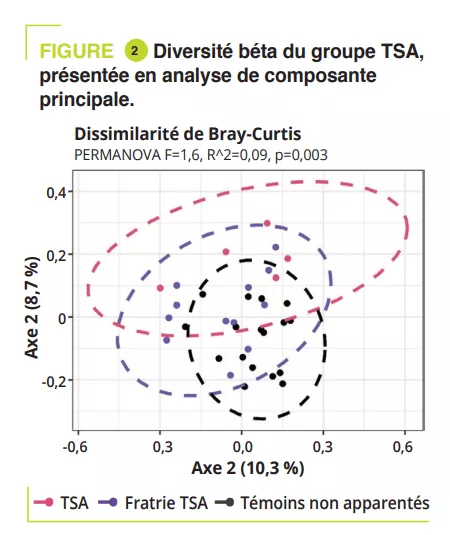
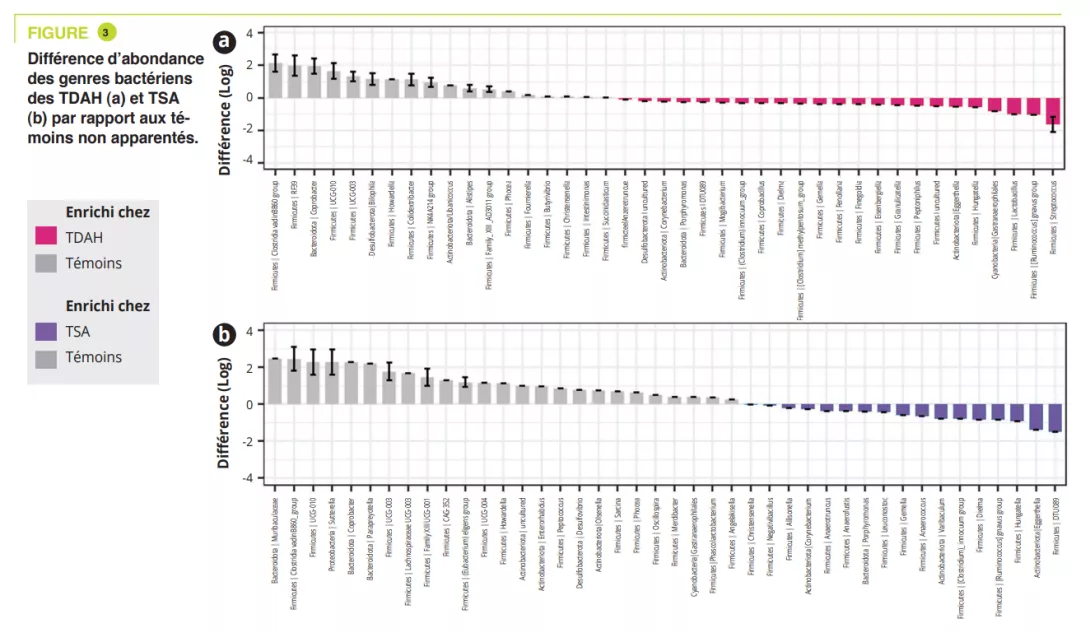
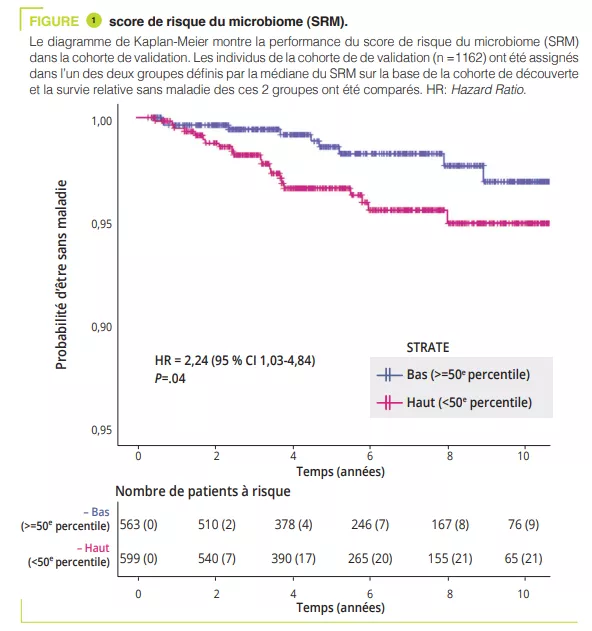
L’axe microbiote intestin-cerveau est un sujet « tendance » dans le domaine des maladies neurodégénératives et la maladie d’Alzheimer (MA), la plus fréquente d’entre elles, ne fait pas exception. Une méta-analyse récente identifiait 17 études de ce type (438 personnes atteintes de MA et 672 témoins) [1]. Bien que les résultats de ces études soient parfois divergents, il est généralement proposé que la dysbiose observée au cours de la MA traduit un changement vers un profil « pro-inflammatoire » [1]. L’ensemble des études disponibles concernent la MA avec troubles cognitifs avérés, et il n’y a pas à présent de données dans la MA préclinique. Cette phase de la maladie qui précède de plusieurs années les troubles cognitifs et au cours de laquelle les nouveaux marqueurs biologiques et d’imagerie permettent de détecter la pathologie amyloïde, une des deux caractéristiques neuropathologiques de la maladie. Ce manque est désormais comblé avec cette publication récente dans laquelle les auteurs ont tiré bénéfice d’une cohorte assez originale puisqu’elle consiste en 164 personnes qui ont un suivi longitudinal de leurs fonctions cognitives, couplé à une imagerie cérébrale (tomographie par émission de positons, TEP et à une ponction lombaire), ces deux derniers examens détectant directement ou indirectement la présence de dépôts de peptide b-amyloïde [2]. Au moment de l’analyse du microbiote intestinal (entre 2019 et 2021), les sujets avaient entre 68 et 94 ans (45% d’hommes) ; à cette date, 49 sujets sur les 164 étaient classés comme ayant une forme préclinique de MA, c’est à dire qu’ils avaient des marqueurs amyloïdes positifs en imagerie et/ou dans le liquide cérébrospinal sans atteinte cognitive clinique. L’analyse du microbiote a montré des différences entre sujets sains et sujets avec une MA préclinique : les espèces les plus significativement associés à la MA préclinique étaient Dorea formicigenerans, Faecalibacterium prausnitzii, Coprococcus catus et Anaerostipes hadrus. Les voies métaboliques associées avec les formes précliniques de MA impliquaient les voies de dégradation de l’arginine et l’ornithine alors que la voie de dégradation du glutamate était surreprésentée chez les sujets sains.
Pensez-vous que les analyses d’échantillons de selles seront bientôt ajoutées aux tests permettant d’identifier les personnes atteintes d’Alzheimer précoce afin de les orienter plus rapidement vers des traitements adaptés ?
La première question qui vient logiquement à l’esprit à la lecture de cet article est de se demander si l’analyse du microbiote pourrait être proposée pour identifier les personnes avec une MA à un stade précoce ou préclinique. D’un point de vue du neurologue, la réponse est plutôt négative. En effet, les données actuelles, tant dans la MA avérée que préclinique ne permettent pas de dégager un microbiote « type », permettant de la distinguer d’une population témoins lors d’un examen des selles réalisable en routine. Et surtout, il existe désormais des marqueurs de MA fiables même à un stade préclinique facilement utilisables en clinique. Si l’on met de côté l’imagerie TEP qui n’est pas accessible dans tous les centres et l’analyse du liquide céphalo-rachidien par ponction lombaire qui peut être considérée comme invasive, il est désormais possible de détecter des modifications du niveau d’expression et/ou de phosphorylation de certaines protéines impliquées dans le processus neurodégénératif dans le plasma et donc à partir d’un simple prélèvement sanguin aussi dans bien dans la MA avérée que préclinique [3].
Partageriez-vous cette publication avec vos patients pour expliquer le lien entre le microbiote intestinal et le cerveau, afin de renforcer le rôle clé que joue le microbiote intestinal dans la santé humaine ?
Pour terminer sur une note plus positive, il est en revanche indéniable que cet article, en montrant pour la première fois une modification de la composition du microbiote dans la MA préclinique, apporte de nouveaux arguments pour penser que le microbiote pourrait jouer un rôle dans le développement de la MA et ce à un stade précoce. Dans ce contexte, son résumé et sa vulgarisation pourraient être proposés au grand public ou à certains patients afin d’insister sur le rôle important du microbiote en santé. Il conviendra toutefois à l’avenir de vérifier que ces résultats peuvent être répliqués indépendamment par d’autres équipes.

1. Jemimah S, Chabib CMM, Hadjileontiadis L, et al. Gut microbiome dysbiosis in Alzheimer’s disease and mild cognitive impairment: A systematic review and meta-analysis. PLoS One 2023; 18: e0285346.
2. Ferreiro AL, Choi J, Ryou J, et al. Gut microbiome composition may be an indicator of preclinical Alzheimer’s disease. Sci Transl Med 2023; 15: eabo2984.
3. De Meyer S, Blujdea ER, Schaeverbeke J, et al. Longitudinal associations of serum biomarkers with early cognitive, amyloid and grey matter changes. Brain 2023: awad