Comment choisir un probiotique pour votre patient ?
Face à une offre de produits pléthorique, il n’est pas toujours facile pour un professionnel de santé de conseiller au patient un produit contenant une ou des souches de probiotique de qualité et adapté à ses besoins 1,2 . Les recommandations des experts peuvent vous y aider.

Conseiller à un patient de « prendre des probiotiques » n’est pas forcément suffisant chez un patient souhaitant un produit probiotique pour un trouble spécifique 3. Pourtant, une étude américaine révèle que 40% des professionnels de soins primaires qui recommandent des probiotiques à leurs patients les laissent choisir leur produit 4. Bien qu’il soit aujourd’hui admis que les probiotiques en général contribuent à la bonne santé du microbiote intestinal, les experts s’accordent pour préciser que la grande majorité des effets des probiotiques sont dépendants de la souche 5,6.
Il est donc important de veiller à la bonne correspondance entre la souche et le besoin ciblé ou la maladie visée 7. Pour cela, il faut donc en particulier vérifier que les caractéristiques et informations sur le produit (souche, dosage, formulation) correspondent en tout point à celles utilisées dans les essais cliniques qui ont prouvé le bénéfice auquel le produit est associé 3. Aussi, il convient d’être particulièrement attentif aux informations suivantes :
- la mention claire du genre, de l’espèce et de la souche du probiotique contenu dans le produit et l’indication associée 8,9 ;
- le dosage du produit 3,8 ;
- les preuves cliniques de l’efficacité de la souche probiotique dans ce domaine thérapeutique auquel elle est associée à un dosage similaire et non inférieur à celui utilisé dans l'essais clinique 8.
D’autres facteurs sont également à prendre en compte dans le choix d’un produit probiotique :
- le type de formulation 3,8 ;
- la durée de viabilité jusqu’à la date de péremption, et non à la date de fabrication 8;
- la qualité du produit liée aux exigences du fabricant : contrôles qualité et de préférence, certification par un organisme indépendant 8,9 .
Pour communiquer avec votre patient
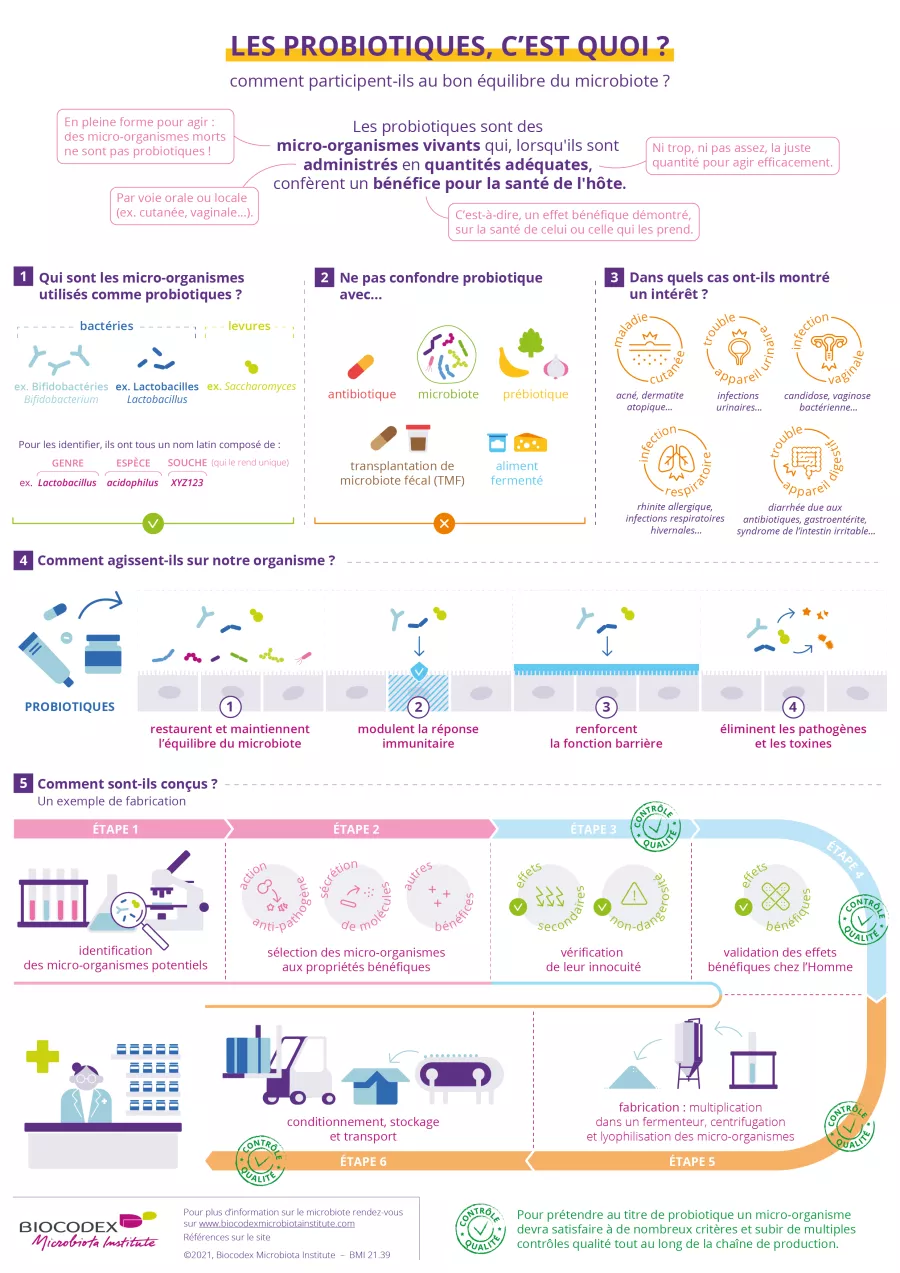
Vous trouverez ci-dessous une infographie « les probiotiques, c’est quoi ? » destinée à votre patient pour l’informer sur les produits à base de probiotique et faciliter vos échanges lors de la consultation.
Des infographies à partager avec vos patients
L’Institut du Microbiote vous recommande le site de L’ISAPP qui fournit également aux professionnels de santé et aux consommateurs des ressources sur les probiotiques (en anglais) : https://isappscience.org/for-clinicians/resources/
Dans le domaine de la gastro-entérologie, vous trouverez des informations sur les indications chez les adultes et les enfants, prouvés cliniquement, sur les sites de la World Gastroenterology Organisation (WGO) et l’American Gastroenterological Association (AGA).
Point de vigilance et effets secondaires :
Il est utile de préciser au patient que la prise de produit à base de probiotique par voie orale peut s’accompagner d’effets indésirables transitoires à type de gaz et ballonnements 10.
Il est important de garder à l’esprit et d’informer le patient que l’efficacité d’une souche probiotique peut varier d’un patient à un autre 3.
Les risques associés aux souches probiotiques sont reconnus faibles, mais il est prudent d’éviter l’utilisation des produits probiotiques chez les nouveau-nés prématurés, les personnes intolérantes à l’un des excipients rentrant dans la formulation des produits à base de probiotique, immunodéprimées, atteintes du syndrome du grêle court ou en état critique 3,11,12.
Consultez les autres pages de notre série dédiée aux probiotiques
Les probiotiques : de quoi parle-t-on ?
Tout ce que vous devez savoir à propos des probiotiques
Recommandé par notre communauté

"Une belle réussite" -@ABmrJutt (De Biocodex Microbiota Institute sur X)
BMI-23.39
 Atténuer la dénutrition avec des biotiques ?
Atténuer la dénutrition avec des biotiques ?