D’après l’Observatoire International des Microbiotes, plus de 9 personnes sur 10 (95 %) ayant bénéficié, de façon répétée, d’informations de la part de leurs professionnels de santé ont adopté des comportements spécifiques afin de conserver un microbiote équilibré. Qu’en est-il des antibiotiques ? Selon la même étude, seul 1 patient sur 3 a déclaré avoir été informé par son professionnel de santé que la prise d’antibiotiques pouvait perturber l’équilibre de son microbiote. Étant donné que les renseignements fournis par les professionnels de santé sont un vecteur de changement de comportement, au cours de la WAAW 2023 (du 18 au 24 novembre), le Biocodex Microbiota Institute met en avant le rôle clé joué par les médecins quant aux informations qu’ils transmettent concernant l’impact des antibiotiques sur le microbiote et la santé.
Former les médecins : transmettre les informations à leurs patients
Engaging healthcare professionals (antibiotics prescribers) with tailor-made content. During the WAAW campaign, Biocodex Microbiota Institute federates its physicians ‘community with two “hub” pages gathering all physicians’ tools (thematic folder, accredited training on dysbiosis and the impact of antibiotics, infographics to share with their patients, news, experts ‘interviews…).
Sensibiliser à l’impact des antibiotiques sur le microbiote reste important. Ces deux pages « Hub » ont pour but de fournir aux médecins un contenu bref et facile à utiliser afin de permettre à leurs patients de mieux comprendre l’importance d’utiliser les antibiotiques avec précaution.
Éduquer le grand public : passez à l’action !
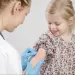
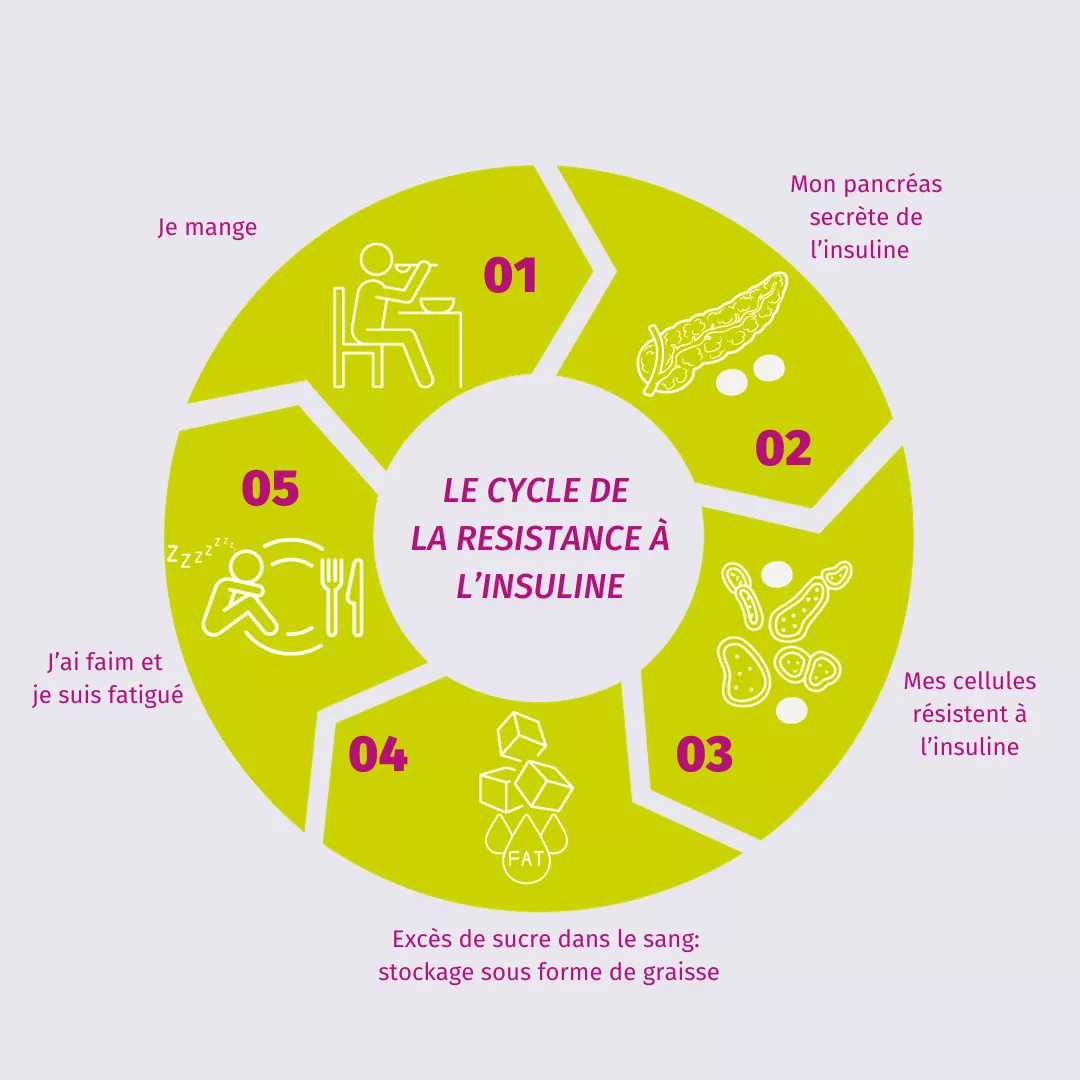
Considérés comme l’une des plus grandes avancées médicales du 20e siècle, les antibiotiques ont sauvé des millions de vies. Aujourd’hui, ils représentent de sérieux défis en matière de santé publique : leur utilisation excessive et inappropriée entraîne l’émergence de nombreuses résistances, qui, à long terme, pourraient finalement les rendre inefficaces. De plus, ils peuvent aussi endommager le microbiote en induisant une dysbiose. Pour le grand public, l’institut enquête sur ce rôle ambivalent avec une page « Hub » regroupant tout le contenu concernant l’impact des antibiotiques sur le microbiote.
Des différentes filiales au Biocodex Microbiota Institute, en passant par le site de production de Beauvais, tous les collaborateurs de Biocodex s’engagent !
Pour la campagne WAAW 2023, la page d’accueil du site Web du Biocodex Microbiota Institute, ainsi que ses comptes X (Twitter), Facebook et LinkedIn se sont mis au bleu. Mais les réseaux sociaux de l’institut ne sont pas les seuls… le centre de production et logistique Biocodex de 9 hectares de Beauvais, près de Paris, a rejoint le mouvement en adoptant le bleu pendant toute la WAAW. Plus de 30 projecteurs ont été installés afin que les visiteurs et les collaborateurs de Biocodex puissent voir la vie en bleu. Du 18 au 24 novembre, l’institut invite les collaborateurs de Biocodex, partout dans le monde, à rejoindre la campagne sur les réseaux sociaux grâce à une vignette bleue à ajouter sur LinkedIn.
#GoBlueForAMR
 Fausses couches répétées : un cas d’étude sur la transplantation de microbiote vaginal (TMV)
Fausses couches répétées : un cas d’étude sur la transplantation de microbiote vaginal (TMV)