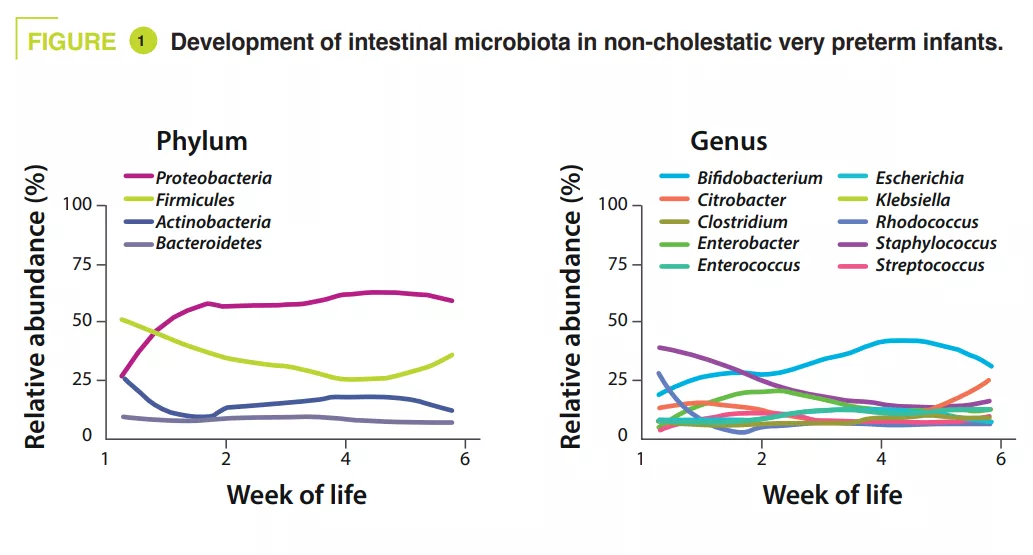
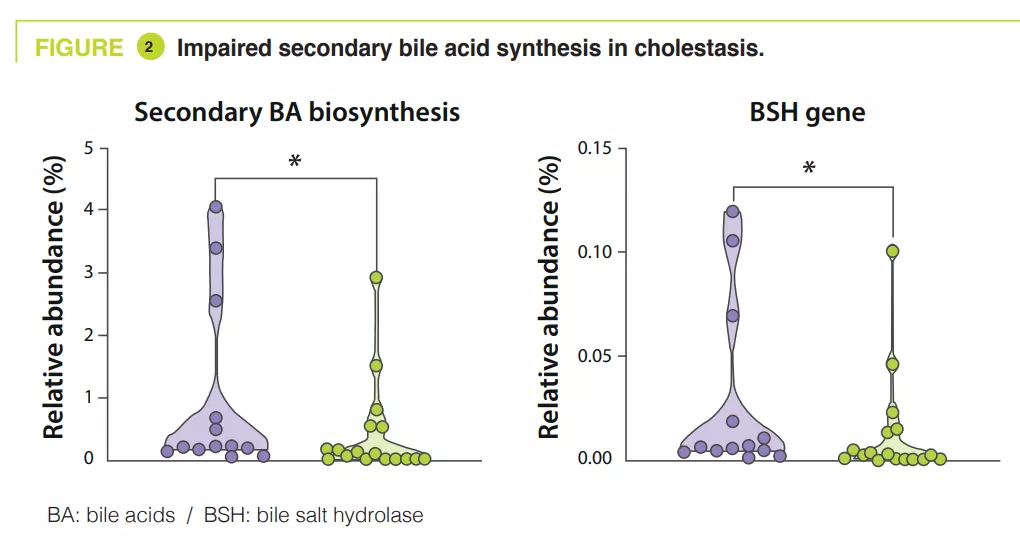
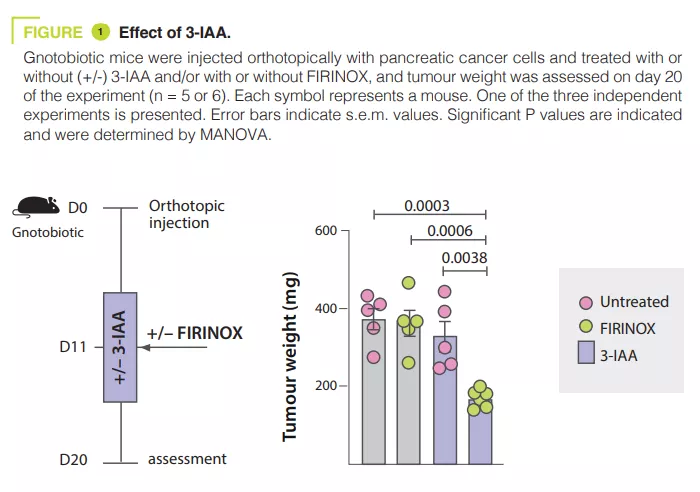
Les microbiotes : essentiels pour la santé, mais peu connus dans le monde
Que savent aujourd’hui nos concitoyens sur le rôle des microbiotes ? Que savent-ils du bon comportement à adopter pour prendre soin de leurs microbiotes ? Quel est le rôle joué par les professionnels de santé dans l’information des patients ? Pour répondre à ces questions, le Biocodex Microbiota Institute a confié à Ipsos la réalisation d’une grande enquête internationale sur ce sujet : l’Observatoire International des Microbiotes. Pour mener cette enquête, Ipsos a interrogé 6 500 personnes dans 7 pays. L’enquête a été menée du 21 mars au 7 avril 2023. Les résultats ont été présentés le 27 juin, lors de la Journée mondiale du microbiome.
Grande méconnaissance du terme « microbiote »
En règle générale, les personnes interrogées ont assez peu de connaissances sur le microbiote : seule 1 personne 5 déclare savoir précisément ce que signifie le mot microbiote (21 %), alors que les autres admettent ne connaître que le mot (43 %). Plus d’1 personne sur 3 indique n’avoir jamais entendu le terme (36 %). En outre, lorsque nous essayons d’en savoir plus sur leur niveau de connaissance, les notions sont superficielles. Si une petite majorité affirme connaître le microbiote intestinal (53 %, mais seulement 24 % savent exactement de quoi il s’agit), les autres types de microbiotes sont nettement moins connus, qu’il s’agisse du microbiote vaginal (45 % des personnes interrogées connaissent le terme, mais seulement 18 % savent précisément ce que c’est), le microbiote buccal (43 % connaissent le terme, mais 17 % savent ce que c’est) ou le microbiote cutané (40 % connaissent le terme, mais seulement 15 % savent ce que c’est). Les autres sont encore moins connus, comme le microbiote urinaire (seulement 14 % savent précisément ce que c’est), le microbiote pulmonaire (seulement 13 % savent précisément ce que c’est) et le microbiote ORL (11 % savent précisément ce que c’est).
Le rôle et l’importance du microbiote sont plutôt mal connus
Environ 3 personnes interrogées sur 4 savent qu’un risque de déséquilibre du microbiote peut avoir des conséquences majeures sur la santé (75 %), que notre alimentation a des conséquences majeures sur l’équilibre de notre microbiote (74 %) et que notre microbiote joue un rôle réel dans les mécanismes de défense immunitaire (72 %). Pour le reste, les connaissances restent très modérées. Plus d’1 personne sur 3 ne sait pas que les antibiotiques ont un impact sur notre microbiote (34 %). Près d’1 personne sur 2 ne sait pas que le microbiote est constitué de bactéries, de champignons et de virus (46 %) et qu’il permet à l’intestin de transmettre au cerveau des informations essentielles sur la santé (47 %). 1 personne sur 2 pense que lorsque notre microbiote est déséquilibré ou ne fonctionne pas correctement, on ne peut pas y faire grand-chose (47 %). Enfin, la grande majorité des personnes interrogées ne savaient pas que de nombreuses maladies, comme la maladie de Parkinson, la maladie d’Alzheimer et l’autisme, pourraient être liées au microbiote (75 %).
1 personne sur 5 déclare savoir précisément ce que signifie le mot microbiote (21 %)
24% savent exactement de quoi il s’agit
1 personnes sur 3 a été informé du fait que la prise d’antibiotiques pourrait avoir des conséquences négatives sur l’équilibre de son microbiote
Le début d’une prise de conscience ?
Plus d’1 personne sur 2 disent aujourd’hui avoir adopté au quotidien des comportements favorables au maintien d’un microbiote équilibré (57 %). Si nous pouvons nous féliciter de cette prise de conscience, elle doit être mise en perspective. Premièrement, parce que seule 1 personne sur 7 déclare faire « très attention » (15 %) à son microbiote, tandis que la plupart des autres disent y faire « un peu attention » (42 %). Deuxièmement, 43 % des personnes interrogées ont répondu n’avoir adopté aucun comportement spécifique. Les résultats de l’Observatoire international des microbiotes montrent qu’il reste beaucoup à faire dans ce secteur.
Les informations fournies par les professionnels de santé : un vecteur d’information qui change la donne !
Moins d’1 patient sur 2 déclare que son médecin lui a déjà expliqué comment maintenir un microbiote équilibré (44 %, mais chez seulement 19 % cela a été expliqué plus d’une fois) ou lui a prescrit des probiotiques ou des prébiotiques (46 %, mais seulement 21 % indiquent que cela a été fait plusieurs fois). Seule une minorité des personnes interrogées déclarent avoir été informées par leur médecin de l’importance d’un microbiote bien équilibré (42 %). Enfin, seule 1 personne sur 3 indique que son médecin lui a déjà expliqué ce qu’est le microbiote et à quoi il sert (37 %, et cela a été expliqué plusieurs fois à seulement 15 %).
Les informations fournies par les médecins lors de la prescription d’antibiotiques demeurent insuffisantes pour permettre aux patients de comprendre les risques du traitement en termes de déséquilibre du microbiote. La prescription d’antibiotiques devrait être une opportunité de fournir des informations essentielles sur le microbiote, mais souvent ce n’est pas le cas. Lors de la prescription d’antibiotiques, par exemple, le microbiote du patient est exposé à un risque. Lorsque des antibiotiques sont prescrits, moins d’1 patient sur 2 indique que son médecin l’a informé du risque de problèmes digestifs associés aux antibiotiques (41 %). Seulement 1 sur 3 a reçu des conseils visant à réduire au maximum les conséquences négatives de la prise d’antibiotiques sur leur microbiote (34 %) ou a été informé du fait que la prise d’antibiotiques pourrait avoir des conséquences négatives sur l’équilibre de son microbiote (33 %).
L’enquête montre qu’à partir du moment où un patient a reçu toutes les informations de la part de son professionnel de santé, et ce de manière répétée, son rapport au microbiote change considérablement et se démarque de la moyenne. Plus de 9 personnes sur 10 (95 %) ayant reçu des informations répétées de la part de leur professionnel de santé ont adopté des comportements favorables au maintien d’un microbiote équilibré, contre 57 % de l’ensemble des personnes interrogées. Des informations répétées fournies par un professionnel de santé ont donc un impact très puissant sur les niveaux de connaissance et les comportements.
Cette enquête exclusive révèle à la fois un manque général de compréhension de la manière dont le microbiote influe sur notre santé et du rôle essentiel des professionnels de santé dans la transmission des connaissances.
1 patient sur 2 déclare que son médecin lui a déjà expliqué comment maintenir un microbiote équilibré
95% des personnes ayant reçu des informations répétées de la part de leur professionnel de santé ont adopté des comportements favorables au maintien d’un microbiote équilibré
vs 57% Contre 57% de l’ensemble des personnes interrogées