Que sait-on déjà à ce sujet ?
Le cancer est l’une des principales causes de décès dans le monde. Sa tumorigenèse, sa progression et la façon dont il répond aux traitements vont être influencés par différentes interactions entre le système immunitaire de l’hôte et les bactéries du microbiote. Néanmoins, le rôle des champignons (mycobiote) dans ces processus reste largement inexploré. Les champignons et les bactéries co-colonisent le tube digestif, l’épithélium de la peau, les voies respiratoires et les organes reproducteurs des mammifères, formant un écosystème complexe d’interactions microbe-microbe et hôte-microbe ayant des implications importantes pour la santé humaine. Alors que les infections fongiques sont responsables de plus de 1,5 million de décès par an dans le monde, elles ne représentent que 0,1 % de l’ADN microbien présent dans l’intestin, suggérant une influence disproportionnée des espèces de ce règne sur le microbiome global et l’immunité de l’hôte. Que l’on parle de virus, de bactéries ou de champignons, les preuves scientifiques s’accumulent sur l’existence d’un lien entre microbiome humain, cancer et ses conséquences. Plusieurs cas d’association entre espèces bactériennes et développement/ progression du cancer ont été observées ces dernières années. Helicobacter pylori est responsable d’environ 75 % du risque attribuable au cancer gastrique, tandis que Escherichia coli génotoxique, Bacteroides fragilis, Streptococcus bovis/gallolyticus et Fusobacterium nucleatum ont été impliqués dans la carcinogenèse colorectale [2]. Ces bactéries ont en commun leur capacité à provoquer une inflammation chronique, des caractéristiques qui contribueraient à leur capacité tumorigène. Des rapports récents ont également identifié des bactéries intracellulaires dans de nombreux types de tumeurs [3].
Le mycobiome joue un rôle clé dans l’activation de l’immunité innée dans l’intestin. Les toxines fongiques et les amines bioactives ont été associées à la cancérogenèse. Des études expérimentales récentes soutiennent l’implication fongique dans les cancers dans certains contextes [4]. Les données de séquençage provenant de banques de tumeurs montrent la présence de séquences microbiennes, mais la composante fongique reste inexplorée.
Quels sont les principaux résultats apportés par cette étude ?
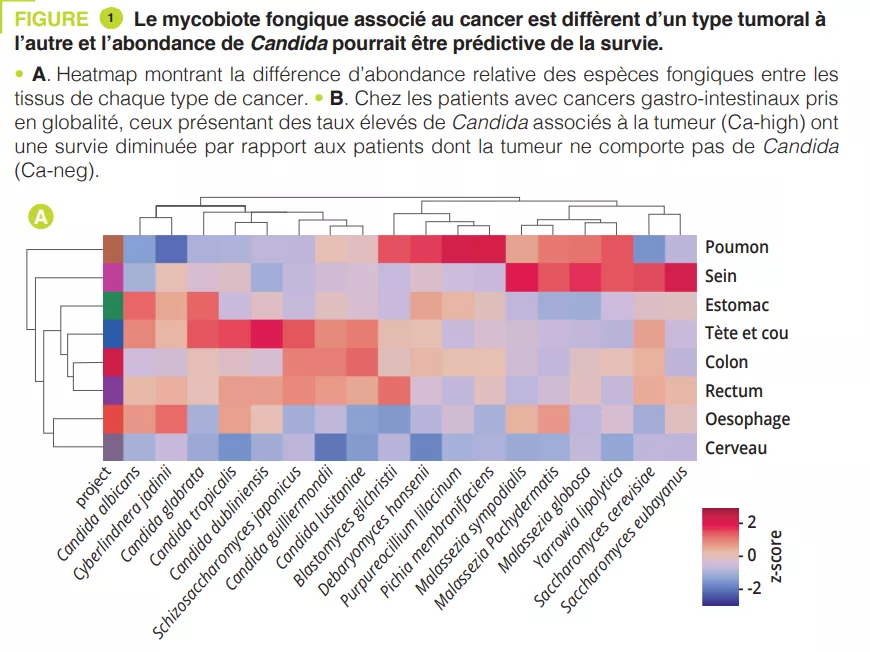
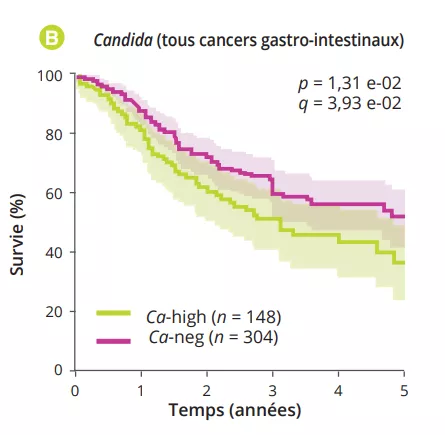
En analysant plusieurs types de cancer à partir du « The Cancer Genome Atlas » (TCGA), les auteurs ont extrait les profils des mycobiomes associés aux tumeurs avec une résolution au niveau des espèces. Après avoir éliminé les contaminations et les signaux faussement positifs, les auteurs ont constaté que les compositions fongiques variaient selon le type de cancer, certains champignons étant spécifiques du type tumoral, que cela soit pour des localisations gastro-intestinales ou non (figure 1A). Dans l’ensemble, il a été trouvé jusqu’à une cellule fongique pour 10 000 cellules tumorales humaines, un taux cohérent avec le fait que les champignons représentent 0,1-1 % du microbiome, et qu’il est estimé que les bactéries représentent un peu moins de 1 % des cellules trouvées dans les tumeurs [2, 3]. Plusieurs espèces de Candida, Saccharomyces cerevisiae et Cyberlindnera jadinii étaient retrouvées comme très abondantes dans les tumeurs gastro-intestinales, tandis que les espèces de Blastomyces et Malassezia étaient abondantes dans les tumeurs pulmonaires et mammaires, respectivement. Les auteurs ont ensuite démontré que plusieurs espèces de Candida sont vivantes et actives sur le plan transcriptionnel au niveau de la tumeur. Enfin, l’abondance de certains champignons au sein de la tumeur pourrait prédire l’expression des gènes de la tumeur hôte, l’état de la maladie et la survie (figure 1B), même si cela doit être confirmés. Ensemble, ces résultats impliquent les champignons, et particulièrement Candida, dans la pathogenèse des cancers gastro-intestinaux, mais suggèrent également leurs potentiels en tant que cible thérapeutique et outil pronostique.
Quelles sont les conséquences en pratique ?
À côté des bactéries, cette étude démontre la présence de champignons au sein de nombreuses tumeurs digestives et extradigestives, avec une forme de spécificité d’un type tumoral à l’autre et un potentiel caractère prédictif de la sévérité. Ces résultats suggèrent un rôle des champignons dans le processus carcinologique et sa gravité. D’autre part, ils pourraient ouvrir la voie vers le développement de nouveaux biomarqueurs ou de nouveaux traitements du cancer ciblant la composante fongique.
 Urétrites idiopathiques masculines : de nouvelles étiologies infectieuses identifiées ?
Urétrites idiopathiques masculines : de nouvelles étiologies infectieuses identifiées ?