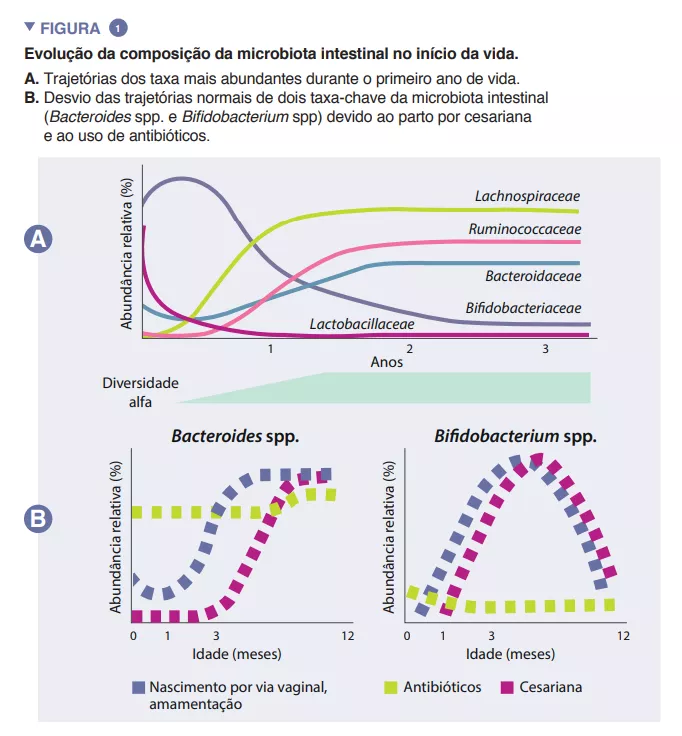
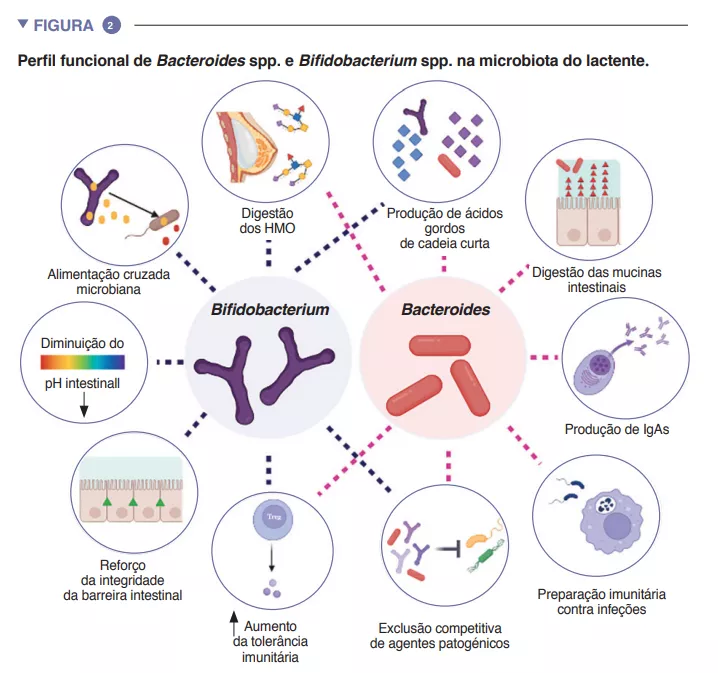
Microbiota Intestinal #17
Pelo Prof. Satu Pekkala
Investigador na Academia da Finlândia, Faculdade de Ciências do Desporto e da Saúde, Universidade de Jyväskylä, Finlândia

RELAÇÃO ENTRE A DINÂMICA DA MICROBIOTA GASTROINTESTINAL E O SEU METABOLOMA E O RESULTADO CLÍNICO DO TRANSPLANTE DE CÉLULAS ESTAMINAIS HEMATOPOIÉTICAS EM CRIANÇAS
O transplante de células estaminais hematopoiéticas (GCSH) é utilizado para tratar muitas doenças. Após o GCSH, podem ocorrer doenças do enxerto contra o hospedeiro e infeções, que constituem as principais causas de mortalidade. O papel da microbiota intestinal (MI) nas complicações pós-GCSH em pacientes pediátricos ainda é pouco conhecido. Num estudo longitudinal, Vaitkute et al. investigaram se a MI e o metaboloma fecal estavam associados ao resultado clínico em 64 doentes pediátricos submetidos a GCSH durante um período de hospitalização de aproximadamente 66 dias. Após o GCSH, a diversidade alfa da MI diminuiu. Foram observadas alterações na composição do MI, sendo que a maioria dos doentes não regressou à linha de base. A MI foi dividida em tipos de estado comunitário (community state types, CST). O CST1 era comum antes do GCSH, com abundância de Clostridium XIVa, Bacteroides e Lachnospiraceae. A ausência de nutrição parentérica total contribuiu para o CST1. O CST2 era comum após o GCSH e caracterizava-se pela presença abundante de Streptococcus e Staphylococcus e pela utilização de vancomicina e metronidazol. O CST3 também era comum após o GCSH e incluía Enterococcus, Enterobacteriaceae e Escherichia em abundância. O CST3 foi associado a um maior risco de viremia, à utilização de nutrição parentérica total e à utilização de vários antimicrobianos. As análises metabolómicas mostraram que a presença inicial de butirato nas fezes estava associada a um menor risco de viremia. A análise longitudinal mostrou uma diminuição do acetato e do butirato e um aumento da glucose após o GCSH. Os taxa microbianos intestinais e os metabolitos identificados podem constituir biomarcadores úteis para prever o risco de complicações pós-GCSH. No entanto, são necessários estudos longitudinais de maior dimensão.
ESTUDO PROSPETIVO DA RELAÇÃO ENTRE A MICROBIOTA INTESTINAL DO LACTENTE E A RESPOSTA ÀS VACINAS
O estabelecimento da microbiota intestinal (MI) no início da vida é essencial para o desenvolvimento do sistema imunitário. Além disso, a MI contribui para as respostas imunitárias à vacinação, particularmente contra a poliomielite. No entanto, a investigação nesta área é ainda escassa. Moroishi et al. recrutaram 83 lactentes e estudaram a relação entre a composição e a função da MI no início da vida (6 semanas de idade) e a resposta de anticorpos ao polissacárido capsular pneumocócico (PCP) e ao toxoide tetânico (TT) com 1 ano de idade. As análises de PERMANOVA das composições da comunidade microbiana intestinal correspondente mostraram uma fraca associação com as respostas de anticorpos ao PCP e ao TT. Nas suas análises metagenómicas, os autores demonstraram uma associação inversa entre a resposta ao TT e Aeriscardovia aeriphila, enquanto a associação foi positiva com Staphylococcus aureus, Escherichia coli, Streptococcus thermophilus e Anaerococcus vaginalis. No entanto, apenas a A. aeriphila permaneceu significativa após a correção FDR. Uma resposta mais baixa à vacina contra a PCP foi associada a nove vias, incluindo a biossíntese da fenilalanina e a biossíntese de novo de desoxirribonucleótidos de pirimidina. Em contrapartida, as vias da biossíntese do pantotenato e da coenzima A III, da degradação dos ribonucleósidos de pirimidina, da degradação do metilfosfonato II e da biossíntese de novo dos ribonucleótidos de pirimidina foram associadas a uma maior resposta à PCP. Cinco vias foram positivamente associadas à resposta ao TT, nomeadamente as vias de biossíntese do CDP-diacilglicerol I e II.
Em conclusão, a espécie A. aeriphila pode ser utilizada como marcador de resposta ao TT. Além disso, as funções da MI no início da vida poderiam influenciar a resposta vacinal do lactente.
UMA META-ANÁLISE DA MICROBIOTA DA MUCOSA REVELA ASSINATURAS MICROBIANAS UNIVERSAIS E DISBIOSE NA CARCINOGÉNESE GÁSTRICA
O cancro gástrico (CG) é a quarta principal causa de morte por cancro. As fases de desenvolvimento do CG são a gastrite superficial (GS), a gastrite atrófica (AG), a metaplasia intestinal (MI), a displasia e o carcinoma gástrico. As infeções por Helicobacter pylori estão frequentemente implicadas no CG, reduzindo a secreção de ácido gástrico e permitindo a proliferação de microrganismos não-H. pylori. Estudos sobre as associações entre a microbiota gástrica e o CG produziram resultados contraditórios. Liu et al. efetuaram uma meta-análise da microbiota gástrica em seis estudos independentes, a fim de identificar assinaturas microbianas no CG. A diversidade alfa foi menor no CG do que no GS, GA e MI. Os géneros Veillonella, Dialister, Granulicatella, Herbaspirillum, Comamonas, Chryseobacterium, Shewanella e Helicobacter foram identificados como biomarcadores universais que distinguem o CG do GS. Além disso, os patógenos oportunistas Fusobacterium, Parvimonas, Veillonella, Prevotella e Peptostreptococcus foram mais abundantes no GC do que no GS. Por outro lado, Bifidobacterium, Bacillus e Blautia foram menos abundantes. As funções microbianas foram deduzidas utilizando a ferramenta PICRUSt2. Em comparação com GS, a via mais enriquecida no CG foi a maturação de peptidoglicano a partir da biossíntese de peptidoglicano. A via mais depletada no CG foi o ciclo do ácido tricarboxílico específico de Helicobacter, o que é consistente com a abundância muito baixa de Helicobacter em doentes com CG. Os autores também descobriram que a Helicobacter parecia afetar o microbiota gástrico, na medida em que os doentes com H. pylori negativo apresentavam uma maior diversidade microbiana do que os doentes com H. pylori positivo. Em conclusão, o microbiota gástrico pode constituir um biomarcador que permite distinguir entre as diferentes fases da doença.