Устойчивость к антибиотикам в окружающей среде: давняя проблема
Антибиотикорезистентность (АР) — древний и распространенный феномен, существовавший задолго до начала использования антибиотиков в качестве лекарственных средств. Окружающая среда служит огромным резервуаром генов антибиотикорезистентности, где различные микробные сообщества имеют свои механизмы резистентности. Феномен АР можно обнаружить в различных условиях окружающей среды, включая почву, воду, растений, животных и даже в арктической вечной мерзлоте возрастом 30 000 лет [1, 2]. Экологическая роль молекул антибиотиков и связанной с ними резистентности в природных условиях не до конца изучена, однако неоспорим тот факт, что легкодоступный пул генов существовал еще до начала клинического использования антибиотиков и объясняет быстрое появление патогенов. Нынешний кризис антибиотиков является эволюционным событием, а стратегии его преодоления должны учитывать микробную экологию. Проблема заключается в быстром приобретении резистентности еще недавно чувствительными патогенами, что ведет к неудачам терапии, особенно на фоне очень ограниченного поступления новых противомикробных препаратов на рынок [3].
Механизмы появления и распространения резистома
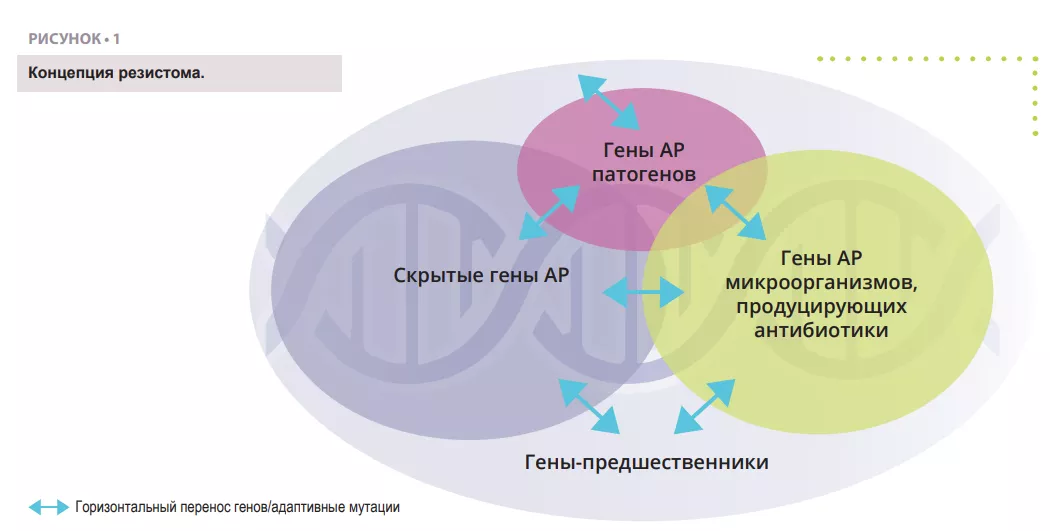
Резистомом называют весь набор генов, кодирующих связанные с АР белки, или белки, потенциально способные эволюционировать в мощные инструменты АР [4] (рисунок 1). Он включает известные гены АР у патогенных (проблемные) и антибиотикпродуцирующих организмов (например, Streptomyces spp. , производящий стрептомицин), ассоциированные гены резистентности [5], скрытые гены АР (т. е. гены, способные обеспечить резистентность в определенных условиях, например, эффлюксные насосы или порины), предшественники генов АР, кодирующие белки с минимальным уровнем аффинности или резистентности к антибиотическим соединениям.
Важно отметить, что понятие резистома не означает «функциональную и клинически значимую АР» . Гены резистома могут переходить между различными состояниями, описанными выше, посредством горизонтального переноса генов (ГПГ) , точечны х мутаций или рекомбинации, которые приводят к появлению новых хозяев или генетического контекста, в котором создаются условия для реализации клинически значимого фенотипа АР. Фото: Shutterstock. Таким образом, гены резистентности сами по себе не являются проблемой, поскольку зависят от хозяин а и генетического контекста, однако все гены резистома представляют потенциальную угрозу и риски для здоровья населения. Обнаружение гена резистентности к клинически значимой молекуле в мобильном элементе патогена человека является серьезным риском, однако наличие того же гена или его близких гомологов, не связанных с мобильными генетическими элементами, у непатогенной почвенной бактерии ассоциируется с очень низким риском АР. Поэтому определение степени риска АР в исследованиях резистома имеет первостепенное значение.
Горизонтальный перенос генов (ГПГ) является важнейшим механизмом быстрого распространения генов АР среди бактерий, даже не родственных друг другу. Например, Bacteroides spp., преобладающая в кишечной микробиоте человека, обладает геном устойчивости к макролидам ermB, иде нтичным обнаруженным в нескольких изолятах Clostridium perfringens, Streptococcus pneumoniae и Enterococcus faecalis из различных географических регионов, что указывает на генетическую связь между Bacteroides и некоторыми грамположительными бактериями, которые не распространены в кишечнике человека [6]. Генетические элементы, такие как плазмиды, облегчают передачу генов резистентности между различными видами микроорганизмов [7].
ГПГ позволяет распространять гены в различных средах и популяциях бактерий, способствуя обще й распространенности и разнообразию АР.
Совместный отбор является еще одним значимым фактором распространения АР. Использование неантибиотических соединений, таких как тяжелые металлы и биоциды, помогает отбору генов АР благодаря избирательному давлению на микробные популяции, совместному приобретению резистентности (появление различных факторо в резистентности в одном генетическом элементе) или перекрестной резистентности (появление общего фактора устойчивости к антибиотикам и металлам) [8]. Воздействие природных антимикробных соединений, например, продуцируемых конкурирующими микроорганизмами, или любыхко-селективных молекул может стимулировать отбор резистентных штаммов [9]. Присутствие в окружающей среде антибиотиков, как природных, так ипроизводимых человеком, также способствует селективному давлению на резистентность. Кроме того, использование антибиотиков в сельском хозяйстве и ветеринарной практике может привести к попаданию их в окружающую среду, способствуя появлению и распространению генов АР [10].
Дисбиоз и кишечный резистом у младенцев: тонкий баланс
Разнообразие экологического резервуара генов АР и возможности их передачи представляют угрозу для кишечного микробиома человека враннем возрасте. Такие стратегии, как улучшение очистки сточных вод, ответственное использование антибиотиков в сельском хозяйстве и ветеринарии, а также снижение загрязнения окружающей среды антибиотиками и антибиотикорезистентными бактериями могут помочь в борьбе с распространением АР [11]. Кроме того, наблюдение за экологическими резервуарами может дать ценную информацию овозникновении и сохранении АР, а также послужить основой для мероприятий в области общественного здравоохранения.
После рождения наш кишечник быстро колонизируется микроорганизмами, полученными от матери и из окружающей среды. Именно в первые годы жизни изменения микробиома — более резкие и медленнее восстанавливаются по сравнению с более стабильным микробиомом кишечника здорового взрослого человека. Поэто м у новорожденные и младенцы более подвержены нарушениям со стороны микробных сообществ, известным как дисбиоз. В течение этого периода многие факторы могут влиять, в том ч и с л е н егативно, насозревани е кишечника, что потенциально может иметь долгосрочные последствия для здоровья [12]. Исследования на мышах показали, что в этом критическом периоде развития, не столько прямое воздействие молекул антибиотиков, сколько изменение состава кишечной микробиоты вызывает неблагоприятные метаболические последствия, например, ожирение [13].
Обнаружение резистома в кишечнике младенцев: результаты крупного когортного исследования
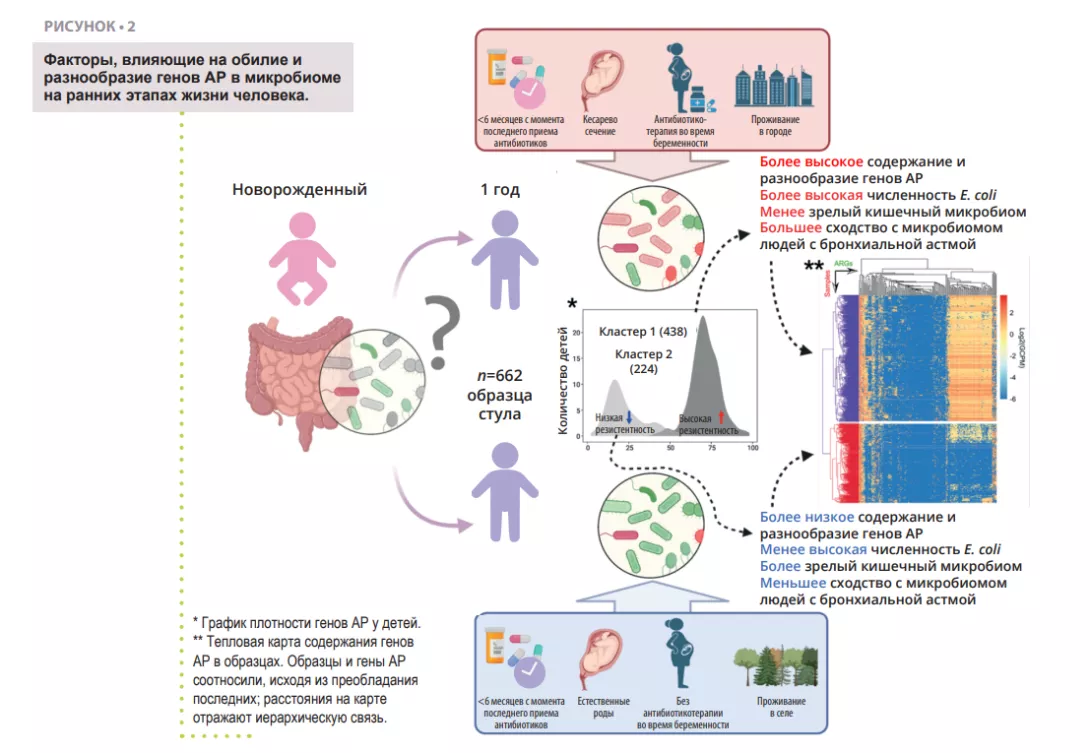
В то время как АР является проблемой в любом возрасте, созревание кишечного микробиома в раннем возрасте представляет собой окно возможностей для уменьшения резервуара генов АР в кишечнике. Поэтому важно выявить различные факторы, увеличивающие или уменьшающие количество генов А Р ,которые могут передаваться инфекционным патогенам и приводить к неэффективности антибиотикотерапии на протяжении всей жизни. Изучение резистома кишечника у человека основано на целостном подходе, учитывающем присутствие видов и функциональный потенциал их геномов, включая резистом. Ученые выделяют ДНК из окружающей среды косвенным путем (например, из фекалий), а затем используют метод неизбирательного в ы с о к о п р о и з в о д и т е л ь н о г о секвенирования (метод дробовика). Примерно 80% видов бактерий кишечника человека, обнаруженных с помощью молекулярных инструментов, не поддаются культивированию, особенно облигатные анаэробы. Вероятно, многие микробы организованы в многовидовые сообщества с общими метаболическими путями, что делает выделение чистого штамма трудным или невозможным. Однако с помощью вычислительных методовможно реконструировать квазиполные геномы из метагеномов и связать определенные гены с конкретными видами или даже штаммами бактерий. В недавнем исследовании ученые проанализировали образцы кала 662 детей, за которыми наблюдали от рождения до 7 лет [14]. Цель исследования заключалась в оценке резистома в возрасте 1 года и выявлении перинатальных и экологических факторов, ассоциированных с качественными и количественными характеристиками генов АР. С помощью секвенирования методом дробовика авторы изучили образцы, полученные у 662 детей в возрасте 1 года, для выявления генов АР и соответствующих бактериальных таксонов (рисунок 2). Используя большой набор данных, удалось проследить геномно-метагеномные ассоциации (MAG) и таксономически соотнести геномы конкретных микроорганизмов с генами АР.
Первой находкой оказалось то, что все дети имели минимум один ген множественной лекарственной устойчивости в своем кишечнике. Это значит, что даже при отсутствии лечения антибиотиками в организме человека существует резидентный резистом, ассоциированный с кишечным микробиомом. Далее оказалось, что большая часть генов множественной лекарственной устойчивости кодирует эффлюксные насосы. Эти белки являются нормальным компонентом каждой бактериальной клетки. Некоторые из них могут вызывать АР и сильно подвержены перекрестному отбору, например, в условиях воздействия тяжелых металлов или биоцидов, что потенциально объясняет их высокое содержание в кишечнике и в окружающей среде [8, 15]. Другим неожиданным результатом было четкое разделение когорты участников на две группы по профилю резистома. Первая группа характеризовалась более высоким разнообразием генов АР и относительным преобладанием Escherichiacoli в качестве основного переносчика генов АР (рисунок 2). Это согласуется с предыдущими наблюдениями, что Enterobacteriaceae преобладают в раннем возрасте, но затем их популяция быстро уменьшается по мере роста колонизации кишечника представителями Bacteroidetes. Задержка этих процессов у некоторых детей может быть связана с рядом факторов, таких как применение антибиотиков, способ родоразрешения, условия проживания (город или село). В результате происходит задержка сокращения популяции Escherichia coli и увеличение резистома в возрасте 1 года. Это подтверждается наблюдением, что более высокое содержание генов АР связано с более низкими показателями зрелости кишечного микробиома с точки зрения соотношений отдельных таксонов в том или ином возрасте [16].
Это указывает на некоторую пластичность микробиома в раннем возрасте, который потенциально может быть улучшен с помощью целенаправленного вмешательства, например, с помощью про- или пребиотиков. Эта гипотеза еще нуждается в проверке. Однако в когортном масштабе наибольшие различия в распространенности генов АР касались антибиотиков, никогда не назначавшихся детям, т. е. увеличение резистома кишечника зависит от перинатальных и экологических факторов, помимо антибиотикотерапии. Еще одно наблюдение, касающееся связей между окружающей средой и резистомом, в том числе кишечника, заключалось в том, что дети из городских районов имели значительно больше генов АР, чем их сельские сверстники. Существует множество потенциальных искажающих факторов, которые могут объяснить этот факт, однако нельзя спорить с тем, что окружающая среда вносит большой вклад в развитие микробиома на ранних этапах жизни.
Можно предположить, что городская жизнь связана с меньшим контактом с внешним миром и уменьшением разнообразия микробиома, или что тип жилья (частный дом или квартира) влияет на его внутренний микробиом (как видно на примере постельной пыли).