Motricité gastrointestinale et troubles fonctionnels
Les nombreuses sessions dédiées à la motricité GI, axées essentiellement sur les maladies fonctionnelles, ont constitué l’un des temps forts de cette édition. Lors de la cérémonie d’ouverture, un point sur le reflux gastro-œsophagien (RGO) réfractaire a été présenté dans le cadre d’une conférence présidentielle donnée par le Pr Somchai Leelakusolvong, Président du comité d’organisation local. Le Pr Leelakusolvong a souligné l’importance de la version 2.0 du consensus de Lyon, qui a élargi les critères des signes endoscopiques pour inclure l’œsophagite par reflux de grade B de la classification de Los Angeles, plus pratique dans les pays asiatiques. L’événement a également été l’occasion de présenter de nombreuses nouvelles données sur l’optimisation du traitement du RGO réfractaire sur la base de différents mécanismes. Les avancées réalisées en matière de stratégies thérapeutiques ont également été mises en avant, notamment l’utilisation de médicaments ciblant la pression du sphincter inférieur de l’œsophage (SIO), les contractions œsophagiennes, les interventions endoscopiques et la stimulation électrique. Les relaxations transitoires du sphincter inférieur de l’œsophage ont été considérées comme l’un des mécanismes clés du RGO. Ce phénomène peut être amélioré par le baclofène en augmentant la pression du SIO au repos, réduisant ainsi les épisodes de reflux. Des données préliminaires sur une petite cohorte de patients ont suggéré que la stimulation électrique pourrait améliorer la pression du SIO ; cependant, l’application pratique de cette intervention à l’avenir fait toujours l’objet de débats.
L’événement a également accordé une attention particulière à la comparaison entre les inhibiteurs de la pompe à protons (IPP) et les antiacides compétitifs du potassium (potassium competitive acid blockers, PCAB) dans différentes études, la population cible étant les patients atteints d’œsophagite érosive. Les preuves actuelles montrent que les PCAB sont plus efficaces que les IPP dans le traitement de l’œsophagite érosive sévère, tout en étant associés à des événements indésirables acceptables.
L’une des sessions les plus intéressantes était celle intitulée « All about GERD » (Tout sur le RGO), présidée par le Pr Somchai Leelakusolvong et le Pr Kwang-Jae Lee le 8 décembre. Cette session s’est principalement concentrée sur les mises à jour du consensus de Lyon, la prise en charge du reflux non acide et l’optimisation du traitement du pyrosis fonctionnel.
Le Dr Ping-Huei Tseng, de Taïwan, a présenté les détails des changements apportés par la version 2.0 du consensus de Lyon, avec une clarification sur l’élargissement des critères concernant les signes endoscopiques pour intégrer l’œsophagite de grade B de la classification de Los Angeles. Le rôle de la manométrie haute résolution (high-resolution manometry, HRM) pour exclure les autres troubles œsophagiens et identifier les facteurs de risque du RGO, tels qu’une faible pression du SIO, une hernie hiatale ou une faible contraction œsophagienne, a également été expliqué avec des exemples de cas pour plus de clarté. En pH-impédancemétrie des 24 heures, certains paramètres prometteurs tels que l’impédance basale nocturne moyenne (mean nocturnal baseline impedance, MNBI) et l’onde péristaltique induite par la déglutition post-reflux (post-reflux swallow-induced peristaltic wave, PSPW index), font toujours l’objet de débats et nécessitent davantage de données cliniques.
Concernant la prise en charge du reflux non acide, le Pr Justin Wu de Hong Kong a souligné les différences entre la définition du RGO réfractaire et les symptômes du RGO réfractaire, ces derniers pouvant être causés par différentes maladies. Les rôles de la HRM, de l’endoscopie et de la pH-impédancemétrie des 24 heures dans le diagnostic et la prise en charge de ces maladies sont expliqués en détail dans les recommandations de l’ESNM/ANMS. La décision de réaliser une pH-impédancemétrie des 24 heures avec ou sans IPP dépend de l’objectif diagnostique, visant soit à confirmer un RGO chez des patients n’ayant jamais été diagnostiqués soit à confirmer un RGO réfractaire. Il sera utile d’adopter une stratégie par étapes pour les patients qui présentent un RGO réfractaire afin de déterminer le moment optimal pour réaliser les interventions endoscopiques ou la chirurgie. La prise en charge du reflux non acide doit être envisagée en fonction de l’ensemble des mécanismes possibles, notamment les caractéristiques des épisodes de reflux, les profils de motricité œsophagienne et les chevauchements de symptômes. De plus, le Pr Wu a insisté sur la nécessité d’établir une valeur seuil pour le temps d’exposition à l’acide (acid exposure time, AET) pour le diagnostic du RGO dans la population asiatique, qui peut être un point de débat par rapport au consensus de Lyon.
Le pyrosis fonctionnel pose également certains problèmes en raison de différents facteurs : chevauchement avec d’autres troubles gastro-intestinaux fonctionnels, présentation avec des troubles mentaux (anxiété, dépression, stress) dans le contexte du mécanisme de la « voie intestin-cerveau », et nécessité de réaliser des examens d’exploration pour exclure d’autres diagnostics. De récentes données ont montré que 70 % des patients présentant des symptômes fonctionnels avaient des résultats endoscopiques normaux. Au sein de cette population, 50 % avaient des résultats normaux à la pH-impédancemétrie des 24 heures et 60 % ne montraient pas de corrélation avec la survenue des symptômes, et donc 21 % seulement ont été considérés comme présentant un pyrosis fonctionnel. C’est pourquoi, parallèlement aux IPP, les neuromodulateurs jouent un rôle essentiel. Les antidépresseurs tricycliques (ATC) et les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS) ont montré leur efficacité dans le traitement du pyrosis fonctionnel. Cependant, leurs effets indésirables potentiels doivent être soigneusement évalués. Pour la prévention, il est recommandé de commencer le traitement par une faible dose et de maintenir un suivi pendant le traitement.
Intelligence artificielle en endoscopie : temps forts du symposium de l’APSDE–WEO
L’intelligence artificielle (IA) est également un sujet d’actualité qui a mobilisé de nombreux orateurs. Le 9 décembre, dernier jour de l’APDW, l’APSDE et la WEO ont organisé un symposium clinique international intitulé « Artificial Intelligence in Endoscopy: Implementation in the Asia Pacific and the World » (Intelligence artificielle en endoscopie : mise en œuvre dans la région Asie-Pacifique et le reste du monde). Cette session était modérée par le Pr Hisao Tajiri, le Pr Yuichi Mori et la Pr associée Nonthalee Pausawasdi. Le Pr Yuichi Mori a fait la première présentation au cours de laquelle il a présenté le comité IA de la WEO et les deux projets en cours. Le premier projet est une étude internationale destinée à évaluer les perceptions des endoscopistes et des patients concernant l’utilisation de l’IA en endoscopie. L’autre est une étude longitudinale sur le rôle de l’IA en vie réelle. Le comité IA de la WEO se concentre sur la mise en œuvre de l’IA dans la pratique clinique, en considérant différents aspects tels que l’exactitude, le rapport coût-efficacité, les interactions médecin-machine, les programmes de formation et les considérations éthiques.
Le Pr Han-Mo Chiu, le Pr Rungsun Rerknimitr et le Pr Kherk-Yu (Lawrence) Ho ont chacun présenté différents sujets sur le développement et l’utilisation de l’IA dans différents domaines, à savoir le dépistage du cancer colorectal, le dépistage du cancer gastrique et l’endoscopie biliaire. De nombreuses données nouvelles ont été présentées, qui motiveront les cliniciens et les endoscopistes pour mettre en œuvre l’IA dans un avenir proche.
La Pr associée Dao Viet Hang a présenté un autre aspect de l’utilisation de l’IA dans le domaine de la formation en endoscopie, en particulier dans les pays à ressources limitées. Elle a souligné que les paramètres conventionnels utilisés dans la formation en endoscopie, basés le nombre minimum de cas ou la durée d’exercice, ne reflètent pas les compétences et le développement personnel dans le temps, nécessitant une approche davantage interactive. Les programmes d’e-formation et les activités avec simulation intégrée ont montré des résultats prometteurs pour renforcer les connaissances des jeunes endoscopistes et leurs compétences en matière de détection des lésions. Jusqu’à présent, l’IA a produit des résultats prometteurs pour l’amélioration de la détection des lésions, de plus en plus de données étant disponibles en pratique clinique, mais elle n’est toujours pas intégrée dans la formation en endoscopie. Des éléments importants doivent être pris en compte pour l’application de l’IA dans le domaine de la formation en endoscopie, notamment la faisabilité économique, la sécurité, la responsabilité, les problèmes techniques, la validation et le rôle des cliniciens dans la numérisation. L’adoption de l’IA dans la formation en endoscopie devra être basée sur un équilibre entre facteurs liés à l’utilisateur, facteurs technologiques, facteurs sociaux et facteurs contextuels (environnement et normes pédagogiques). Une évaluation est nécessaire pour définir les besoins éducatifs et fixer des objectifs clairs pour pouvoir choisir la technologie d’IA. L’IA doit être intégrée dans la formation sur la base des meilleures preuves disponibles et dans le cadre d’un programme spécifique, incorporant une formation à la fois pour les apprenants et pour les formateurs afin de favoriser son adoption.
Toutes les présentations faites lors de cette session ont suscité un grand nombre de commentaires et de questions, reflétant un vif intérêt pour l’application future de l’IA en endoscopie.

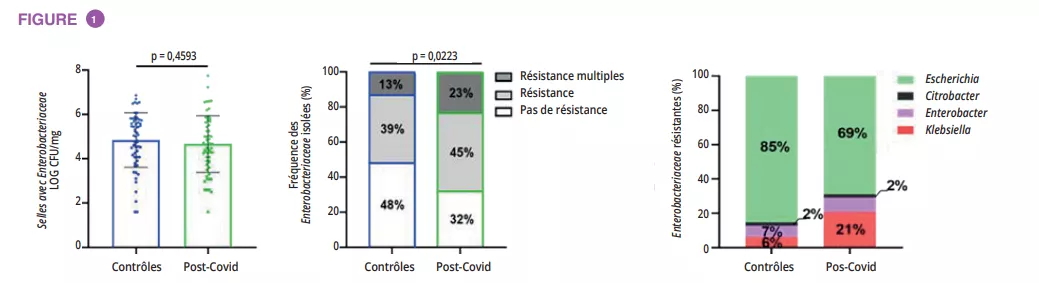
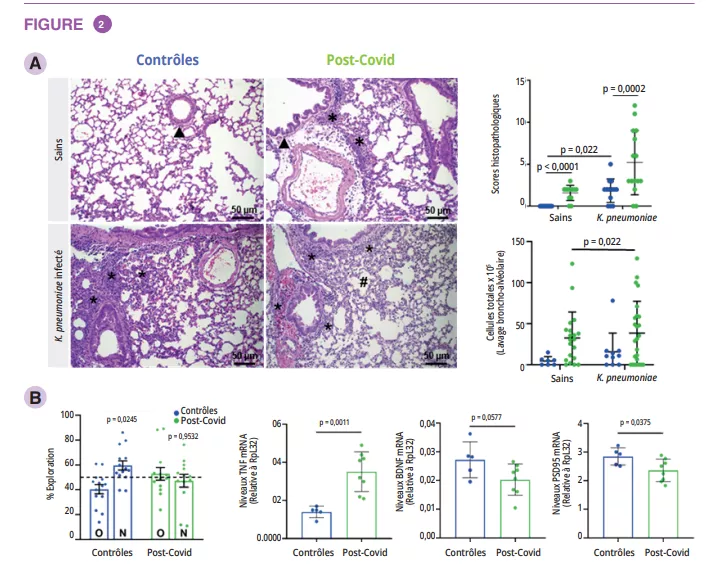
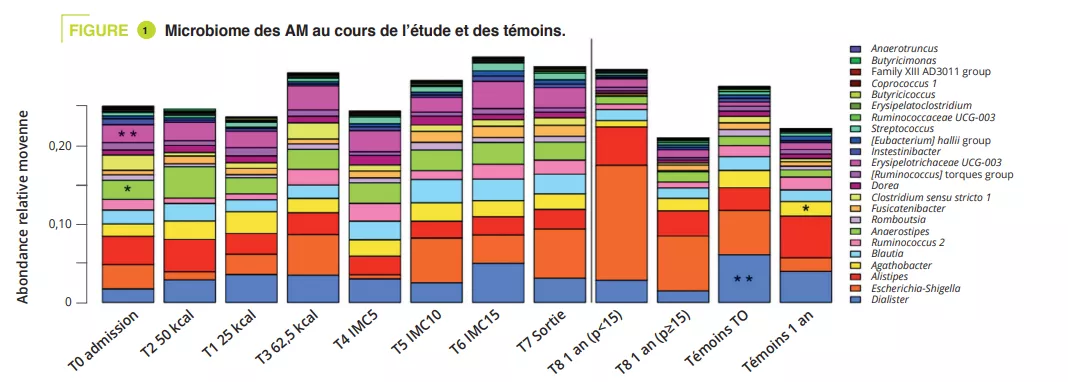
 Infections urinaires : rompre le cercle vicieux
Infections urinaires : rompre le cercle vicieux