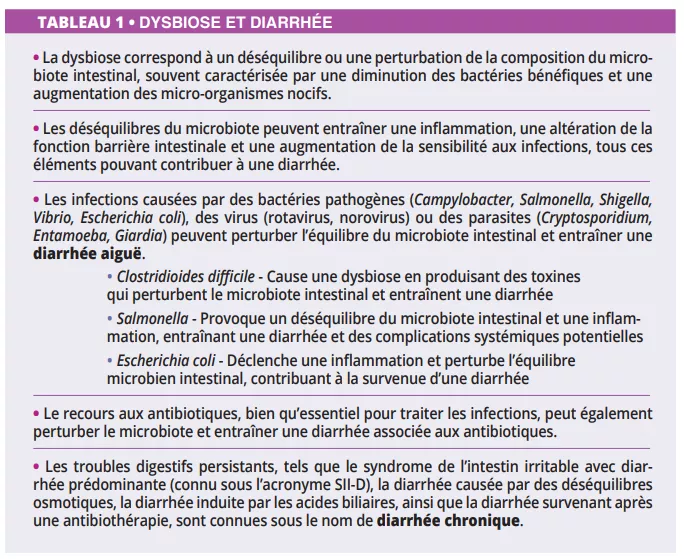
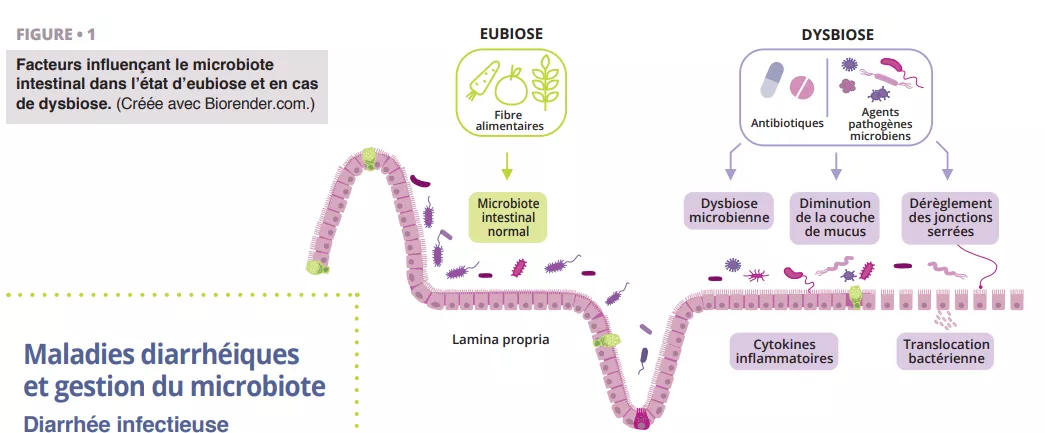
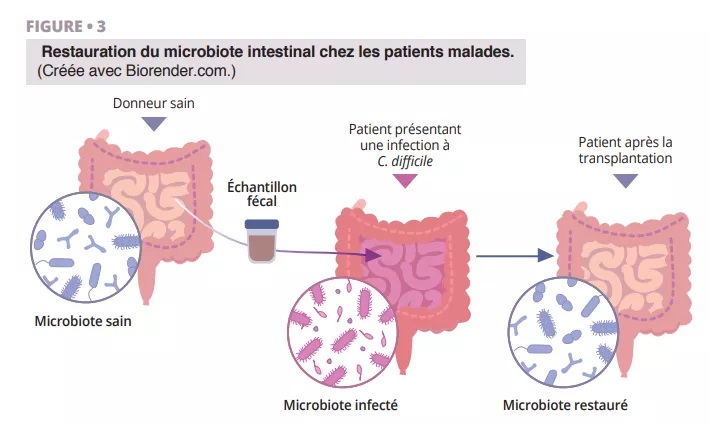
Transplantation de microbiote fécal associée à une immunothérapie anti-PD-1 dans le cadre d’un mélanome avancé : essai de phase I
ARTICLE COMMENTÉ - Rubrique adulte
Par le Pr. Harry Sokol
Gastro-entérologie et nutrition, Hôpital Saint-Antoine, Paris, France
Commentaire de l’article de Routy et al., Nature Medicine 2023 [1]
La transplantation de microbiote fécal (TMF) représente une stratégie potentielle pour surmonter la résistance aux inhibiteurs de points de contrôle immunitaire chez les patients atteints de mélanome réfractaire ; cependant, le rôle de la TMF dans le cadre d’un traitement de première ligne n’a pas été évalué. Les auteurs ont mené un essai multicentrique de phase I combinant la TMF de donneurs sains avec les inhibiteurs de PD-1 nivolumab ou pembrolizumab chez 20 patients atteints de mélanome avancé et n’ayant jamais été traités. Le critère d’évaluation principal était la sécurité. Aucun événement indésirable de grade 3 n’a été rapporté lors de la TMF. Cinq patients (25 %) ont présenté des effets indésirables de grade 3 liés au système immunitaire à la suite de la thérapie combinée. Les principaux critères d’évaluation secondaires étaient le taux de réponse objective, les changements dans la composition du microbiome intestinal et les analyses immunitaires et métabolomiques systémiques. Le taux de réponse objective était de 65 % (13 sur 20), dont quatre (20 %) réponses complètes. Le profilage longitudinal du microbiome a révélé que tous les patients ont été colonisés par des souches de leurs donneurs respectifs. Néanmoins, la similarité acquise entre les microbiomes des donneurs et des patients n’a augmenté qu’au fil du temps chez les répondeurs. Les répondeurs ont connu un enrichissement en bactéries immunogènes et une perte de bactéries délétères après la TMF. Ces résultats montrent que la TMF à partir de donneurs sains est sûre en première intention et qu’elle mérite d’être étudiée plus avant en association avec des inhibiteurs de points de contrôle immunitaire.
Que sait-on déjà à ce sujet ?
Près de la moitié des patients atteints de mélanome avancé qui reçoivent un anti-PD-1 en monothérapie présentent une résistance primaire, ce qui souligne la nécessité d’élaborer de nouvelles stratégies thérapeutiques pour améliorer la réponse aux inhibiteurs de points de contrôle immunitaire (ICIs). Bien que l’association d’anti-PD-1 et d’anti-CTLA4 (cytotoxic T lymphocyte-associated antigen-4) augmente le taux de réponse, cette thérapie est limitée par un taux élevé d’effets indésirables liés à l’immunité (EI-Li). Le microbiome intestinal est apparu comme un régulateur essentiel des réponses immunitaires locales et systémiques. Plusieurs études chez des patients atteints de cancer et traités avec des ICI ont révélé que des bactéries intestinales spécifiques sont associées à la fois à la réponse et aux effets indésirables liés au système immunitaire [1]. Plus précisément, la présence de certains genres commensaux, comme Ruminococcus, Faecalibacterium et Eubacterium, a été associée à des résultats favorables chez les patients atteints de mélanome [2]. Le potentiel thérapeutique du microbiome intestinal a été démontré pour la première fois dans des modèles de souris combinant les ICIs avec TMF en utilisant des matières fécales provenant de patients non répondeurs (NR) qui ont été associés à la résistance aux ICIs [1]. Deux études ont montré que la TMF de patients ayant répondu à long terme à une thérapie ICI contourne la résistance à l’anti-PD-1 chez près de 30 % des patients atteints de mélanome réfractaire à l’ICI [3, 4]. Dans ces études, le microbiote des patients a changé après la TMF, et les patients répondeurs (R) ont montré une augmentation des Ruminococcaceae et des Bifidobacteriaceae en plus de la reprogrammation du microenvironnement tumoral avec une augmentation de l’infiltration des cellules T CD8+ et de la signalisation de l’interféron-γ. Ces résultats cliniques confirment le potentiel des interventions basées sur les microbiomes pour surmonter la résistance aux ICI dans le mélanome.
Quels sont les principaux résultats apportés par cette étude ?
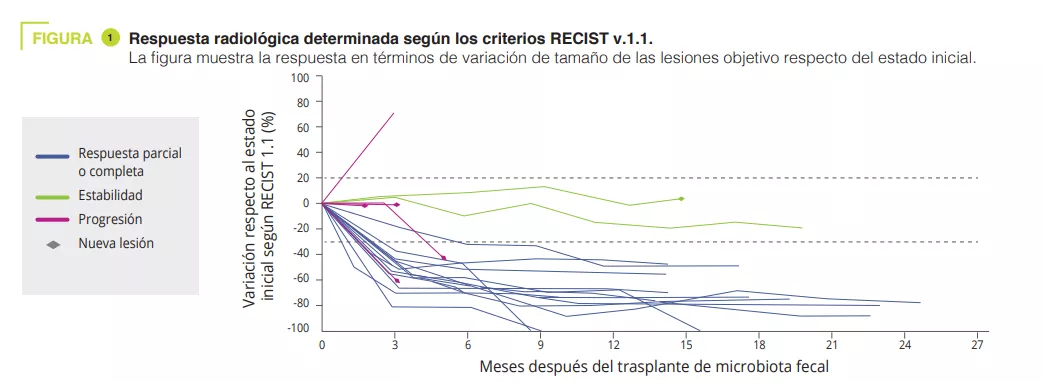
• Les auteurs rapportent ici les résultats cliniques et translationnels d’un essai de phase I (NCT03772899) combinant la TMF avec des matières fécales de donneurs sains et l’anti-PD-1 chez des patients atteints de mélanome avancé et n’ayant jamais été traités (figure 1). La toxicité observée (85 % de EI-Li, dont 25 % de toxicité de grade 3 et aucune toxicité de grade 4 ou 5) était similaire à celle des essais de phase III pour les anti-PD-1. L’efficacité clinique observée (réponse objective 65 %) était supérieure à celle du nivolumab ou du pembrolizumab en monothérapie dans les essais de phase III (réponse objective 42–45 %) et dans les données de vie réelle (réponse objective 17,2–51,6 %). Néanmoins, l’absence de bras contrôle et la petite taille de l’étude limitent l’interprétation de ces résultats.
Contrairement aux études précédentes [3, 4], les patient inclus étaient en première ligne de traitement, une seule TMF était réalisée par capsule orale, les donneurs étaient des sujets sains (et pas des patients répondeurs aux ICI) et enfin la préparation était faite uniquement par PEG (sans utilisation d’antibiotiques). En analysant le microbiote des donneurs et des receveurs, les auteurs ont observé que le microbiote des répondeurs s’enrichissait en Ruminococcus SGB15234 et SGB15229, Alistipes communis, Eubacterium ramuleus et Faecalibacterium SGB15346 alors que l’abondance de Enterocloster aldensis et Enterocloster clostridioformis diminuait. L’augmentation de Faecalibacterium était aussi associée avec la réponse à l’ICI dans les études précédentes [3, 4].
Les auteurs ont en ensuite réalisé des expériences avec des souris colonisées avec les microbiotes humains et ont reproduit l’efficacité de la transplantation fécale de sujets sains dans ce contexte, avec un effet associé à l’augmentation de l’infiltration de lymphocytes mémoire CD8+ T dans le microenvironnement tumoral.
Quelles sont les conséquences en pratique ?
Malgré ses limitations, cette étude suggère que la modulation du microbiote par TMF pourrait augmenter l’efficacité de l’ICI donnée en première ligne pour mélanome métastatique. Même si l’utilisation à grande échelle de la TMF semble difficile à envisager en pratique courante, la modulation du microbiote, notamment avec des probiotiques de nouvelle génération, pourrait à l’avenir devenir un standard en combinaison avec les ICI.
- Le microbiote intestinal joue un rôle dans la réponse aux ICI
- La TMF issue de donneurs sains est faisable et sans danger chez les patients traités par ICI en première ligne pour mélanome métastatique
- Malgré les limitations liées à l’absence de bras contrôle et la petite taille de l’étude, l’efficacité clinique observée chez les patients recevant une TMF en combinaison avec l’ICI était supérieure à celle des ICI en monothérapie dans les essais de phase III et dans les données de vie réelle
CONCLUSION
Cette étude montre que la TMF issue de donneurs sains est faisable et sans danger chez les patients traité par ICI en première ligne pour mélanome métastatique. La modulation du microbiote par TMF ou par d’autres méthodes pourrait augmenter l’efficacité des ICI et des études dédiées de plus grande taille et contrôlées sont nécessaires.
1. Routy B, Lenehan JG, Miller WH Jr, et al. Fecal microbiota transplantation plus anti-PD-1 immunotherapy in advanced melanoma: a phase I trial. Nat Med 2023; 29: 2121-32.
2. Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2018 ; 359 : 97–103.
3. Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021 ; 371 : 602–9.
4. Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science 2021 ; 371 : 595–602.