La diarrhée virale : les vaccins sont-ils capables de changer la donne ?
Les diarrhées virales se manifestent généralement sous la forme d’une diarrhée aqueuse et sont causées par cinq principaux types de virus. Parmi eux, le rotavirus demeure la principale cause de mortalité liée à la diarrhée chez les enfants de moins de 5 ans, et ce malgré la disponibilité de vaccins depuis 2006. La composition du microbiote intestinal (qui est impliquée dans l’issue de l’infection virale) et l'efficacité du vaccin contre le rotavirus pourraient jouer un rôle clé dans les stratégies visant à réduire la morbidité de la diarrhée virale.
Rotavirus, norovirus, sapovirus, astrovirus et adénovirus : cinq types de virus sont actuellement reconnus comme les principales causes de diarrhée virale.21
Sur les plus de 2 milliards d’épisodes de maladies diarrhéiques qui surviennent chaque année dans le monde, selon les estimations de l’étude GBD (Global Burden of Disease)2 de 2016, près de 900 millions d’épisodes modérés à sévères peuvent être attribués à seulement trois de ces virus : rotavirus, norovirus et adénovirus22.
LE ROTAVIRUS, PREMIÈRE CAUSE DE MORTALITÉ DIARRHÉIQUE CHEZ LES ENFANTS
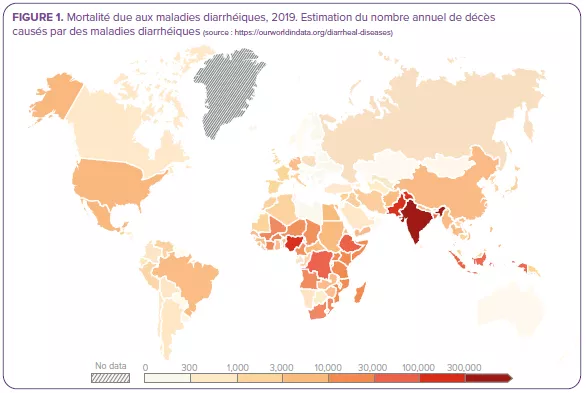
Malgré la mise au point de vaccins contre le rotavirus et leur disponibilité depuis 200622, ce virus, responsable de symptômes plus sévères que la plupart des autres pathogènes entériques22, était encore responsable de plus de 228 000 décès dans le monde en 2016, dont plus de 128 000 chez des enfants de moins de 5 ans2, ce qui en fait la principale cause de mortalité due à la diarrhée dans ce segment de la population (Figure 4).
LA DIARRHÉE AQUEUSE
Quel que soit le virus qui déclenche un épisode de diarrhée, le processus d’infection est globalement le même : le virus infecte les cellules épithéliales de l’intestin grêle et provoque des lésions qui entravent l’absorption des liquides.21 La diarrhée virale se manifeste généralement sous la forme d’une diarrhée aqueuse (non sanglante). Elle peut s’accompagner d’autres symptômes, comme des nausées, des crampes abdominales, des vomissements et de la fièvre,22 ce qui donne lieu à ce que l’on appelle une gastro-entérite virale.
RÉHYDRATATION... ET PROBIOTIQUES
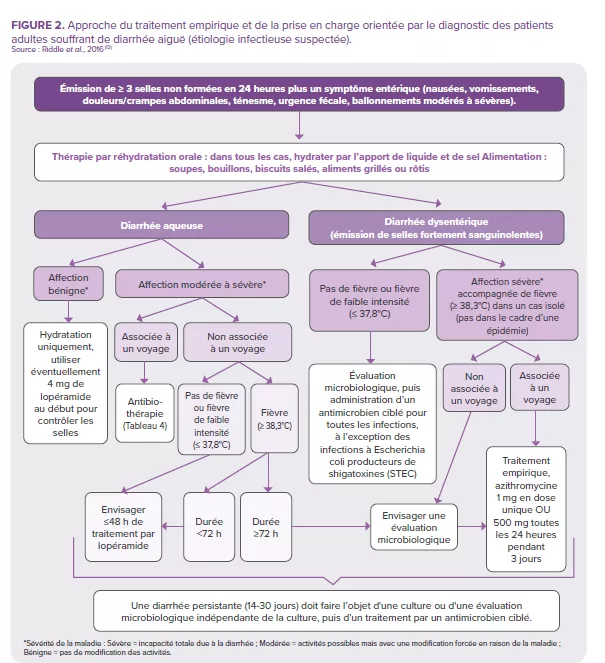
Tout comme pour les autres étiologies des diarrhées infectieuses (bactériennes ou parasitaires), la prise en charge des diarrhées virales repose sur une thérapie de réhydratation orale ou intraveineuse, en fonction du degré de déshydratation21. De plus, selon les dernières conclusions du comité de la ESPGHAN (2023)20, les professionnels de santé peuvent recommander certaines souches probiotiques (L. rhamnosus, S. boulardii et L. reuteri) pour la prise en charge de la gastro-entérite aiguë chez l'enfant, car il existe des preuves (degré de certitude des données probantes : faible ; degré de recommandation : faible) d’une réduction de la durée de la diarrhée, de la durée d’hospitalisation ou de la production de selles.
Parmi tous les pathogènes diarrhéiques, et malgré la disponibilité de vaccins, le rotavirus reste la première cause de mortalité chez les enfants de moins de cinq ans.2
L’AMÉLIORATION DE L’EFFICACITÉ DU VACCIN CONTRE LE ROTAVIRUS : UN DÉFI À RELEVER
En ce qui concerne la prévention, les mesures habituelles s’appliquent (garantir l’accès à l’eau potable, avoir une hygiène adéquate et se laver les mains fréquemment, limiter les contacts avec des personnes infectées, etc.). Compte tenu de la morbidité considérable des maladies diarrhéiques à rotavirus, les vaccins antirotavirus constituent une autre mesure préventive importante.22,23
LE SARS-COV-2 : BIENVENU AU CLUB DES VIRUS DIARRHÉIQUES
Outre les virus reconnus depuis longtemps comme des causes importantes de diarrhée virale, l’infection par le SARS-CoV-2, responsable de la plus grande pandémie de l’histoire récente (COVID-19) peut également donner lieu à des diarrhées. Dans les études cliniques, le taux d'incidence de la diarrhée varie de 2 à 50 % des cas.27 Comme pour les voies respiratoires, les cellules intestinales montrent une forte expression de récepteurs de l’enzyme de conversion de l’angiotensine 2 (ECA2) et constituent un important point d'entrée dans l’intestin pour le virus. Les mécanismes censés être à l’origine de la diarrhée impliquent principalement des dérèglements de l’enzyme de conversion de l’angiotensine 2 après l’entrée du virus dans l’entérocyte, ce qui déclencherait une réponse inflammatoire, un déséquilibre ionique et une augmentation de la perméabilité. En outre, la protéine « spike » du SRAS-CoV-2 agit comme une entérotoxine selon un mécanisme similaire à celui de l’entérotoxine NSP4 du rotavirus.28 On pense également que l’altération du microbiote intestinal et les effets indésirables des médicaments (antiviraux et antibiotiques) sont en cause.29

Le microbiote : un rôle clé dans l’efficacité de la vaccination contre le rotavirus
Depuis leur introduction en 2006, les vaccins oraux contre le rotavirus ont permis, à l’échelle mondiale, une chute significative du nombre d’hospitalisations et de décès dus à la diarrhée à rotavirus.30 Cependant, l’efficacité des vaccins est variable, les pays à faible revenu enregistrant de moins bonnes performance en comparaison avec l’efficacité remarquablement élevée (>90 %) que l’on observe dans les pays à revenu plus élevé.31 Les raisons de cette disparité seraient multifactorielles (immunité de l’hôte, paramètres périnataux, génétique, état nutritionnel, stress, consommation de tabac et d’alcool, mode de vie urbain ou rural, taille de la famille, etc.). Comme pour d’autres vaccins, la composition et la fonction du microbiote intestinal sont considérées comme un facteur clé de régulation de la réponse immunitaire à la vaccination30,32,33 (Figure 5).
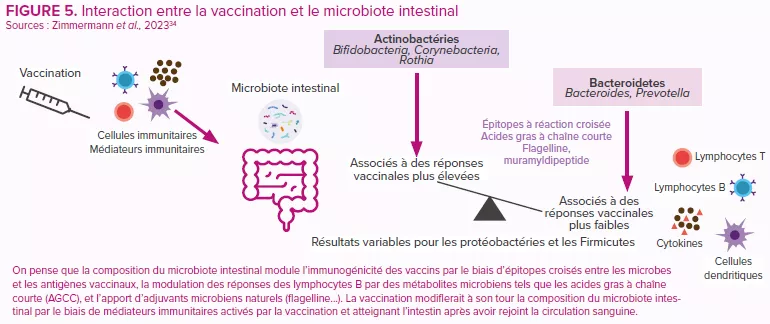
On estime à 139 000 le nombre de décès dus au rotavirus que ces vaccins ont permis d'éviter chez les enfants de moins de cinq ans au cours de la période 2006-2019, et à 15 % la proportion de décès dus au rotavirus évités chez les enfants de moins de cinq ans en 201924. Toutefois, l’efficacité du vaccin dépend de chaque région et le taux de séroconversion est faible dans les pays à revenu faible ou intermédiaire. Les résultats d’essais cliniques sur l’homme suggèrent l’existence d’un lien possible entre le microbiote intestinal et la réponse du système immunitaire entérique au vaccin contre le rotavirus25 (Figure 5).
On estime que chaque gramme de contenu intestinal humain contient au moins 108 à 109 particules pseudovirales, dont la grande majorité sont des phages.14
LE MICROBIOTE : UN ALLIÉ OU UN ADVERSAIRE DANS LE DÉCLENCHEMENT DE LA DIARRHÉE VIRALE ?
Dans les cas de diarrhée virale, comme dans les diarrhées infectieuses en général, l’issue de la confrontation entre le pathogène et l’hôte dépend d'équilibres complexes qui impliquent dans une large mesure le microbiote.
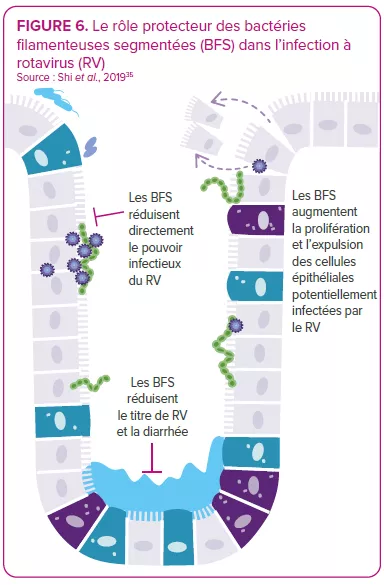
Le microbiote intestinal présente des interactions bidirectionnelles avec les infections à rotavirus et à norovirus14 : il peut soit protéger l’hôte contre l’infection, soit le prédisposer à celle-ci ; à son tour, une infection peut modifier le microbiote intestinal. Certaines bactéries semblent capables d’inhiber l’infection virale. Par exemple, une étude montre que des bactéries filamenteuses segmentées sont capables de prévenir et de guérir l’infection à rotavirus dans des colonies de souris35 (Figure 6). Par ailleurs, des études in vitro et in vivo indiquent que le microbiote intestinal facilite l’infection virale. En effet, certains microbes intestinaux (par exemple, Enterobacter cloacae) stimulent la capacité du norovirus à infecter les lymphocytes B humains in vitro ; l’élimination du microbiote par les antibiotiques retarde l’infection et réduit le pouvoir infectieux ou le titre viral du norovirus et du rotavirus chez la souris.8,36
Par conséquent, tout pathogène invasif exercerait des effets différents en fonction de l’état du microbiote intestinal.3 Il reste à caractériser le profil optimal du microbiote et à définir les stratégies de ciblage permettant de réduire le risque d’infection et la diarrhée virale qui s’ensuit.37
Quant à l’effet de l’infection virale sur la composition du microbiote intestinal, de nombreuses études ont documenté des schémas spécifiques de dysbiose chez les patients souffrant de diarrhée virale en comparaison avec des témoins en bonne santé25,38. Une réduction de la diversité (alpha) du microbiote est souvent rapportée, mais les augmentations ou diminutions de taxons spécifiques varient considérablement d’une étude à l’autre.14 Et une question demeure : la dysbiose observée au cours de la diarrhée virale reflète-t-elle une disposition antérieure qui aurait pu faciliter l’infection, ou au contraire s’agit-il d'un état causé par le virus, ou encore est-ce une combinaison de ces deux facteurs ?
CAS CLINIQUE par le docteur Marco Poeta
- Une fillette de 4 ans se présente aux urgences pédiatriques avec de la fièvre, de la diarrhée, des vomissements et une déshydratation sévère.
- L’état de l’enfant nécessitant une réhydratation intraveineuse, elle est hospitalisée.
- L’écouvillonnage rhinopharyngé se révèle positif au SRAS-CoV-2 malgré l’absence de symptômes respiratoires.
- Les selles sont négatives pour le rotavirus, le norovirus, l’adénovirus, les bactéries et les parasites, mais positives pour le SRAS-CoV-2.
- Après l'administration de probiotiques, la fréquence et la consistance des selles s’améliorent.
- La réhydratation intraveineuse est interrompue au bout de quatre jours et la fillette sort de l’hôpital.
- La diarrhée peut être la seule manifestation clinique de l’infection par le SRAS-CoV-2. Le SARS-CoV-2 devrait donc être ajouté à la liste des pathogènes entériques.
- L'efficacité des probiotiques contre la gastro-entérite associée au Covid que l’on a observée dans ce cas clinique a déjà été démontrée par des études in vitro.

POINT DE VUE DE L’EXPERT
Les probiotiques sont recommandés pour le traitement actif de la diarrhée virale chez les enfants, car ils exercent un effet antidiarrhéique en restaurant la composition du microbiote altéré. Dans les essais cliniques, certaines souches probiotiques atténuent la diarrhée sécrétoire en un laps de temps très court, la réduction étant mesurable à peine quelques heures après le début de l’administration du probiotique. Sachant qu’il faut normalement plusieurs jours pour modifier la composition du microbiote, l’efficacité rapide des probiotiques implique l’existence d’effets favorables supplémentaires. Les molécules sécrétées par les bactéries qui agissent directement sur les cellules intestinales inhiberaient la diarrhée sécrétoire par le biais d’un mécanisme antioxydant. C’est ce que l’on appelle « l’effet postbiotique ». Les métabolites produits par les probiotiques exercent une action de type pharmacologique et pourraient constituer des thérapies innovantes pour la prise en charge de la diarrhée virale.