Сьогодні екзема зустрічається втричі частіше, ніж 30 років тому і вражає до 20% дітей. Екзантема є найбільш поширеним дитячим шкірним захворюванням в індустріально розвинених країнах. Однак у більшості випадків екзема зникає в підлітковому віці, але тільки у 10-15% пацієнтів вона триватиме протягом всього життя.
Надмірна імунна відповідь
Екзема виникає через генетичну схильність, яка впливає на захисний шар шкіри. Це ослаблює бар'єрну функцію шкіри і дозволяє алергенам проникати всередину, спричиняючи надмірну імунну реакцію. Також у пацієнтів з екземою спостерігаються зміни у складі та різноманітності кишкової і шкірної мікробіоти.
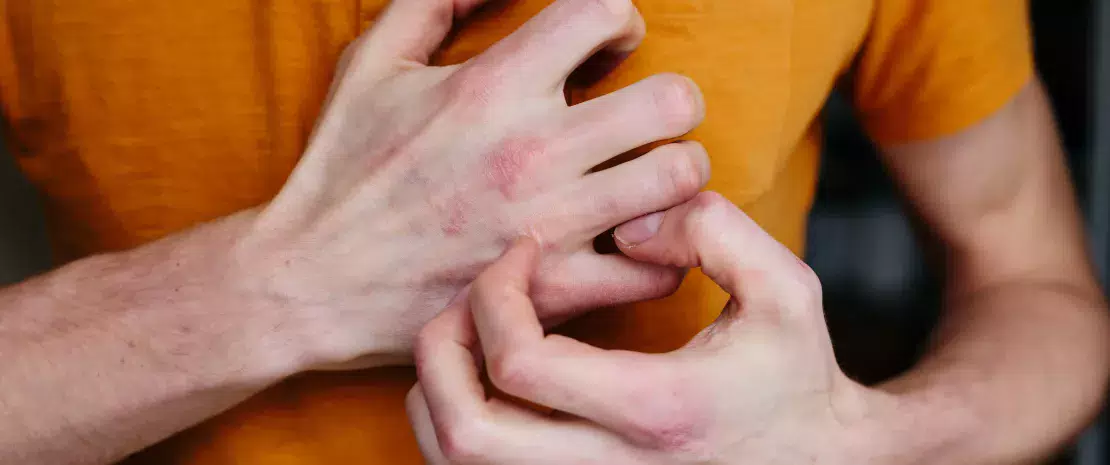
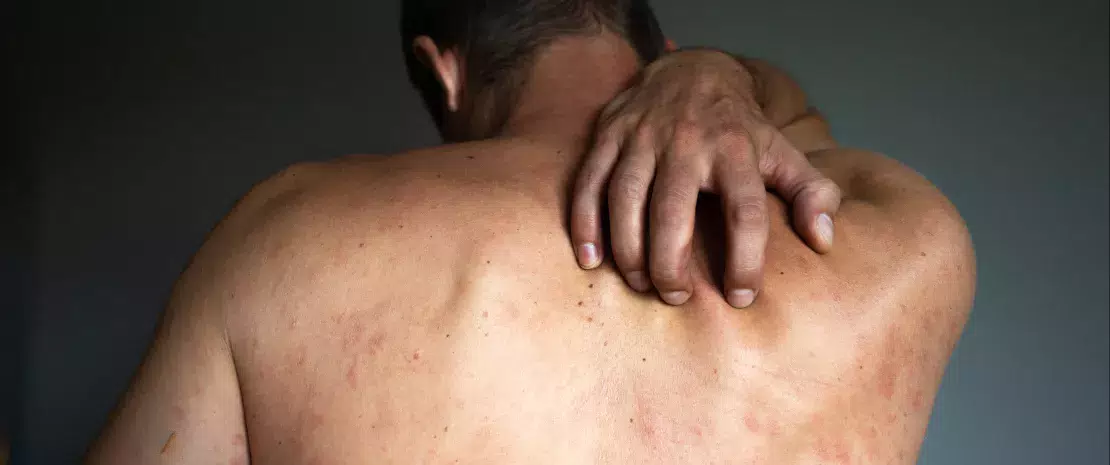
Екзема зазвичай починається в дитинстві, найчастіше між першим і третім місяцем життя. Симптоми включають грубу, суху шкіру та появу червоних плям, які надзвичайно сверблять під час запалення.
Обмежте подразнення шкіри
У першу чергу, лікування екземи спрямоване на те, аби зменшити подразнення шкіри. Ці заходи мають включати носіння одягу зробленого з бавовни, використання безмильних гелів для очищення шкіри, дбайливе миття тощо. Крім того, важливо використовувати зволожуючі креми і місцеві стероїди для зменшення шкірних подразнень. У більш важких випадках лікар може призначити короткочасні антигістамінні препарати для полегшення симптомів.
Пробіотики полегшують симптоми
Є ще один підхід, який полягає в корекції дисбалансу бактеріальної флори, відомого як дисбактеріоз, шляхом змін в мікробіоті кишківника та шкіри. Кілька досліджень показали, що пробіотики можуть полегшити симптоми екземи, особливо ті, які містять певні види лактобацил. Також, пробіотики можуть зменшити запалення кишківника у дітей, які страждають на цю хворобу. Як профілактичний захід, пробіотики можуть бути призначені вагітним жінкам, що може знизити ризик виникнення симптомів у майбутніх дітей.