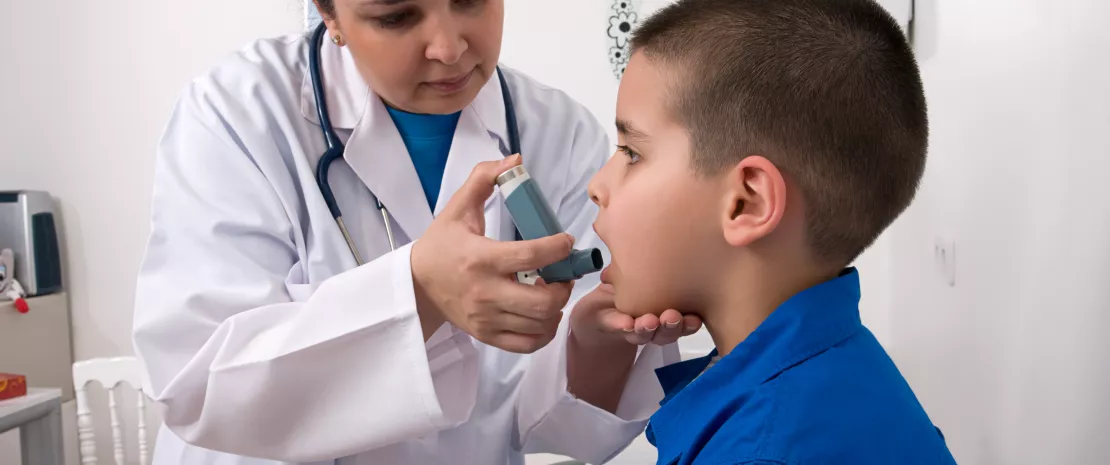
Менше антибіотиків, менше дисбактеріозу, менше дитячої астми
Зменшення дитячої астми, що спостерігається в останні роки, вважається неочікуваним позитивним ефектом зменшення призначення антибіотиків серед немовлят. Одним із можливих пояснень є зменшення дисбактеріозу кишківника.

Дитяча астма вражає 8% молодих американців і канадців. Його поширеність подвоїлася в другій половині 20-го століття, але тенденція, схоже, змінюється. Чи пов’язане це зниження зі зменшенням кількості призначених антибіотиків і, як результат, сприятливим впливом на кишкову мікробну спільноту? Щоб перевірити цю гіпотезу, автори проаналізували державні дані про діагнози астми та призначення антибіотиків у (sidenote: Data from the BC PharmaNet government database, which collects data from all health centers in the province (database population: 4.7 million) ) (Канада), а також кишкову мікробіоту 2 644 дітей, які беруть участь у когортному (sidenote: Canadian CHILD Cohort Study Canadian Healthy Infant Longitudinal Development study, a prospective study of children recruited before birth between 2008 and 2012 ) .
Менше антибіотиків означає менше випадків астми
На популяційному рівні між 2000 і 2014 роками захворюваність на астму серед дітей від одного до чотирьох років впала на 7,1% в абсолютному вираженні, з 27,3% до 20,2%, згідно з даними уряду Канади. За цей же період значно зменшилось призначення антибіотиків дітям до року (з 1253,8‰ до 489,1‰). У 2014 році кожній третій дитині (34,8%) принаймні один раз призначали антибіотики до досягнення однорічного віку, порівняно з двома з трьох дітей (66,9%) у 2000 році. Статистичний аналіз показує зв’язок між призначенням антибіотиків і астмою: частота астма зростає на 24% з кожним 10% збільшенням призначення антибіотиків. Ця тенденція, що спостерігається на популяційному рівні, також була виявлена на індивідуальному рівні в когорті CHILD. Після виключення дітей, які отримували антибіотики через респіраторні проблеми, діагноз астми у п’ятирічному віці був більш частим серед дітей, які отримували антибіотики у віці до одного року. Крім того, захворюваність на астму зросла зі збільшенням кількості рецептів: 5,2% без рецепта, 8,1% для одного, 10,2% для двох і 17,6% для трьох і більше антибактеріальних засобів.
Антибіотики є надзвичайним науковим відкриттям, яке рятує мільйони життів, але їх надмірне та невідповідне використання зараз викликає серйозні занепокоєння для здоров’я, зокрема через резистентність до антибіотиків та дисбактеріоз мікробіоти. Давайте поглянемо на цю спеціальну сторінку:
Амбівалентна роль антибіотиків
Рольмікробіоти
На думку авторів, дисбактеріоз кишкової мікробіоти у немовлят може пояснити зв'язок між впливом антибіотиків та дитячою астмою. Діти з астмою п'ятирічного віку мали меншу різноманітність мікробіоти кишківника аніж малюки-однорічки. Зниження різноманіття залежало від частоти застосування антибактеріальних засобів та більш раннім віком призначення (наприклад, різке зниження відбувалось, якщо антибіотик застосовувався до трьохмісячного віку дитини). Менша різноманітність була пов’язана зі зменшенням п’яти ключових груп бактерій, зокрема двох видів, які беруть участь у виробництві імуномодулюючих коротколанцюгових жирних кислот. Таким чином, зменшення певних видів бактерій може вплинути на розвиток імунної системи дітей, роблячи їх сприйнятливими до алергії. Звідси потенційна цінність стратегій, спрямованих на збереження різноманітності мікробіоти після застосування антибіотиків та необхідність обережного використання антибіотиків у дітей віком до одного року.
Що таке Всесвітній тиждень обізнаності про антимікробні засоби?
Кожен рік, починаючи з 2015 року, ВООЗ організовує Всесвітній тиждень обізнаності про протимікробні препарати (WAAW), метою якого є підвищення обізнаності про глобальну стійкость до протимікробних препаратів.
Така кампанія проводиться між 18 та 24 листопада, закликає широку громадськість, медичних працівників і осіб, які приймають рішення, обережно використовувати антимікробні препарати, щоб запобігти подальшій появі антимікробної резистентності.