ИЗМЕНЕНИЕ В ВОСПРИЯТИИ
Функциональные расстройства ЖКТ воспринимаются как постыдные во многих культурах, они долго считались частным делом и связывались со стрессом и ощущениями, а не с легкоузнаваемыми органными проблемами. Восприятие изменилось в 1960-х годах благодаря техническим и научным достижениям: работы по этиологии и патофизиологии послужили основой для понимания органной основы ФГИР. В последующие десятилетия «исключительно физиологическое» понимание данной патологии постепенно дополнялось и углублялось пониманием психосоциальных процессов, в конечном итоге была достигнута стандартная современная биопсихологическая модель.
РИМ, КОЛЫБЕЛЬ КЛАССИФИКАЦИИ
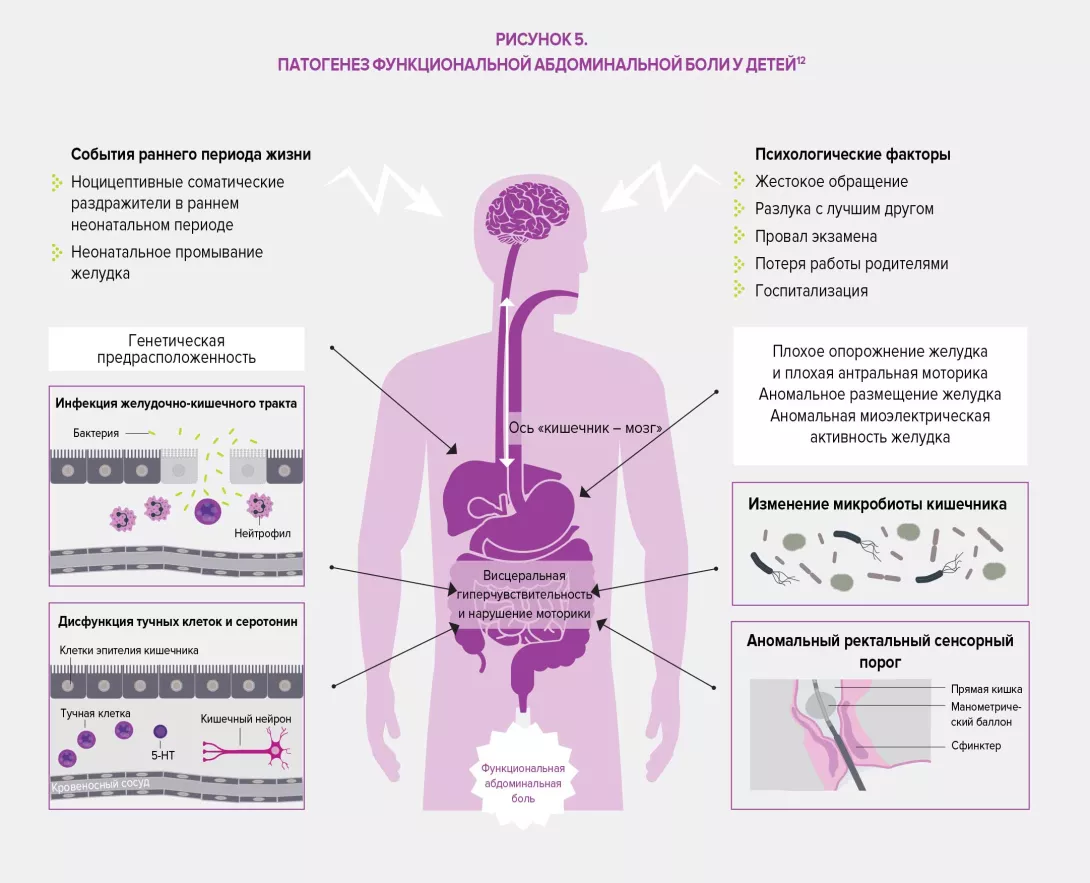
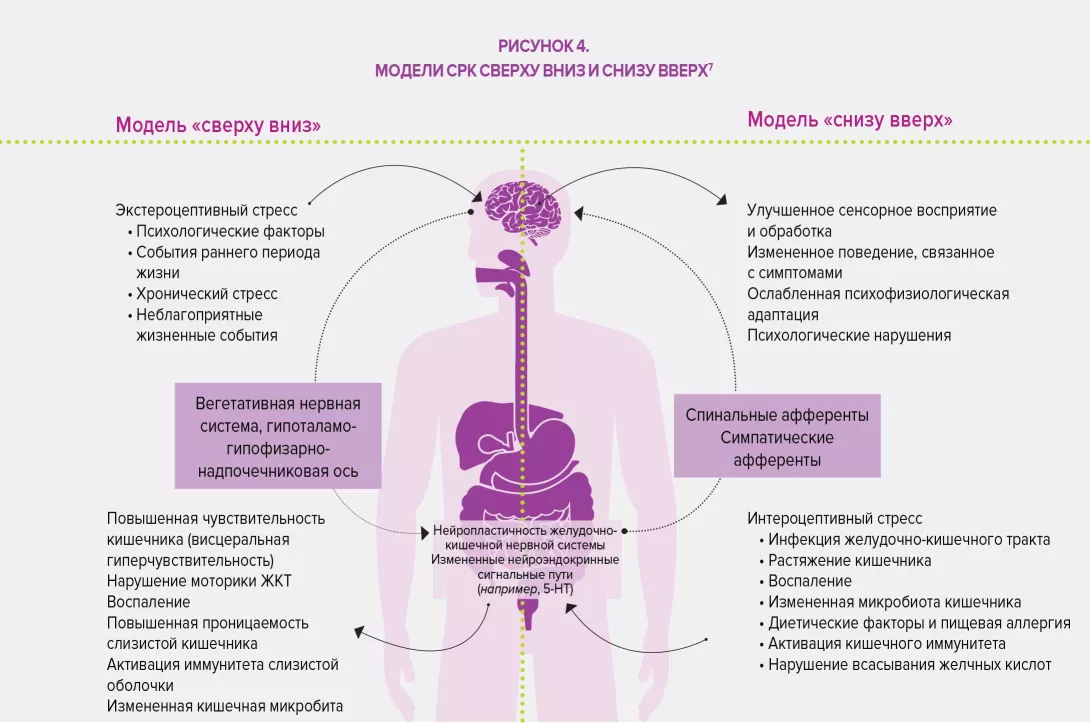
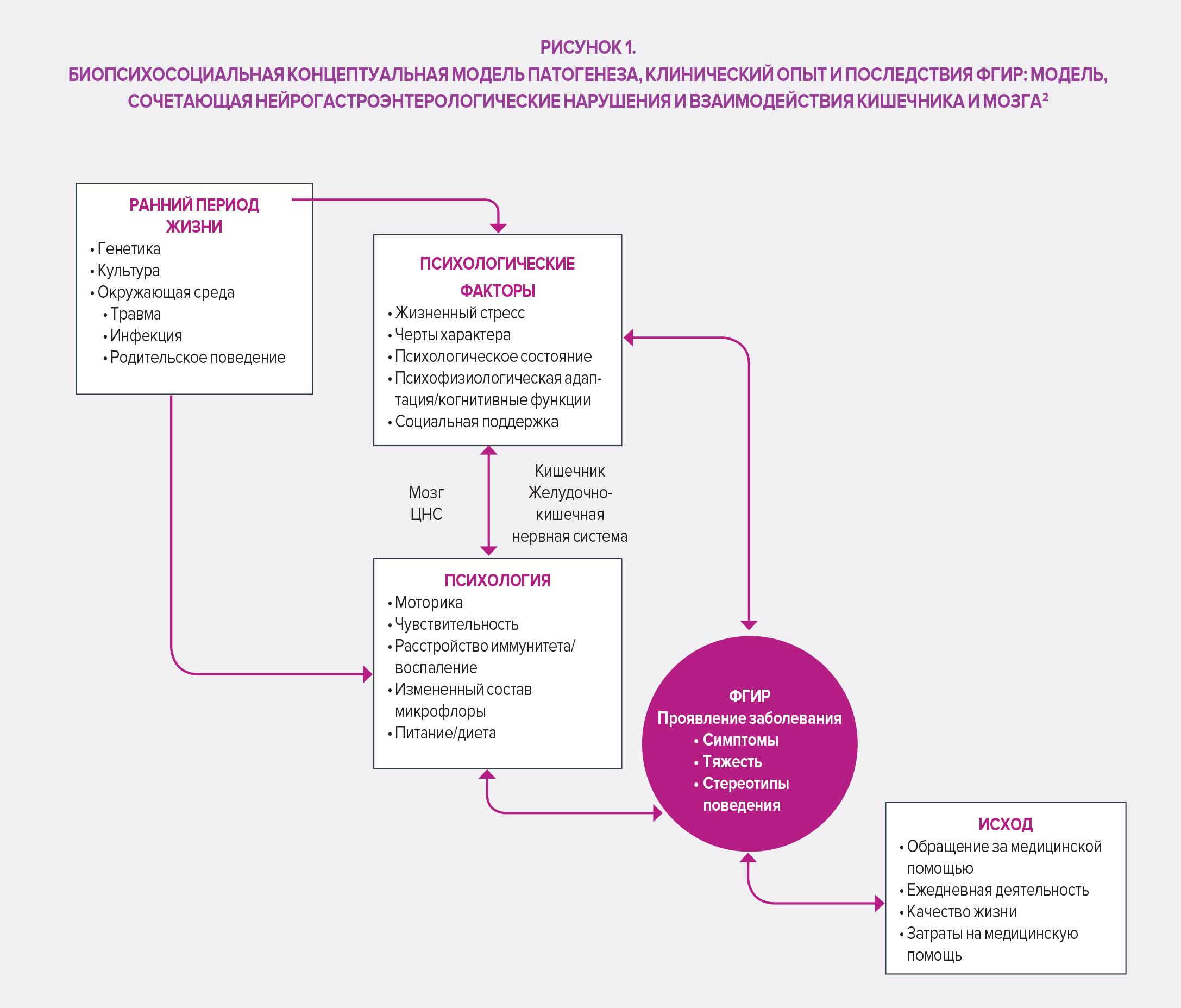
В четвертом издании своей известной работы (Римские критерии IV) Римский фонд предлагает определение ФГИР, совместно разработанное группой экспертов: они включают нарушения по оси «кишечник – мозг», то есть «группу заболеваний, классифицированных на основе симптомов желудочно-кишечного тракта, связанную с комбинацией следующих симптомов: нарушение моторики ЖКТ, висцеральная гиперчувствительность, нарушение слизистого барьера и иммунной функции, изменение состава микробиоты кишечника и нарушения со стороны центральной нервной системы».
53 РАЗЛИЧНЫХ ТИПА ФГИР
Классификация Римских критериев IV основана на симптоматических критериях, сгруппированных по анатомической области (пищеводная, гастродуоденальная, кишечная, желчная и аноректальная). Тем не менее классификация симптомов по принципу локализации сама по себе является недостаточной особенно в отношении синдрома раздраженного кишечника (СРК), функциональной диспепсии или абдоминального болевого синдрома (его трудно локализовать и он подвержен влиянию системных воздействий, что приводит к нарушению сигнальных путей между центральной и кишечной нервными системами), опосредованных центральной нервной системой. 33 пункта классификации у взрослых и 20 у новорожденных, детей и подростков обеспечивают точный диагноз и облегчают осуществление целенаправленного ухода за пациентами. В этой связи Римский фонд подчеркнул важность того, чтобы не ограничивать терапевтические подходы только медикаментозным лечением, и рекомендует биопсихосоциальный подход к решению проблемы вариабельности случаев и индивидуальных ожиданий пациентов, страдающих ФГИР.

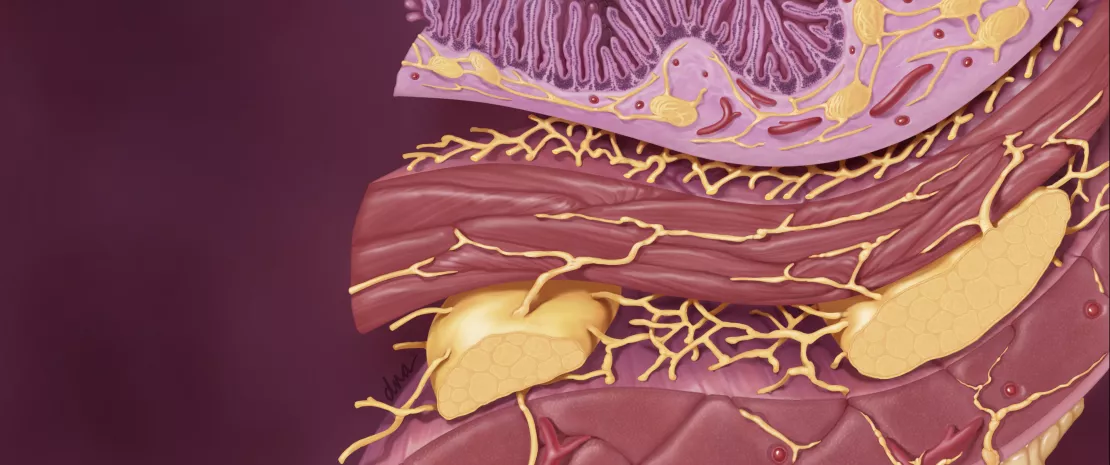
МИКРОБИОТА: ГЛАВНЫЙ ИГРОК В КИШЕЧНИКЕ3,4
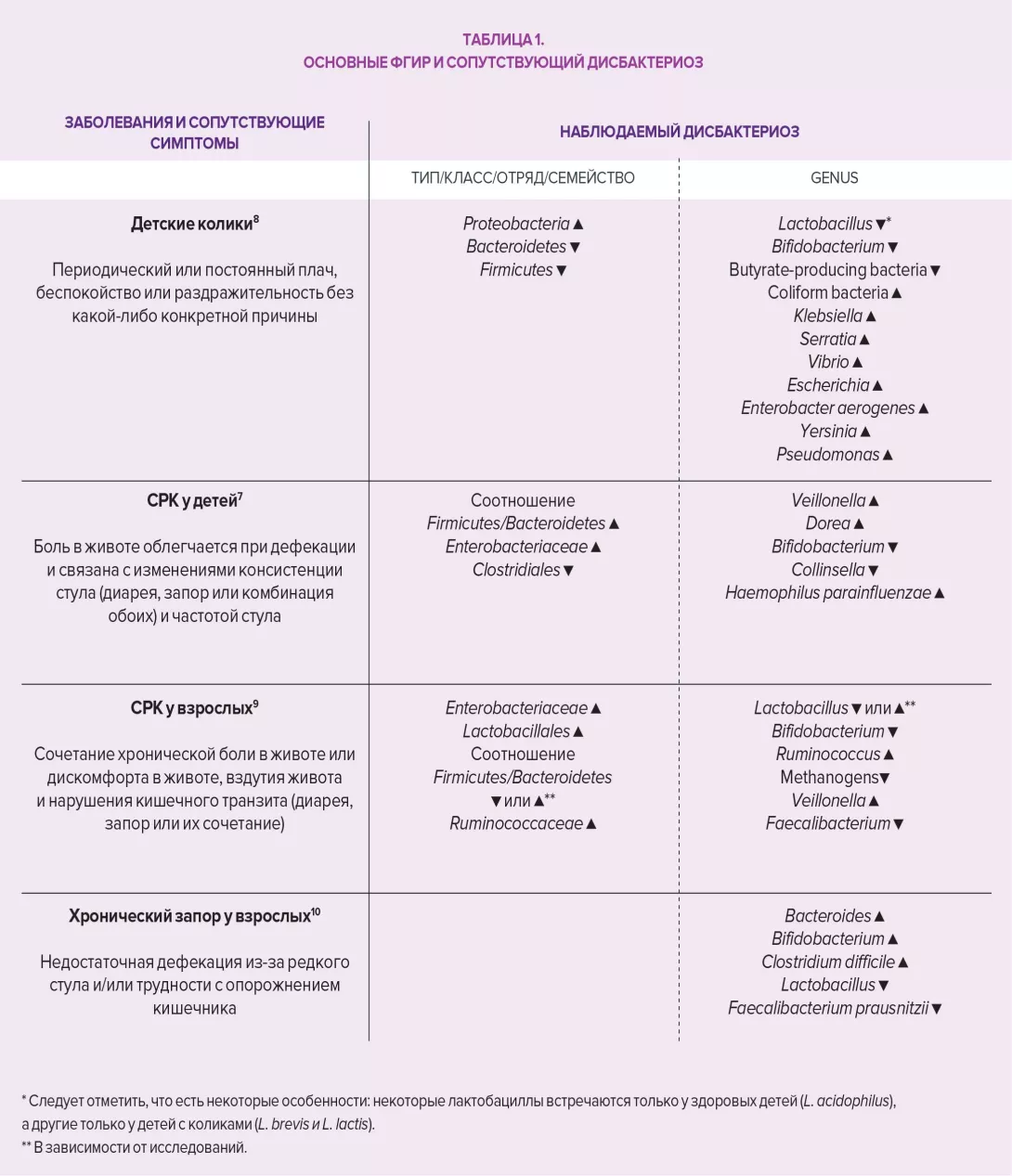
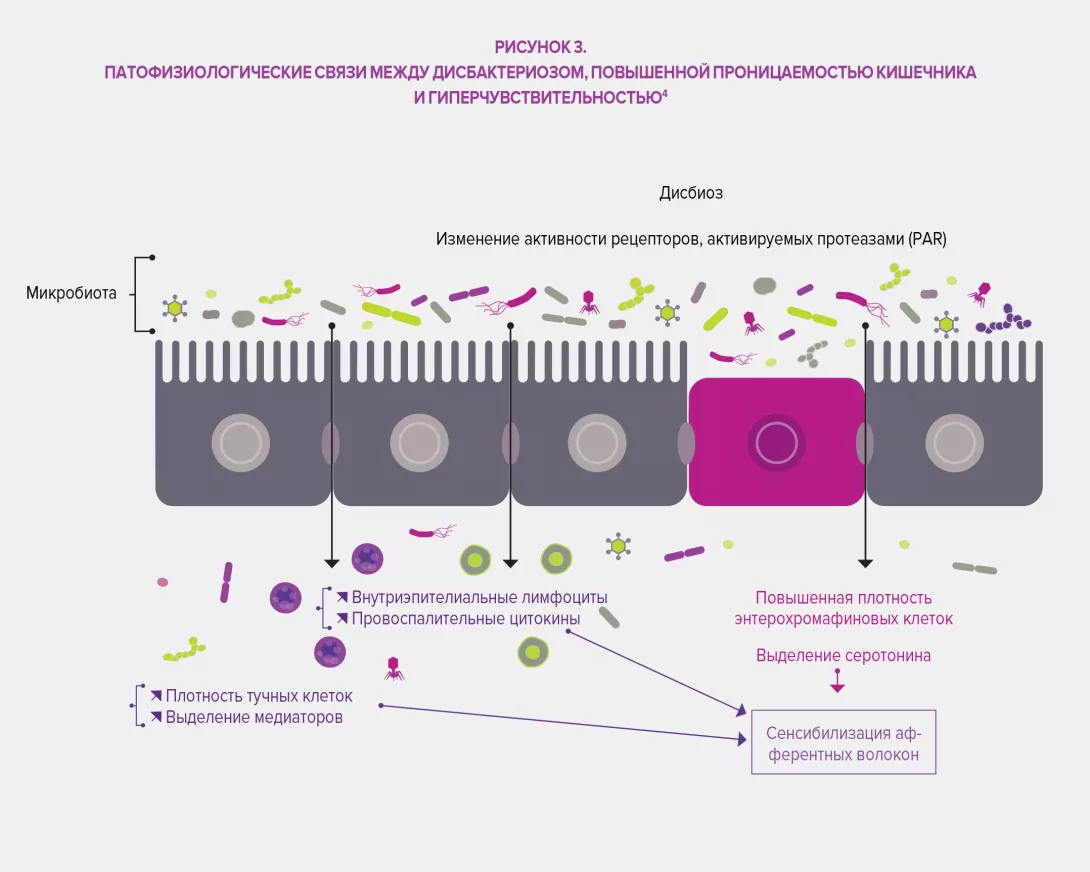
Микробиота кишечника оказывает комплексное влияние на обмен веществ, питание и иммунные функции организма хозяина. Ее изменения играют основную роль в развитии ФГИР. Дисбиоз был специально изучен в отношении СРК, исследования на животных показали, что этот дисбаланс может быть связан с наблюдаемой висцеральной гиперчувствительностью (через эндолюминальные желчные кислоты), а также при нарушении моторики ЖКТ посредством экспрессии ферментов, участвующих в синтезе нейромодуляторов (например, гаммааминомасляной кислоты [ГАМК]) и продуктов ферментации в толстой кишке (газовые или короткоцепочечные жирные кислоты, SCFA). Наконец, дисбиоз, по-видимому, способствует нарушению кишечного барьера: повышенная проницаемость кишечника улучшает проникновение бактериальных антигенов, ответственных за неспецифическое воспаление, что приводит к сенсибилизации сенсорных афферентных волокон кишечной нервной системы.
ПЕРСПЕКТИВНЫЙ ПОДХОД
Неоднородность ФГИР и противоречивые результаты с точки зрения бактериального состава в зависимости от исследований и методов не позволяют использовать микробиоту и ее метаболиты в качестве соответствующих маркеров для диагностики, мониторинга прогрессирования заболевания или ответа на лечение. Литературные данные, однако, подтверждают важность разнообразия и состава кишечной микробиоты в патофизиологии ФГИР и, следовательно, потенциальное влияние терапевтических подходов, связанных с модуляцией кишечных бактериальных популяций.