Sarcopenia: implicación de la microbiota intestinal en la pérdida funcional y de masa de los músculos esqueléticos
¿Se puede atribuir el debilitamiento muscular de los ancianos (sarcopenia) a alteraciones estructurales y funcionales de la microbiota intestinal? Esto es muy probable según un estudio reciente que se concentró en el poco conocido eje intestino-músculo en una población de ancianos chinos. ¿Una pista prometedora para envejecer con buena salud?
La microbiota intestinal Se confirma la implicación de la microbiota oral en la enfermedad de Alzheimer Alzheimer: influencia de la disbiosis intestinal en la enfermedad amiloide Artritis reumatoide: alteración de la microbiota intestinal desde los estadios incipientes de la enfermedad
Cuando la taurina «energetiza» a la microbiota intestinal frente a los patógenos
Ante una infección, el huésped produce taurina, un nutriente que alimenta a la microbiota y permite la eliminación de patógenos. De esta manera, la taurina estimula una resistencia duradera frente a nuevas infecciones.
La microbiota intestinal Fibromialgia: la microbiota intestinal muestra un perfil característico de la enfermedad La microbiota intestinal podría bloquear los efectos de algunos antidepresivos Exposición a los antibióticos entre el nacimiento y los 6 años de edad: perturbación de la microbiota intestinal y alteración del desarrollo del niño
Covid-19 y pérdida del olfato: rehabilitación olfativa y microbiota nasal, ¿dos vías para recuperar el olfato?
La pérdida del olfato es un síntoma común de la COVID-19. Este trastorno, especialmente desconcertante, también es muy invalidante para las personas afectadas. Se están realizando estudios que combinan una rehabilitación olfativa diaria y una investigación de la microbiota nasal para ayudar a los pacientes a recuperar el olfato.
La microbiota ORL La alimentación
Endolisinas recombinantes contra la vaginosis bacteriana
Un estudio demostró que gracias a las endolisinas recombinantes derivadas de profago, es posible eliminar la biopelícula bacteriana responsable de la vaginosis bacteriana, sin dañar a las bacterias beneficiosas de la microbiota vaginal. Unos resultados prometedores.
La microbiota vaginal ¿La microbiota vaginal como marcador de la progresión del papilomavirus? Papel de las microbiotas vaginal, uterina e intestinal en la endometriosis
Dr. Markus Egert : Probióticos, una opción terapéutica complementaria
Markus Egert es profesor de Microbiología e Higiene en la Universidad de Ciencias Aplicadas de Furtwangen (Alemania). Sus principales ámbitos de investigación son la microbiota humana (intestino y piel) y la microbiota del entorno edificado. Estudió biología y ecología, y trabajó durante 4 años en el sector de los bienes de consumo y cosméticos.
La microbiota cutánea Dermatitis atópica: correlación entre la severidad de la enfermedad y las microbiotas nasal y cutánea Papel de la microbiota en la comunicación entre el intestino y el cerebro Exposición a los antibióticos entre el nacimiento y los 6 años de edad: perturbación de la microbiota intestinal y alteración del desarrollo del niño
Modular la microbiota cutánea mediante soluciones orales
La existencia de un eje intestino-piel sugiere la posibilidad de modular la microbiota intestinal para influir en la microbiota cutánea, esto es, administrando soluciones orales de prebióticos y probióticos.
La microbiota cutánea Dermatitis atópica: correlación entre la severidad de la enfermedad y las microbiotas nasal y cutánea Papel de la microbiota en la comunicación entre el intestino y el cerebro Exposición a los antibióticos entre el nacimiento y los 6 años de edad: perturbación de la microbiota intestinal y alteración del desarrollo del niño
Lactobacillus bacteria, computer illustration.
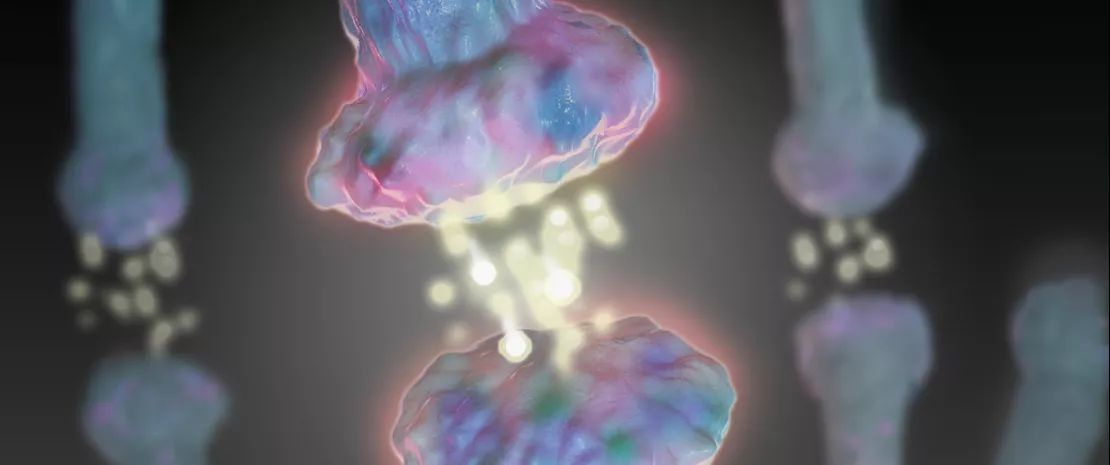
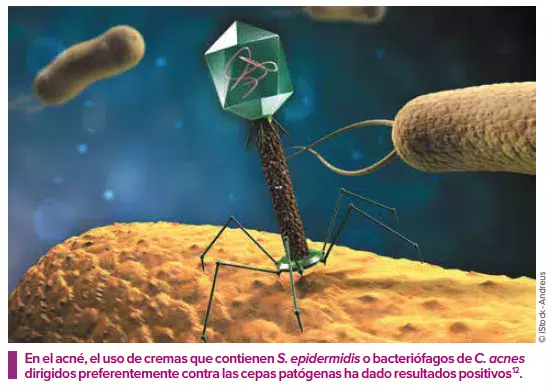
Modular la microbiota cutánea mediante aplicaciones tópicas
Prevenir y tratar la disbiosis, sin eliminar forzosamente a los patógenos: las nuevas estrategias terapéuticas pretenden reequilibrar directamente la microbiota cutánea gracias a aplicaciones tópicas o indirectamente mediante soluciones orales que modulen el ecosistema intestinal.
La microbiota cutánea Dermatitis atópica: correlación entre la severidad de la enfermedad y las microbiotas nasal y cutánea Papel de la microbiota en la comunicación entre el intestino y el cerebro Exposición a los antibióticos entre el nacimiento y los 6 años de edad: perturbación de la microbiota intestinal y alteración del desarrollo del niño
Staphylococcus epidermidis
Autismo: el intestino al mando
El intestino a menudo se considera como nuestro segundo cerebro. Y con razón, porque está íntimamente relacionado con el primero. La calidad de la microbiota intestinal, barómetro de nuestro estado de ánimo, nuestro comportamiento e incluso de nuestra salud mental, interviene en la intensidad de los síntomas de ciertas enfermedades neurobiológicas, como los trastornos autistas.
La microbiota intestinal Los trastornos del espectro autista
 ¿La ansiedad crónica posiblemente influenciada por bacterias intestinales?
¿La ansiedad crónica posiblemente influenciada por bacterias intestinales?
Bibliografia:
Bjørklund G, Pivina L, Dadar M, et al. Gastrointestinal alterations in autism spectrum disorder: What do we know? Neurosci Biobehav Rev. 2020 Nov;118:111-120. doi: 10.1016/j.neubiorev.2020.06.033. Epub 2020 Jul 1.
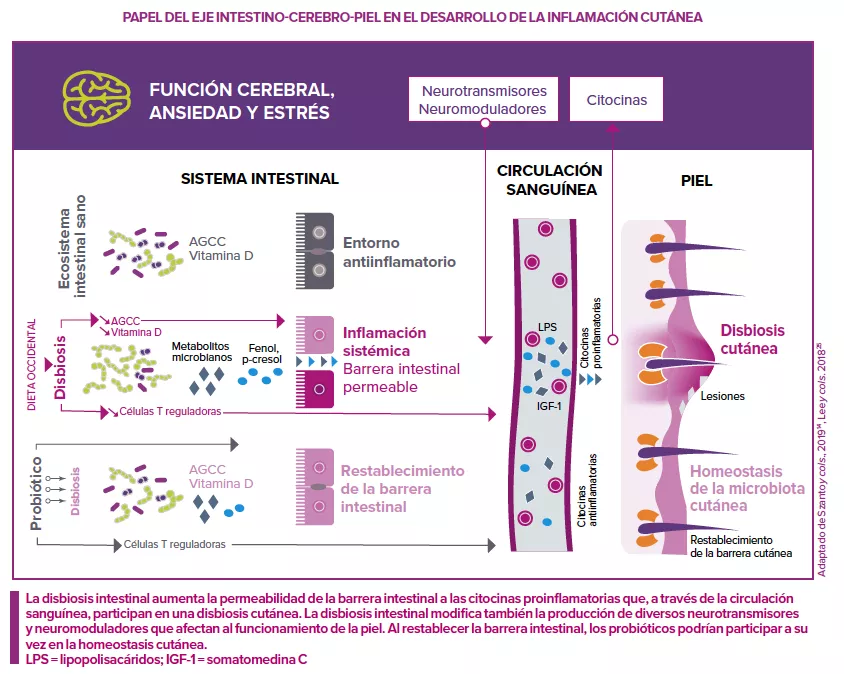
¿Un eje intestino-cerebro-piel?