Diarrea asociada a los antibióticos
Los antibióticos constituyen una herramienta poderosa en la lucha contra las infecciones bacterianas. Aunque los tratamientos a veces parecen desarrollarse sin efectos secundarios evidentes a corto plazo, el desequilibrio de la microbiota intestinal que producen en los pacientes puede provocar diarrea hasta en el 35% de ellos.1-3 Esta diarrea asociada a los antibióticos en ocasiones puede ocultar una infección intestinal grave.3
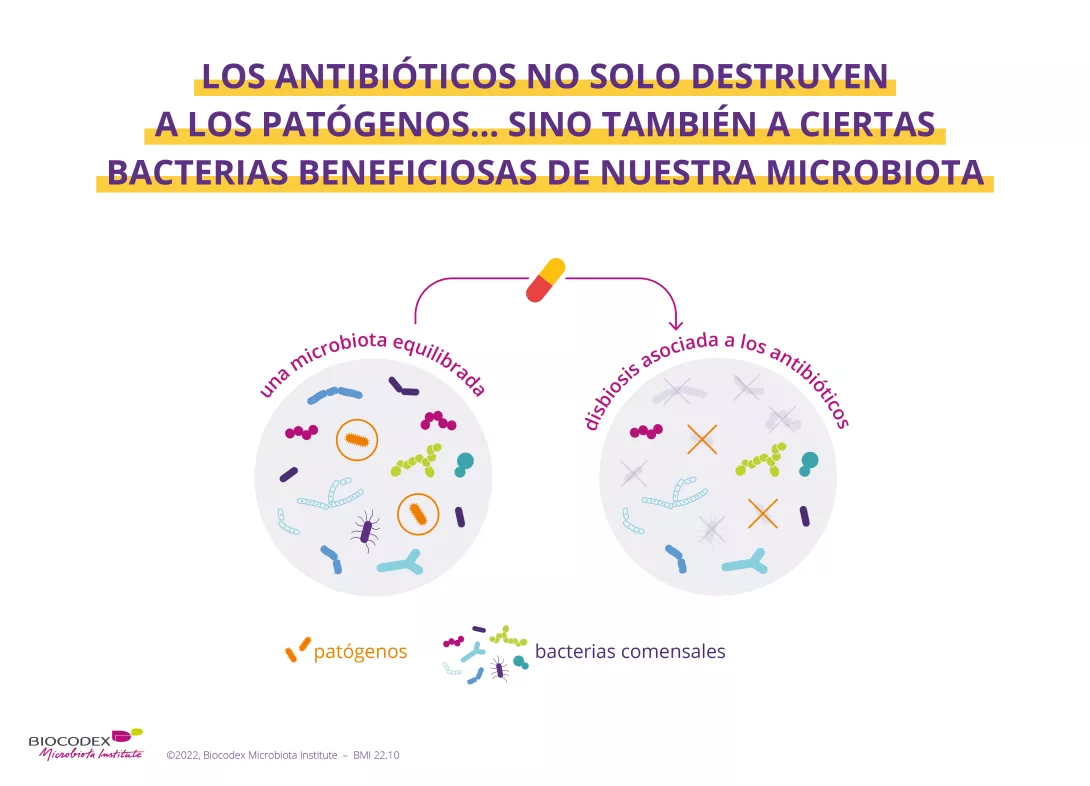
¿Cuál es el mecanismo por el que los antibióticos desequilibran la microbiota intestinal?
Aunque los antibióticos son capaces de erradicar los microorganismos (sidenote: Patógeno Un patógeno es un microorganismo que causa, o puede causar, una enfermedad. Pirofski LA, Casadevall A. Q and A: What is a pathogen? A question that begs the point. BMC Biol. 2012 Jan 31;10:6. ) responsables de la infección, también pueden destruir algunas bacterias beneficiosas de la microbiota y provocan sistemáticamente un desequilibrio más o menos importante de este ecosistema. Este fenómeno, conocido con el término de (sidenote: Disbiosis La disbiosis no es un fenómeno homogéneo ya que varía en función del estado de salud de cada individuo. Se define generalmente como una alteración de la composición y funcionamiento de la microbiota, provocada por un conjunto de factores ambientales y relacionados con el individuo, que alteran el ecosistema microbiano. Levy M, Kolodziejczyk AA, Thaiss CA, et al. Dysbiosis and the immune system. Nat Rev Immunol. 2017;17(4):219-232. ) , sería el origen de la diarrea asociada a los antibióticos, ya que la microbiota intestinal sería menos capaz de cumplir con sus funciones protectoras. Esto puede afectar hasta al 35% de los pacientes1-3 y, en los niños, este porcentaje puede llegar al 80%.1

Además, la microbiota intestinal, a pesar de cierto grado de resiliencia (es decir que vuelve a una composición cercana a la que tenía antes del desequilibrio inducido por los antibióticos), a veces puede no restablecerse por completo.4,5 Investigaciones recientes mostraron que los antibióticos pueden alterar la diversidad y la abundancia de las bacterias, y que este desequilibrio puede ser prolongado (generalmente de 8 a 12 semanas después de la interrupción del tratamiento).1,6
En la mayoría de los casos, una diarrea sin otros síntomas
La principal consecuencia a corto plazo de un tratamiento antibiótico es la modificación del tránsito intestinal en algunos pacientes, que provoca generalmente una diarrea. Esta se define por la emisión de al menos tres deposiciones muy blandas a líquidas, en las 24 horas siguientes al inicio de un tratamiento antibiótico o hasta 2 meses después de su interrupción.7-9 La incidencia de la diarrea asociada a los antibióticos depende de varios factores (edad, contexto, tipo de antibióticos, etc.). En la gran mayoría de los casos, la diarrea es de origen funcional, es decir, se asocia al desequilibrio de la microbiota intestinal y suele ser de intensidad leve a moderada.1 Los antibióticos que presentan el espectro más amplio de actividad antimicrobiana (es decir que ejercen sus efectos en una gran variedad de bacterias) se asocian a una mayor incidencia de diarrea.3
¡Los antibióticos salvan vidas! ¿Sabía que también afectan a su microbiota? ¿Sabía que un mal uso o un abuso de los antibióticos puede generar una resistencia a estos medicamentos? ¿Ha oído hablar de la Semana mundial de concienciación sobre la RAM (WAAW)? Encontrará todas las respuestas en esta página dedicada al tema :
Antibióticos: ¿qué impacto en la microbiota y en nuestra salud?
Sin embargo, en el 10 al 20% de los casos, la diarrea se debe a una infección por Clostridioides difficile (C. difficile), una bacteria que puede volverse patógena bajo la influencia de ciertos factores, como la toma de antibióticos, por ejemplo, pero también una edad superior a 65 años o ciertas enfermedades asociadas...3 La colonización de la microbiota intestinal por parte de esta bacteria desencadena una reacción inflamatoria, con consecuencias clínicas que van de una diarrea moderada a síntomas mucho más graves e incluso la muerte.3
Interrupción del tratamiento con antibióticos: ¿la medida más eficaz?
El tratamiento de la diarrea asociada a los antibióticos depende de los síntomas y del patógeno implicado (por ejemplo, C. difficile).10 En el caso de una diarrea leve a moderada, el tratamiento consiste en suspender la administración del antibiótico causal (o reemplazarlo por un antibiótico con menos riesgo de provocar diarrea) con el fin de favorecer la restauración de la microbiota y la rehidratación del paciente.10
Numerosos estudios muestran que los probióticos son útiles en el proceso de reconstitución de la microbiota intestinal; algunos probióticos tienen una eficacia demostrada para prevenir y tratar la diarrea asociada a los antibióticos.6,11,12 Otros se toman durante el tratamiento antibiótico para reducir el riesgo de primera infección por C. difficile y las infecciones recurrentes.13-15 Por último, el trasplante de microbiota fecal, que consiste en implantar por vía natural una microbiota sana en un individuo enfermo para restablecer su ecosistema microbiano, por el momento se limita a los casos más graves: está indicado exclusivamente para las recaídas de infecciones causadas por la bacteria patógena C. difficile.16,17
Este artículo procede de fuentes científicas validadas, pero no sustituye a la consulta médica. En caso de síntomas, no dude en consultar a su médico de cabecera o al pediatra de sus hijos.
¿Qué es la Semana mundial de concienciación sobre la RAM?
"Cada año, desde 2015, la OMS organiza la Semana mundial de concienciación sobre la RAM (WAAW por sus siglas en inglés), cuyo objetivo es fomentar la sensibilización sobre la resistencia global antimicrobiana.
La resistencia antimicrobiana se produce cuando las bacterias, los virus, los parásitos y los hongos cambian con el tiempo y dejan de responder a los medicamentos. Debido a la resistencia a los fármacos, los antibióticos y otros medicamentos dejan de ser efectivos y las infecciones son cada vez más difíciles o incluso imposibles de tratar, lo que aumenta el riesgo de propagación de las enfermedades, de sufrir dolencias graves y de muerte.
Esta campaña, que se desarrolla del 18 al 24 de noviembre, anima al público en general, a los profesionales de la salud y a los responsables políticos a usar los antibióticos, los antivirales, los antifúngicos y los antiparasitarios con cuidado, para prevenir la aparición de nuevas resistencias antimicrobianas. "
1 McFarland LV, Ozen M, Dinleyici EC et al. Comparison of pediatric and adult antibiotic-associated diarrhea and Clostridium difficile infections. World J Gastroenterol. 2016;22(11):3078-3104.
2 Bartlett JG. Clinical practice. Antibiotic-associated diarrhea. N Engl J Med 2002;346:334-9.
3 Theriot CM, Young VB. Interactions Between the Gastrointestinal Microbiome and Clostridium difficile. Annu Rev Microbiol. 2015;69:445-461.
4 Dethlefsen L, Relman DA. Incomplete recovery and individualized responses of the human distal gut microbiota to repeated antibiotic perturbation. Proc Natl Acad Sci U S A. 2011;108 Suppl 1(Suppl 1):4554-4561.
5 Francino MP. Antibiotics and the Human Gut Microbiome: Dysbioses and Accumulation of Resistances. Front Microbiol. 2016;6:1543.
6 Kabbani TA, Pallav K, Dowd SE et al. Prospective randomized controlled study on the effects of Saccharomyces boulardii CNCM I-745 and amoxicillin-clavulanate or the combination on the gut microbiota of healthy volunteers. Gut Microbes. 2017;8(1):17-32.
7 Wiström J, Norrby SR, Myhre EB, et al. Frequency of antibiotic-associated diarrhoea in 2462 antibiotic-treated hospitalized patients: a prospective study. J Antimicrob Chemother. 2001 Jan;47(1):43-50.
8 McFarland LV. Epidemiology, risk factors and treatments for antibiotic-associated diarrhea. Dig Dis. 1998 Sep-Oct;16(5):292-307.
9 Bartlett JG, Chang TW, Gurwith M, et al. Antibiotic-associated pseudomembranous colitis due to toxin-producing clostridia. N Engl J Med. 1978 Mar 9;298(10):531-4.
10 Barbut F, Meynard JL. Managing antibiotic associated diarrhoea. BMJ. 2002 Jun 8;324(7350):1345-6.
11 Szajewska H, Kołodziej M. Systematic review with meta-analysis: Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea. Aliment Pharmacol Ther. 2015 Oct;42(7):793-801.
12 Hempel S, Newberry SJ, Maher AR, et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis. JAMA. 2012 May 9;307(18):1959-69.
13 McFarland LV, Surawicz CM, Greenberg RN, et al. A randomized placebo-controlled trial of Saccharomyces boulardii in combination with standard antibiotics for Clostridium difficile disease. JAMA. 1994 Jun 22-29;271(24):1913-8.
14 Kotowska M, Albrecht P, Szajewska H. Saccharomyces boulardii in the prevention of antibiotic-associated diarrhoea in children: a randomized double-blind placebo-controlled trial. Aliment Pharmacol Ther. 2005 Mar 1;21(5):583-90.
15 McFarland LV. Probiotics for the Primary and Secondary Prevention of C. difficile Infections: A Meta-analysis and Systematic Review. Antibiotics (Basel). 2015 Apr 13;4(2):160-78.
16 Surawicz CM, Brandt LJ, Binion DG, et al. Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections. Am J Gastroenterol. 2013 Apr;108(4):478-98; quiz 499.
17 Li YT, Cai HF, Wang ZH, et al. Systematic review with meta-analysis: long-term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther. 2016 Feb;43(4):445-57.
BMI-21.28
 Antibióticos, microbiota del niño y salud a largo plazo
Antibióticos, microbiota del niño y salud a largo plazo