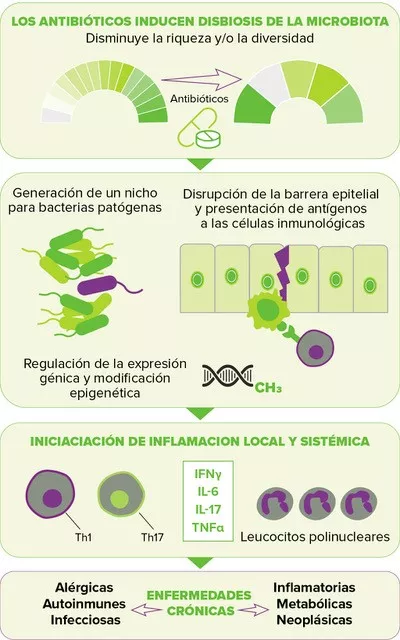
Durante mucho tiempo considerada principalmente como una fuente de infección, hoy en día, la microbiota de la piel humana se acepta comúnmente como un importante impulsor de la salud y el bienestar1. Al promover la respuesta inmunológica como mecanismo de defensa, desempeña un papel clave en la reparación de los tejidos y en las funciones de barrera al inhibir la colonización o la infección por microbios patógenos oportunistas2.
Para cada sitio de la piel, su propia microbiota
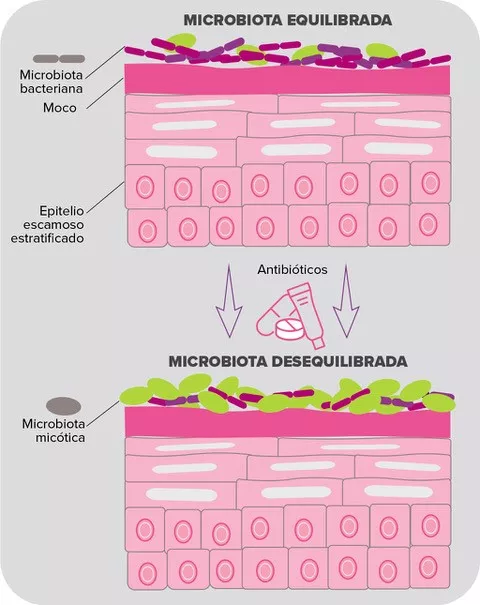
La microbiota de la piel alberga millones de bacterias, así como también hongos y virus en menor abundancia relativa. Corynebacterium, Cutibacterium (antes conocida como Propionibacterium), Staphylococcus, Micrococcus, Actinomyces, Streptococcus y Prevotella son los géneros de bacterias más comunes que se encuentran en la piel humana3. Sin embargo, la abundancia relativa de taxones bacterianos depende en gran medida del microambiente local del área de piel concreta que se esté considerando, y especialmente de sus características fisiológicas, es decir, si es sebácea, húmeda o seca. Por consiguiente, las especies lipofílicas de Cutibacterium dominan los sitios sebáceos, mientras que las especies de Staphylococcus y Corynebacterium son particularmente abundantes en las zonas húmedas4.
De la fisiología a la patología: el rol ambivalente de C. acnes
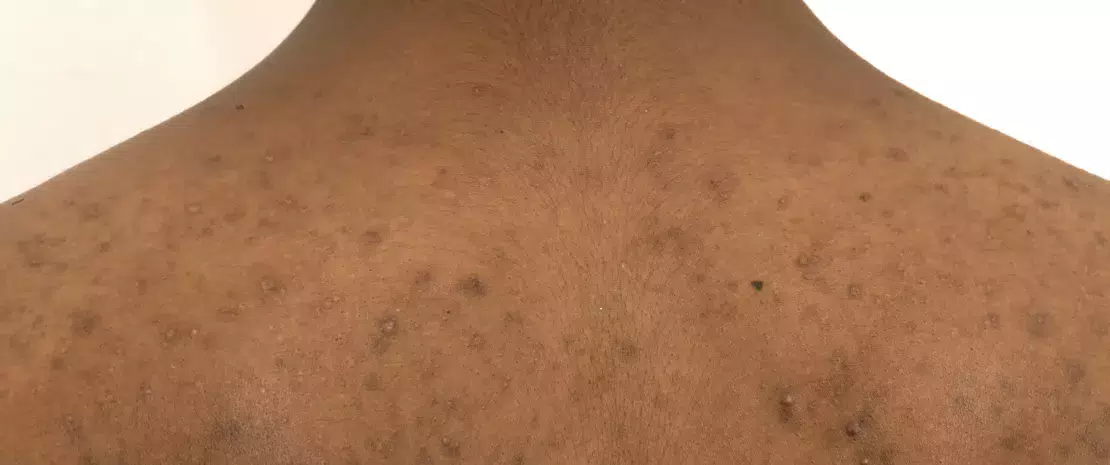
El anaerobio aerotolerante C. acnes es una de las especies bacterianas más abundantes en el microbioma de la piel. Ha estado implicado en el acné, un trastorno inflamatorio crónico de la piel con una patogénesis compleja5. A diferencia de lo que se pensaba anteriormente, hay estudios recientes indican que la hiperproliferación de C. acnes no es el único factor implicado en el desarrollo del acné6. De hecho una pérdida de equilibrio entre las diferentes cepas de C. acnes, junto con una disbiosis de la microbiota de la piel, provocaría el acné6. Además, las interacciones entre S. epidermidis y C. acnes son de importancia crucial en la regulación de la homeostasis de la piel: S. epidermidis inhibe el crecimiento de C. acnes y la inflamación de la piel. A su vez, C. acnes, al secretar ácido propiónico que participa, entre otras cosas, en el mantenimiento del pH ácido del folículo pilosebáceo, inhibe el desarrollo de S. epidermidis. Se cree que Malassezia, el hongo cutáneo más abundante, también desempeña un papel en el acné refractario al reclutar células inmunitarias, aunque es necesario seguir explorando su implicación6.
El tratamiento del acné: una importante fuente de resistencia a los antibióticos
A pesar de que se utilizan habitualmente para tratar el acné, los antibióticos tópicos y orales han demostrado ser problemáticos de varias maneras. Una primera preocupación expresada por los expertos es la alteración de la microbiota de la piel, aunque los datos precisos sobre el tema siguen siendo escasos. En este sentido, un reciente estudio longitudinal comparó la microbiota de las mejillas de 20 pacientes con acné antes y después de seis semanas de tratamiento con doxiciclina oral. Curiosamente, la exposición a los antibióticos se asoció a un aumento de la diversidad bacteriana; según los autores, esto podría deberse a una disminución de la colonización por C. acnes, que liberaría espacio para permitir el crecimiento de otras bacterias7.
Sin embargo, la preocupación más importante sobre el uso de antibióticos para el tratamiento del acné se refiere a la resistencia bacteriana.. Observada por primera vez en la década de 1970, ha sido una de las principales preocupaciones de la dermatología desde los años 808. La resistencia de C. acnes es, con mucho, la más documentada: los últimos datos apuntan a que las tasas de resistencia alcanzan más del 50 % para la eritromicina en algunos países, el 82-100 % para la azitromicina y el 90 % para la clindamicina. En cuanto a las tetraciclinas, aunque siguen siendo muy eficaces contra la mayoría de las cepas de C. acnes, sus tasas de resistencia están aumentando y oscilan entre el 2 % y el 30 % en diferentes regiones geográficas9. Y la resistencia a los antibióticos no se limita a C. acnes : mientras que los antibióticos tópicos utilizados por los pacientes con acné (especialmente como monoterapia) han demostrado aumentar la aparición de bacterias cutáneas resistentes como S. epidermidis, los antibióticos orales se han asociado al aumento de la aparición de S. pyogenes orofaríngea resistente a los antibióticos10,8. Además, se ha informado de que el aumento de las tasas de infección de las vías respiratorias superiores y de faringitis está relacionado con el tratamiento antibiótico del acné11,12.
Un llamado a un uso limitado de antibióticos en los casos de acné
Las posibles consecuencias de la resistencia a los antibióticos desencadenada por el tratamiento del acné son numerosas: fracaso del propio tratamiento del acné (véase el caso clínico), infección por microbios patógenos oportunistas (a nivel local o sistémico) y propagación de la resistencia entre la población8. A pesar de ello, las cantidades de recetas de antibióticos para el acné siguen siendo elevadas y de mayor duración que la recomendada en las directrices13. En este contexto de crecientes preocupaciones, los especialistas llaman a un uso más limitado de los antibióticos en el tratamiento del acné13. En particular, la Alianza Mundial para Mejorar los Resultados del Acné ha propuesto una estrategia al respecto (véase el recuadro a continuación).
 Exposición a los antibióticos entre el nacimiento y los 6 años de edad: perturbación de la microbiota intestinal y alteración del desarrollo del niño
Exposición a los antibióticos entre el nacimiento y los 6 años de edad: perturbación de la microbiota intestinal y alteración del desarrollo del niño