El impacto de la microbiota de los padres en la salud de los hijos
Revisión de prensa
Par le Pr. Markku Voutilainen
Facultad de medicina de la Universidad de Turku; gastroenterología, Hospital Universitario de Turku, Finlandia



Revisión de prensa
Par le Pr. Markku Voutilainen
Facultad de medicina de la Universidad de Turku; gastroenterología, Hospital Universitario de Turku, Finlandia

El intestino del niño es colonizado por las bacterias vaginales y fecales de la madre en el trascurso de un parto vaginal. La colonización microbiana del intestino empieza durante la vida fetal, aunque su papel es aun objeto de debate. Según la hipótesis de los orígenes del desarrollo de la salud y de las enfermedades (Developmental Origins of Health and Disease, DOHaD), es posible que las condiciones de vida fetal tengan un impacto en los primeros estadios de la vida del recién nacido y que sus perturbaciones aumenten el riesgo de enfermedades crónicas en el niño.
El profesor Friedman analizó la programación del desarrollo [1]. La obesidad, la diabetes y la alimentación occidental en la madre tienen un impacto en las células madre, el sistema inmunitario y la microbiota intestinal del niño. El intestino del recién nacido es colonizado, en primer lugar, por microorganismos aerobios y anaerobios facultativos, que a su vez son sustituidos por anaerobios estrictos. Este fenómeno modifica la señalización inmunitaria innata, las respuestas inmunitarias de las células T auxiliares y la tolerancia a las endotoxinas. La obesidad materna puede perturbar la colonización microbiana normal y aumentar el riesgo ulterior de enfermedades inmunológicas y metabólicas. La toma de antibióticos durante el embarazo aumenta el riesgo de obesidad en el niño. Los hijos de madres obesas presentan una menor cantidad de dos familias de proteobacterias fecales. Además, una alimentación rica en grasas en la madre provoca una pérdida de bacterias clave y disminuye la diversidad bacteriana de la microbiota fecal del niño.
El régimen alimenticio del padre también puede tener un impacto en el estado de salud de las siguientes generaciones. Zhang et al. han estudiado el impacto de una alimentación desequilibrada en un modelo animal [2]. Alimentaron a ratones machos de dos generaciones sucesivas (F0 y F1) con alimentos ricos en grasas, en sacarosa y en sal. El grupo control recibió una alimentación normal. La alimentación enriquecida se asoció a niveles más elevados de aspartato-aminotransferasa en la generación siguiente (F2). Una alimentación desequilibrada también se ha asociado a un peso corporal más elevado. En las hembras de la generación F2, el índice de Shannon de la microbiota intestinal indicaba una diversidad significativamente superior. La variación de la abundancia del género bacteriano se ha asociado a anomalías de la función hepática. La alimentación desequilibrada de las generaciones F0 y F1 se asoció a un aumento de los niveles séricos de colesterol y de lipoproteínas en los ratones macho de la generación F2.
Estos datos sugieren que una alimentación desequilibrada en los padres conlleva una disbiosis de la microbiota intestinal en los niños y que podría aumentar los riesgos de sobrepeso y de diferentes enfermedades crónicas (diabetes de tipo 2, enfermedades hepáticas y cardiovasculares).
De vuelta del congreso
Por el Pr. Francisco Guarner
Unidad de investigación sobre el sistema digestivo, Hospital Universitaria Vall d’Hebron, Barcelona, España

En su 8ª edición el pasado mes de marzo, el Gut Microbiota for Health World Summit 2019 otorgó un papel protagonista a la alimentación y a la manera en como interactúa con el microbioma intestinal, previniendo o favoreciendo enfermedades.
La alimentación es un elemento esencial de las interacciones simbióticas entre los microbios intestinales y el huésped. Se considera como uno de los principales factores que conforman la microbiota intestinal a lo largo de la vida, según la revisión realizada por Jack A. Gilbert (UC, San Diego), Susan Devkota (Cedars-Sinai, Los Ángeles) y Lipping Zhao (Rutgers, Nueva Jersey). Los alimentos aportan numerosos sustratos para el metabolismo microbiano y la microbiota digestiva es una fábrica química que sintetiza los metabolitos importantes para la salud humana. Los macro y micronutrientes influyen en la estructura y las funciones del ecosistema microbiano intestinal. De hecho, la alimentación resulta ser el factor de impacto más importante en la construcción de una composición microbiana compartida en los seres humanos [1].
Los datos declarativos de los participantes en el proyecto American Gut relacionado con la alimentación [2] sugieren que el número de especies vegetales únicas consumidas tiene más influencia en la diversidad microbiana que los datos declarativos de los participantes del tipo “vegetariano” u “omnívoro”. Se ha descubierto una diversidad microbiana más elevada y una mayor abundancia de especies productoras de ácidos grasos de cadena corta (AGCC) en personas que consumen más de 30 tipos de plantas a la semana frente a las que comen menos de 10 tipos de plantas por semana. El metaboloma fecal también era diferente entre los dos grupos. Además, las personas que consumían más de 30 tipos de plantas presentaban una abundancia de genes de resistencia a los antibióticos significativamente menor respecto de las personas que consumían como máximo 10 tipos de plantas.
La disbiosis intestinal es un estado definible con implicaciones mecánicas. No corresponde a un simple cambio de la diversidad microbiana, sino a una ruptura del equilibrio recíproco entre la microbiota y el huésped, en la que una alimentación inadecuada desempeña un papel nocivo. En caso de homeostasis, el metabolismo de los colonocitos se orienta hacia una fosforilación oxidativa, que lleva aparejada un elevado consumo epitelial de oxígeno. La hipoxia epitelial resultante contribuye a mantener una comunidad microbiana dominada por los anaerobios obligatorios, que han resultado ser beneficios gracias a la conversión de las fibras en productos de fermentación (AGCC) absorbidos por el huésped. Los factores que modifican el metabolismo del epitelio, como una alimentación pobre en fibras, aumentan la oxigenación epitelial, produciendo así un aumento de los anaerobios facultativos, un elemento característico de la disbiosis cólica [3]. Este cambio de composición, común a numerosas enfermedades crónicas en los humanos, podría estar asociado a la disfunción de los colonocitos. Como destacó Susan Devkota, si se elige un régimen alimenticio estricto o extremo, el consumo de fibras mixtas puede conservar la microbiota y prevenir las carencias de nutrientes.
Lipping Zhao señaló que nuestros antepasados consumían muchas más fibras alimenticias que nosotros. La reducción de los aportes de fibras y la disminución de la prevalencia de las bacterias productoras de AGCC podrían explicar numerosas enfermedades crónicas como la diabetes de tipo 2. En un ensayo de intervención, controlado y aleatorizado, realizado en pacientes chinos con diabetes de tipo 2 [4], unos aportes elevados de diversas fibras alimenticias (régimen WTP) favorecieron de manera selectiva la abundancia de un grupo de cepas productoras de ácido acético y de ácido butírico en el intestino. El régimen WTP se basa en el consumo de cereales completos, de alimentos medicinales tradicionales chinos y de prebióticos. El régimen WTP mejoró la homeostasis de la glucosa reduciendo la hemoglobina glicada, la glucemia en ayunas y la hiperglucemia provocada por vía oral.
La abundancia de productores de AGCC en las heces correspondía a los resultados metabólicos y a los niveles en sangre del péptido similar al glucagón tipo 1 y del péptido YY, que inducen la secreción de insulina. Además, la reducción del pH fecal mediante la producción de AGCC se ha asociado a la inhibición de las bacterias nocivas que favorecen la inflamación y suprimen la producción del péptido similar al glucagón tipo 1. Además de proporcionar AGCC que son directamente beneficiosos para el huésped, este grupo de productores de AGCC ejercía funciones ecológicas importantes en la microbiota intestinal. Lipping Zhao sugirió que se trata como de una especie de “gremio de fundadores” para estructurar la microbiota intestinal sana. Para ayudar a los pacientes a recuperar una microbiota intestinal sana, “este gremio de fundadores debe reinocularse y restablecerse”, señaló.
Según la revisión realizada por Magnus Simren (Universidad de Göteborg), actualmente un 85 % de los médicos recomienda un régimen pobre en oligosacáridos, disacáridos, monosacáridos y polioles fermentables (fermentable oligosaccharides, disaccharides, monosaccharides and polyols, FODMAP) para el tratamiento de los trastornos funcionales del intestino. Los ensayos clínicos sugieren que ciertos pacientes tienen una respuesta favorable a corto plazo a un régimen pobre en FODMAP, pero no hay certeza de que esta pauta alimenticia sea claramente mejor que el tratamiento alimenticio de primera intención para el SCI. En concreto, la administración a corto plazo de un régimen pobre en FODMAP se ha asociado a cambios potencialmente desfavorables de la composición de la microbiota intestinal, en concreto una disminución de las especies que participan en la fermentación (Bifidobacterium, Faecalibacterium y Clostridium grupo XIVa) y un aumento de las puntuaciones del índice de disbiosis [5].
Un ensayo controlado aleatorizado comparó los efectos del régimen pobre en FODMAP y de los galactosacáridos (GOS) prebióticos en la composición de la microbiota intestinal [6]. Las evoluciones de la microbiota fecal fueron diferentes entre los dos grupos después de un periodo de 4 semanas de tratamiento, en concreto a nivel de las bífidobacterias (aumento en el grupo prebiótico y disminución en el grupo pobre en FODMAP) y Bilophila wadsworthia (perfil opuesto).
A pesar de estos efectos diferentes sobre la microbiota, las reducciones de los síntomas fueron muy similares en los dos grupos. Es interesante señalar que la disminución de los síntomas persistió durante el seguimiento de las 2 semanas posteriores a la suspensión del consumo de prebióticos, mientras que los síntomas reaparecieron inmediatamente después de suspender el régimen pobre en FODMAP. La modulación de la microbiota intestinal como estrategia terapéutica en el SCI parece prometedora, pero su inocuidad a largo plazo es un parámetro que hay que tener en cuenta. Los regímenes que reducen los síntomas pero deterioran la salud intestinal (y la salud general a largo plazo) no deben ser la primera elección.
La septicemia en la primera infancia es responsable de un millón de fallecimientos al año en todo el mundo, la mayoría de ellos en países en vías de desarrollo. Pinaki Panigrahi presentó un estudio de intervención para prevenir la septicemia en lactantes en la India rural [7]. Una preparación simbiótica oral (Lactobacillus plantarum más fructooligosacáridos) redujo las septicemias y los fallecimientos de manera significativa en los recién nacidos (riesgo relativo: 0,60; intervalo de confianza del 95 %: 0,48–0,74).
Este resultado sugiere que una gran parte de las septicemias neonatales de los países en desarrollo podrían evitarse gracias a un tratamiento probiótico-prebiótico.
Revisión de prensa
By Pr. Ener Cagri Dinleyici
Servicio de Pediatría, Facultad de Medicina, Universidad Eskisehir Osmangazi, Eskisehir, Turquía
La fibrosis quística es una enfermedad genética progresiva que ocasiona infecciones persistentes de las vías respiratorias inferiores y que se asocia a diferentes signos y síntomas sistémicos. Más de 70 000 personas la padecen en el mundo [1].
Los tipos y la severidad de los síntomas pueden variar considerablemente de un individuo a otro. Están principalmente vinculados a la edad que tenga el paciente así como a la que tenía en el momento del diagnóstico. Los niños y los adolescentes que padecen fibrosis quística presentan un amplio abanico de síntomas y signos, incluyendo manifestaciones gastrointestinales. Estudios recientes han demostrado que la disbiosis es una característica de la fibrosis quística, lo que ha dado lugar a trabajos sobre la relación entre la composición de la microbiota de las vías aéreas, las características clínicas y la función pulmonar en los enfermos [2]. La disbiosis de la microbiota intestinal asociada a la fibrosis quística puede estar vinculada a la evolución natural de la enfermedad (incluyendo una afección gastrointestinal o alteraciones de la microbiota respiratoria). Sin embargo, los pacientes necesitan varios ciclos de tratamiento antibiótico, los cuales pueden modificar la composición de la microbiota.
Estudios han demostrado que pacientes que sufren fibrosis quística generalmente presentan niveles menos elevados de Bifidobacterium spp., del grupo Bacteroides- Prevotella, del clúster XIVa de Clostridium, de Fecalibacterium prausnitzii y de Eubacterium rectale, mientras que los niveles de Enterobacteriaceae y de Clostridia aumentan. De Freitas y sus colaboradores han publicado recientemente, en la revista Plos One, un estudio que quiere evaluar el efecto de la fibrosis quística y de una antibioterapia en la composición de la microbiota intestinal en 19 niños y adolescentes enfermos con respecto a 17 pacientes control de la misma edad y del mismo sexo [3]. La concentración de calprotectina fecal (un marcador de la inflamación intestinal) era más elevado en el grupo afectado de fibrosis quística (independientemente del tratamiento antibiótico) en comparación con los controles sanos. Los autores han mostrado que los niveles de Bacteroides, de Firmicutes, de Eubacterium rectale y de Fecalibacterium prausnitzii se habían reducido de manera significativa, mientras que los niveles de Clostridium difficile, de Escherichia coli y de Pseudomonas aeruginosa habían aumentado significativamente en el grupo enfermo en comparación con los controles sanos. Las principales diferencias de composición de la microbiota entre los pacientes enfermos de fibrosis quística, independientemente del tratamiento antibiótico, se observaron en los Eubacterium rectale, Bifidobacterium, Escherichia coli, Firmicutes, Pseudomonas aeruginosa y Clostridium difficile. Los resultados de este estudio muestran que la composición de la microbiota intestinal en los pacientes afectados de fibrosis quística difiere de la de los controles sanos y que el uso frecuente de antibióticos no tiene efectos suplementarios en estas alteraciones.
Revisión de prensa
Por el Pr. Ener Cagri Dinleyici
Servicio de Pediatría, Facultad de Medicina, Universidad Eskisehir Osmangazi, Eskisehir, Turquía

La mayoría de los estudios recientes que evalúan los efectos de los medicamentos en la composición de la microbiota intestinal se han referido al uso de los antibióticos en diferentes franjas de edad
Estudios anteriores han demostrado que la metformina, los inhibidores de la bomba de protones, los antiinflamatorios no esteroideos y los antipsicóticos atípicos tienen un efecto en la composición de la microbiota intestinal. Sin embargo, estos estudios han presentado resultados generales para clases de medicamentos y no para medicamentos específicos. Lisa Maier y su equipo han publicado los resultados de su nuevo estudio en la revista Nature en 2018 [1]. Su objetivo era clasificar más de 1 000 medicamentos que actúan sobre el microbioma (40 cepas de bacterias intestinales representativas). ¿La finalidad? Facilitar la realización de estudios clínicos y mecanísticos más en profundidad para mejorar el tratamiento y el diseño de los medicamentos. Maier et al. han demostrado que el 24 % de estos 1 000 medicamentos inhibían el crecimiento de al menos una cepa in vitro. Estudios recientes han sugerido que los efectos de los medicamentos en las bacterias intestinales se traducen en efectos secundarios que son similares a los de los antibióticos en el hombre.
El estudio de Maier ha puesto de relieve que la sensibilidad a los antibióticos y a los medicamentos seleccionados se correlaciona entre las especies bacterianas, lo cual sugiere mecanismos de resistencia comunes. Además, se ha puesto de manifiesto un riesgo potencial de que los medicamentos distintos de los antibióticos favorezcan una resistencia a los antibióticos. El uso generalizado de los medicamentos en el mundo podría estar asociado a la disbiosis, en particular en las sociedades occidentales modernas. Por otra parte, este ensayo reciente ha mostrado que la composición de la microbiota intestinal también puede modular la eficacia y la toxicidad de los medicamentos y podría constituir una nueva base para el desarrollo ulterior de moléculas. No obstante, se necesitan otros ensayos clínicos in vivo para comprender mejor el mecanismo de acción. Una identificación global de las interacciones entre agentes terapéuticos y microbiota intestinal ayudará a comprender con precisión los mecanismos subyacentes para estas interacciones y permitirá asegurarse de la inocuidad y eficacia de los tratamientos [2].
De vuelta del congreso
By Dr. Jari Punkkinen
Head of Endoscopy Unit, Porvoo Hospital, Department of Medicine, Finland

Extractos seleccionados sobre el síndrome del intestino irritable (SII) y la microbiota intestinal.
La disbiosis de la microbiota y su vinculación con el síndrome del intestino irritable (SII) han sido analizadas a lo largo de diferentes sesiones de la conferencia. En particular, los catedráticos Magnus Simrén y Uday Ghoshal pusieron de manifiesto ciertas características asociadas a la composición de la microbiota en pacientes afectados por SII. Varios estudios han mostrado que la riqueza microbiana de los pacientes afectados por SII era menor que la de los sujetos sanos, que los Methanobacteriales podían no ser detectados y que la producción de metano era baja en esos pacientes [1]. Además, un subgrupo de pacientes con SII presentaba una disbiosis asociada a un aumento de los enterotipos Firmicutes y Bacteroides con respecto a los individuos sanos que presentaban un aumento de los enterotipos Clostridiales y Prevotella. No obstante, parece importante determinar qué bacterias se asocian al SII, pero también la razón de su presencia en el intestino y cómo intervienen en los mecanismos de hipersensibilidad visceral, de disfunción neuromotora, de aumento de la permeabilidad intestinal y de inflamación de bajo grado. Una proliferación bacteriana del intestino delgado (PBID, en inglés, SIBO: Small Intestinal Bacterial Overgrowth) puede ser la causa del SII en ciertos pacientes. El desafío actual consiste en mejorar la detección de esas PBID dado que el cultivo bacteriano a partir de una muestra de líquido de aspiración del intestino delgado obtenido por endoscopía es difícil de hacer y no siempre resulta posible [2]. El test de hidrógeno espirado (tras la ingesta de glucosa) puede usarse para identificar a estos pacientes; parece ser más preciso que el test de hidrógeno espirado (tras la ingesta de lactulosa).
¿La microbiota intestinal puede modificarse con fines terapéuticos? ¿Podría esto aliviar los síntomas del SII? La microbiota intestinal puede modularse usando antibióticos, probióticos, simbióticos, modificando la motilidad gastrointestinal, actuando sobre la dieta, y mediante trasplante fecal o bacteriófagos. Estas posibilidades se han analizado en las presentaciones de los catedráticos Uday Ghoshal y Giovanni Barbara. El impacto de los antibióticos es mejor en los pacientes con SII que presentan una PBID. En efecto, la norfloxacina y la rifaximina son significativamente más eficaces para reducir los síntomas del SII en los pacientes positivos para una PBID que en los negativos para una PBID.
En los pacientes afectados de SII que no presentan constipación, conforme a los estudios Target 1 y 2, la rifaximina alivia los síntomas globales del SII y la hinchazón abdominal. El estudio Target 3 y otros estudios han mostrado que la rifaximina podía ser usada de manera reiterada en caso de recidiva del SII-D (SII con diarrea predominante) sin pérdida de efecto ni manifestación de resistencia bacteriana [3, 4]. Además, la rifaximina reduce de manera transitoria la cantidad de bacterias en las heces pero también parece tener un efecto eubiótico, aumentando la abundancia de los Lactobacillaceae. Una dieta baja en FODMAP parece reducir los síntomas en algunos pacientes con SII, pero también ocasiona una reducción del número de bifidobacterias en las heces. En los pacientes con SII que siguen una dieta baja en FODMAP, la disbiosis aumenta, y, por ende, la sensibilidad al régimen alimentario puede predecirse por los perfiles bacterianos fecales. La eficacia del trasplante fecal en el SII sigue siendo controvertida dado que solo ha sido demostrada en uno de los dos grandes estudios controlados aleatorizados [5, 6].
Como lo ha indicado el catedrático Giovanni Barbara y, basándose en 53 ensayos controlados aleatorizados, el American College of Gastroenterology concluyó que los probióticos reducían los síntomas globales del SII, así como la hinchazón abdominal y las flatulencias [7]. Para reforzar el fundamento de esta recomendación serían precisos nuevos datos de alta calidad.
No obstante, todos los probióticos no son equivalentes. El catedrático Eamonn Quigley ha mostrado que Bifidobacterium infantis aliviaba los dolores abdominales, la hinchazón abdominal y las alteraciones del tránsito intestinal y que mejoraba la calidad de vida de los pacientes afectados por todos los subtipos de SII. La cepa también parece tener propiedades antiinflamatorias e inmunomoduladoras, dado que reduce los niveles de CRP y de TNFα en la psoriasis, el síndrome de fatiga crónica y la rectocolitis hemorrágica. Además, los resultados sugieren que, en asociación con Bifidobacterium longum , Bifidobacterium infantis también podría aliviar los síntomas depresivos asociados al SII.
Los resultados de estudios preclínicos han mostrado que ciertos metabolitos bacterianos podían modificar la respuesta cerebral a ciertos estímulos. No obstante, el desafío consiste en trasladar esos estudios al plano clínico. El Dr. Huiying Wang mostró en su reciente estudio que la cepa Bifidobacterium longum modulaba la actividad cerebral durante el estrés social observado en el transcurso de una partida de Cyberball en voluntarios sanos basándose en una evaluación realizada mediante magnetoencefalografía y cuestionarios sobre la calidad de vida. Además de un efecto en las oscilaciones neuronales, la cepa también mejora la sensación de vitalidad y reduce la fatiga mental en comparación con el placebo a lo largo de un período de seguimiento de cuatro semanas. El catedrático Paul Enck describió la relación entre el estrés o la ansiedad y el SII como de doble sentido dado que los síntomas pueden ser al mismo tiempo causa y consecuencia del SII. Un estudio [8] desarrollado en pacientes con SII mostró que la presencia de Bifidobacterium longum estaba correlacionada con una reducción de los niveles de depresión y ansiedad; sin embargo, al ingresar al estudio, esos niveles no estaban lo suficientemente altos como para establecer un diagnóstico de depresión o ansiedad. Así, parece más apropiado decir que este probiótico afecta el humor más que la depresión o la ansiedad. Al igual que Bifidobacterium longum, la rifaximina modularía la actividad cerebral, aumentaría la relajación y reduciría la ansiedad en una situación de estrés social. Es lo que ha demostrado un ensayo doble ciego desarrollado en voluntarios sanos evaluados mediante magnetoencefalografía [9].
De vuelta del congreso
Por el Dr. Solange Heller Rouassant
Gastroenterología y nutrición pediátricas, Ciudad de México, México, Asesora mexicana de la NASPGHAN

Las Proteobacteria, los Firmicutes, las Actinobacterias, los Bacteroidetes y las Fusobacteria son los filos más abundantes en los pacientes positivos y negativos para H. pylori, y esta microbiota gástrica podría desempeñar un rol en la cancerogenicidad asociada a H. pylori [1]. Alarcón [2] caracterizó la microbiota gástrica en niños positivos y negativos para H. pylori; cuando estaba presente, H. pylori dominaba la comunidad microbiana, pero en su ausencia, la riqueza y la diversidad bacteriana eran más importantes.
El desarrollo de la microbiota intestinal al inicio de la vida está influido por el tipo de parto, la alimentación (leche materna o leche maternizada), la utilización de antibióticos, el momento de la introducción de los alimentos sólidos y la interrupción de la alimentación láctea. La microbiota intestinal de un recién nacido está dominada transitoriamente por las enterobacterias y los estafilococos, y muy rápidamente por Bifidobacterium y las bacterias lácticas. Predominan los Bifidobacterium hasta la introducción de una alimentación complementaria [3].
Dukanovic [4] demostró que se encontraban pocas Bacteroides en las heces de lactantes nacidos por cesárea y alimentados exclusivamente con leche materna. Estas especies de Bacteroides se detectaron en un 73 % y 16 % en muestras obtenidas de parto natural y por cesárea, respectivamente.
Collado [4] demostró que la microbiota del par madre-hijo y la microbiota de la leche materna presentaban características comunes, lo cual sugiere una transmisión microbiana durante la lactancia. Ciertas cepas de los géneros Bacteroides, Bifidobacterium, Staphylococcus y Enterococcus se aislaron del intestino de las madres y de los lactantes, y, respectivamente, ciertas cepas de Staphylococcus, Lactobacillus, Enterobacter y Acinetobacter se aislaron de la leche materna a la edad de 2 meses.
Se probó que existía un vínculo entre la composición de la microbiota intestinal al inicio de la vida y el desarrollo de enfermedades [5]. Estudios realizados sobre la microbiota intestinal de lactantes al inicio de la vida mostraron que la transferencia de genes de resistencia a los antibióticos se adquiere precozmente y puede dejar secuelas a largo plazo.
Lactantes alimentados solo con leche materna recibieron un suplemento de Bifidobacterium longum subsp. infantis (Casaburi [4]), un probiótico seleccionado, capaz de remodelar la microbiota intestinal con una reducción potencial de los reservorios de genes de resistencia a los antibióticos. Se concluyó que la colonización con niveles elevados de esta cepa es un método seguro y no invasivo para reducir un reservorio de genes que confieren resistencia a los antibióticos.
Los niveles elevados de Bifidobacterium longum subsp. infantis en lactantes amamantados, independientemente de su modo de alumbramiento, permanecían estables durante el primer año de vida si se proseguía el amamantamiento [4].
Los oligosacáridos contenidos en la leche materna (oLM) son compuestos de la lecha materna no conjugados, sólidos y abundantes. El espectro de los oLM contenidos en la leche materna, principalmente asociado al estatus secretor de la madre, modula la composición bifidobacteriana del intestino de los lactantes.
Encontramos menos bifidobacterias en el intestino de recién nacidos alimentados con leche maternizada pero una mayor diversidad microbiana. El uso de prebióticos en la leche maternizada aumenta la fracción bifidobacteriana en el intestino de los lactantes. Actualmente, los prebióticos disponibles (Galacto-oligosacáridos (GoS) y los fructooligosacáridos (FoS)) son metabolizados por las bifidobacterias, pero no por el huésped humano [5].
Puccio [6] suplementó leche maternizada con 2’fucosilactosa y lacto-N-neotetraosa, que generalmente están contenidos en la leche materna, y obtuvo buenos resultados. La leche maternizada suplementada con GoS, FoS y Bifidobacterium breve M-16V compensa el retraso de colonización con Bifidobacterium en los lactantes nacidos por cesárea, modula la microbiota intestinal y reproduce las condiciones observadas en los lactantes nacidos por parto natural [6].
La comparación de las dos leches maternizadas diferentes, suplementadas solo con prebióticos o con prebióticos y probióticos, ha mostrado perfiles de la microbiota intestinal similares a los de lactantes amamantados (Tims & Phavichir [4]).
Los probióticos se recomiendan para prevenir las ALV, pero sería bueno contar con más datos. Lactobacillus rhamnosus o Bifidobacterium lactis se administraron todos los días a madres entre la 35ª semana de embarazo y 6 meses después del parto, y a lactantes desde el nacimiento hasta la edad de 2 años. Los niños que recibieron Lactobacillus rhamnosus presentaron una reducción significativa de la prevalencia de eczema en la infancia (Wickens [4]).
Leches infantiles fuertemente hidrolizadas se suplementaron con L. rhamnosus para tratar las ALV por mediación de tipo IgE y favorecer el desarrollo de la tolerancia inmunitaria. Los estudios clínicos realizados en lactantes en buen estado de salud y lactantes que presentaban una ALV mostraron que las leches maternizadas a base de aminoácidos (LMA) suplementadas con simbióticos son hipoalergénicas, bien toleradas, y garantizan un crecimiento normal.
Se presentaron los resultados de un ensayo multicéntrico, en doble ciego, aleatorizado y controlado desarrollado en lactantes que presentaban ALV por mediación de tipo no IgE (Candy [7]). Los lactantes recibieron LMA hipoalergénica que contenía una mezcla prebiótica de fructooligosacárido neutro derivado de la achicoria y de Bifidobacterium breve de cadena larga. En la 8ª semana, diferencias importantes a nivel de la composición de la microbiota intestinal se habían hecho presentes entre los grupos: los porcentajes de bifidobacterias eran más elevados en el grupo que había recibido LMA suplementada con simbióticos. La modulación de la microbiota intestinal usando estos simbióticos específicos podría mejorar los síntomas en los lactantes que presentan una ALV.
Datos sugieren que una alteración de la microbiota intestinal afecta la motilidad intestinal e induce una producción de gas en los lactantes, lo cual ocasiona dolores abdominales o cólicos. La modulación de la microbiota intestinal podría desempeñar un rol en la gestión y la prevención de los cólicos infantiles.
Una revisión sistemática Cochrane [4] de los probióticos profilácticos en los cólicos infantiles incluyó estudios sobre Lactobacillus reuteri, y sobre probióticos derivados de varias cepas de Lactobacillus rhamnosus, Lactobacillus paracasei y Bifidobacterium animalis. Este metaanálisis no ha mostrado ninguna diferencia asociada al uso de varios probióticos. Sin embargo, un análisis más amplio ha sugerido que los probióticos eran eficaces para tratar los cólicos infantiles (Ong [4]).
De vuelta del congreso
Por el Dr Dragos Ciocan
Hepatogastroenterología y nutrición, Hospital Antoine-Béclère, Clamart, Francia

Las Jornadas Francófonas de Hepatogastroenterología y de Oncología Digestiva se celebraron en París del 21 al 24 de marzo de 2019, y reunieron a más de 5 000 médicos e investigadores francófonos. Durante este congreso se presentaron varios estudios originales sobre la microbiota intestinal (MI).
El trasplante de microbiota fecal (TMF) es una estrategia terapéutica que actualmente solo se utiliza en la práctica clínica para las infecciones recurrentes por Clostridium difficile [1]. El doctor Eymeric Chartrain presentó el experimento del centro referente del Hospital Universitario de Clermont-Ferrand sobre el TMF en la infección recurrente por Clostridium difficile entre 2014 y 2018. El porcentaje de eficacia del TMF fue del 95 % con solamente un 16 % de efectos secundarios menores. Además, se producía una mejora significativa de la calidad de vida 6 meses tras el TMF. El coste total de un TMF era de aproximadamente 3 100 euros. A pesar de este elevado coste, el TMF permite reducir los costes sanitarios disminuyendo la morbimortalidad de estos pacientes y sigue siendo una opción racional y eficaz.
La función del TMF se ha estudiado en numerosas patologías que implican a la MI, entre las que se cuentan las enfermedades inflamatorias crónicas intestinales (EICI). El profesor Harry Sokol presentó los resultados de un pequeño estudio piloto aleatorizado (17 pacientes), en simple ciego y comparado a placebo, que ha evaluado la función del TMF en adultos con una enfermedad de Crohn cólica o ileocólica durante un brote, y tratados con corticoterapia oral. El criterio de evaluación principal, que era la implantación de la MI del donante en el receptor a la semana 6, definido por una MI del receptor más cercana a la del donante en la semana 6 (índice Sorensen ≥ 0,6) que a la del paciente antes del TMF no se alcanzó. Sin embargo, entre los criterios secundarios evaluados, los autores observaron una disminución de la gravedad endoscópica de la enfermedad en el grupo TMF y un aumento de la inflamación en el grupo control. La colonización por la MI del donante estaba asociada al mantenimiento de la remisión, y los pacientes que no habían sido colonizados por la MI del donante recaían más rápidamente. Además, la composición de la MI permitía predecir una remisión clínica sin esteroides. A pesar del pequeño grupo analizado, este estudio sugiere que el TMF podría ser eficaz tras una inducción de la remisión clínica por corticoides, en pacientes que padezcan un brote de enfermedad de Crohn. En este sentido se están realizando ensayos más amplios, entre los cuales uno dirigido por el equipo del Prof. Sokol.
Si bien la función de la MI bacteriana y fúngica en las EICI ya es conocida, lo es menos el papel de las interacciones entre bacterias y hongos en la inflamación. El doctor Bruno Sovran presentó un estudio que, justamente, se interesa por estas interacciones en un modelo de colitis en ratones. Los autores observaron que la administración de une cepa de Saccharomyces mejoraba la colitis, mientras que la administración de Candida albicans la agravaba. Sin embargo, un tratamiento previo por colistina, que destruye las bacterias gramnegativas (como las proteobacterias) inducía la pérdida de los efectos de los hongos. La administración de una cepa de E. coli resistente a la colistina que restauraba el nivel de enterobacterias en los ratones tratados por colistina permitía asimismo restablecer los efectos beneficiosos de una cepa de Saccharomyces y los efectos nocivos de C. albicans sobre la gravedad de la colitis. Estos resultados sugieren que las enterobacterias son necesarias para una mejor colonización intestinal de los hongos y podrían explicar los efectos de ciertos probióticos en la colitis [2].
Actualmente, el papel de la MI en la fisiopatología de la obesidad es ampliamente reconocido. La MI también puede modular las funciones cognitivas y psíquicas a través del eje intestino-cerebro [3]. La obesidad es un factor de riesgo de trastornos cognitivos, independientemente de las comorbilidades, pero los mecanismos son poco conocidos. El estudio MEMOB presentado por la doctora Sophie Cambos se interesa por las disfunciones de la memoria en pacientes obesos, y por su correlación con la MI. Este estudio prospectivo, longitudinal, monocéntrico incluyó a personas obesas y personas normoponderales y demostró que las personas obesas antes de una cirugía bariátrica presentaban disfunciones de la memoria en comparación con la población control. El análisis del perfil microbiano reveló una relación entre la abundancia de Eggerthellales y las funciones de la memoria: cuanto más importante es la abundancia de Eggerthellales, peores son los resultados en memoria. Estos resultados sugieren que la obesidad –y por tanto las alteraciones de la microbiota intestinal asociadas– podrían acelerar el declive cognitivo a través del eje intestino- cerebro.
un taller titulado “Microbiota e hígado, del mecanismo el tratamiento”. El profesor Gabriel Perlemuter revisó los últimos avances sobre el papel de la MI en las enfermedades hepáticas. Entre los estudios recientes más significativos, se puede observar la función de la MI en la susceptibilidad de padecer una enfermedad alcohólica del hígado o una hepatopatía dismetabólica durante el consumo de inhibidores de la bomba de protones. Estos productos inducen un aumento de Enterococcus en la MI, que se traduce por un aumento de la translocación de esta bacteria en el hígado, donde induce una inflamación hepática [4]. Existen varios estudios piloto que también se han interesado por la función del TMF en las enfermedades hepáticas (hepatitis B, encefalopatía hepática y hepatitis alcohólica aguda severa córticorresistente) y han mostrado una cierta eficacia en estas indicaciones.
La Dra. Anne-Marie Cassard evocó la modulación de la MI en casos de enfermedades hepáticas. Presentó los resultados de su equipo que demostraban que unos niveles bajos de Bacteroides se asocian al desarrollo de las lesiones hepáticas relacionadas con el alcohol. El hecho de corregir esta perturbación de la MI mediante la administración de pectina, una fibra soluble, permite prevenir y mejora las lesiones de MAF [5]. Sin embargo, no todas las fibras inducen las mismas modificaciones de la MI, incluso aunque el efecto beneficioso sobre el hospedador sea el mismo.
Además, entre las diferentes estrategias estudiadas que se centran en la MI y que han demostrado una cierta eficacia a nivel de las lesiones hepáticas (antibióticos, TMF, probióticos y prebióticos), solo los antibióticos y el TMF permiten modificar de manera duradera la MI.
Artículo comentado - niño
Por el Pr. Emmanuel Mas
Gastroenterología y nutrición, Hospital de Niños, Toulouse, Francia

Si bien una cantidad creciente de datos sugiere un rol de la microbiota intestinal en el desarrollo neurológico, la estructura y la composición reales de la microbiota intestinal en los niños con trastornos de déficit de atención con hiperactividad (TDAH) todavía resultan inciertas. Por esta razón, este estudio buscaba definir las características de la microbiota intestinal en niños que padecen TDAH, pero no han sido tratados, así como evaluar su relación con la gravedad de los síntomas de TDAH.
Una pirosecuenciación a gran escala se utilizó para estudiar la composición de la microbiota fecal de 51 niños con TDAH y de 32 controles sanos (CS). Un análisis a la altura de las unidades taxonómicas operativas (UTO) reveló una disminución significativa de la representación fraccionaria de Faecalibacterium en los niños con TDAH respecto de los CS. En las personas con TDAH, la abundancia de Faecalibacterium implicaba una asociación negativa con los síntomas informados por los padres. Sin embargo, no había diferencia significativa en términos de diversidad alfa (índices de Shannon, Simpson, ACE y Chao 1) entre el grupo con TDAH y el grupo de control.
Estas observaciones respaldan la implicación de una alteración de la microbiota intestinal en las enfermedades psiquiátricas, y Faecalibacterium puede representar un nuevo indicador potencial de la microbiota intestinal en los pacientes con TDAH. Se requieren otros estudios para validar estas observaciones y determinar las relaciones causales y temporales entre estas variables.
Durante estos últimos años, el intestino y la microbiota intestinal han pasado a ocupar una posición esencial en el hombre, convirtiéndose incluso para algunos en un 2.o y 3.er cerebro. El eje intestino-cerebro se estudia con más precisión, y se buscan alteraciones de su funcionamiento en diversas patologías neurológicas y psiquiátricas. Se han puesto de relieve alteraciones de la microbiota intestinal en el autismo y en otras patologías psiquiátricas. En cuanto al TDAH, ningún estudio ha analizado con precisión la microbiota intestinal en este trastorno, pero algunos sugieren la existencia de una disbiosis (mejora de los síntomas con probióticos y agravación con antibióticos; nacimiento por cesárea como factor de riesgo de la enfermedad).
El eje intestino-cerebro desempeña un rol importante en diversas patologías neurológicas y psiquiátricas.
Este estudio piloto sugiere una perturbación de la microbiota intestinal (en especial, disminución de Faecalibacterium).
Se requieren otros estudios para confirmar este resultado y evaluar si la corrección de esta disbiosis mejorará los síntomas del TDAH.
Los autores han incluido a 51 niños de 6 a 10 años de edad con TDAH y a 32 controles emparejados en un hospital chino entre mayo de 2015 y diciembre de 2016. El diagnóstico de TDAH se basaba en el cuestionario Kiddie-SADS-PL que figura en el manual diagnóstico y estadístico de las enfermedades mentales (DSM-IV). Los padres completaron un cuestionario para evaluar la severidad de los síntomas del TDAH (Conners Parent Rating Scales). Se excluyó a los niños con regímenes específicos, tratados con probióticos o antibióticos dentro de los 2 meses previos, con trastornos digestivos, síntomas depresivos o ansiosos, obesidad, terreno atópico o tratados con medicamentos para su TDAH.
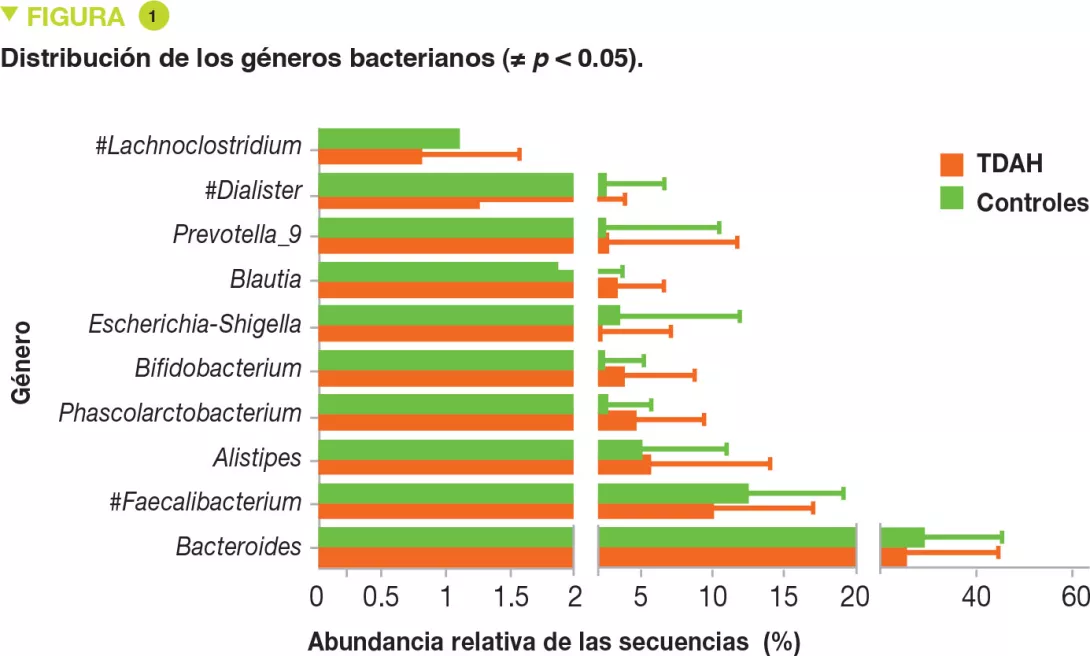
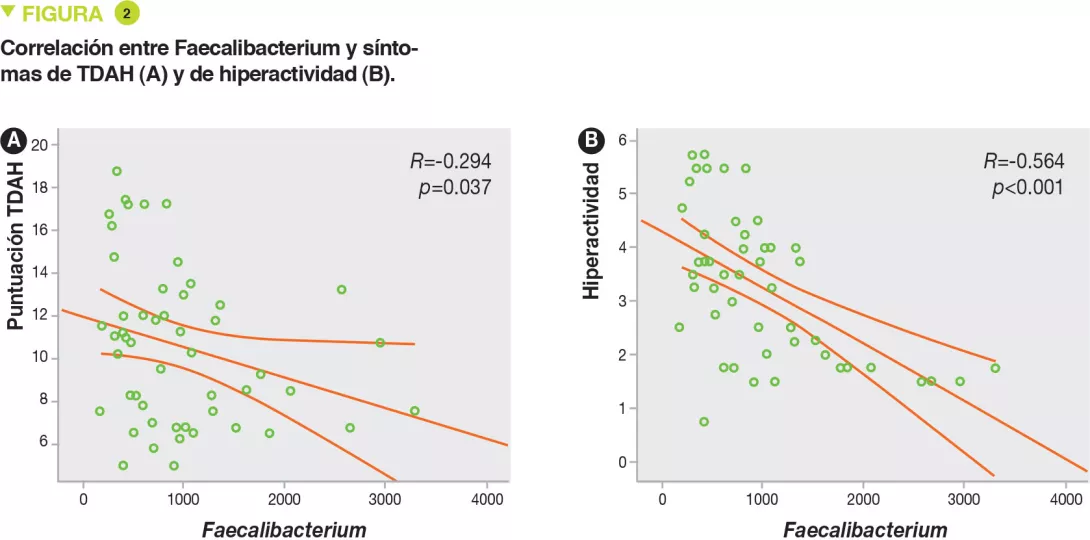
No se encontraba diferencia entre ambos grupos para la edad, el sexo, el IMC, el modo de nacimiento y alimentación (amamantamiento). El análisis de la microbiota intestinal, realizado por pirosecuenciación del ARN 16S y el análisis de las UTO (unidades taxonómicas operativas), no ha mostrado diferencias en términos de diversidad bacteriana (alfa y beta). Los cuatro principales filos en todas las muestras eran Firmicutes, Bacteroidetes, Proteobacterias y Actinetobacterias, pero sin diferencias entre niños con TDAH y controles. Por el contrario, en cuanto a los géneros, los porcentajes de Faecalibacterium, Lachnoclostridium y Dialister eran inferiores en los niños con TDAH (Figura 1). La abundancia de Faecalibacterium se correlacionaba negativamente con la severidad del TDAH, al igual que con el índice de hiperactividad (Figura 2).
Si una perturbación de la microbiota intestinal incide en el TDAH (como en otras patologías), es necesario en primer lugar ser prudentes y contar con una prescripción calculada de antibióticos para el niño, y con más razón para el lactante, a fin de prevenir el desarrollo ulterior de estas enfermedades. En el marco del TDAH, podría ser útil apuntar a Faecalibacterium garantizando su incremento en el plano intestinal. En el plano de la dieta, esto se favorece con una alimentación de tipo mediterránea y probablemente se reduce con una alimentación de tipo occidental. Además de este enfoque desde el punto de vista de la dieta, que apunta a Faecalibacterium, también se trata de reducir la inflamación intestinal a la que contribuye la disminución de Faecalibacterium.
Este estudio piloto ha demostrado que existía una perturbación de la microbiota intestinal en los pacientes con TDAH. Esta disbiosis se refería en particular a Faecalibacterium, género que estaba correlacionado negativamente a la severidad de los síntomas de TDAH.
Artículo comentado - adulto
Por el Pr. Harry Sokol
Gastroenterología y nutrición, Hospital Saint-Antoine, París, Francia
La incidencia de la infección con Clostridium difficile ha aumentado recientemente. Esta bacteria se ha convertido en un patógeno nosocomial dominante en América del Norte y en Europa, si bien se sabe poco sobre lo que desencadenó su aparición. Aquí, los autores muestran que dos ribotipos epidémicos (RT027 y RT078) han adquirido mecanismos únicos para metabolizar bajas concentraciones del disacárido trehalosa que se utiliza como aditivo alimentario. El ribotipo 027 (RT027) contiene una sola mutación puntual en el represor transcripcional* de la trehalosa que aumenta su sensibilidad a la sustancia más de 500 veces. Además, la trehalosa en los alimentos aumenta la virulencia de las cepas RT027 en un modelo murino de infección con Clostridium difficile . El ribotipo 078 (RT078) ha adquirido un grupo de 4 genes implicados en el metabolismo de la trehalosa. Entre ellos, una permeasa de tipo PTS (fosfotransferasa) es, al mismo tiempo, necesaria y suficiente para el crecimiento de las cepas, incluso con bajas concentraciones de trehalosa. Los autores plantean que la aplicación de la trehalosa como aditivo alimentario en la alimentación humana, poco tiempo antes del surgimiento de estos dos ribotipos epidémicos, ha contribuido a su aparición y a su hipervirulencia [1].
El análisis por secuenciación del genoma completo de cepas de C. difficile ribotipo 027 (RT027) ha demostrado que dos linajes independientes han surgido en América del Norte entre el 2000 y el 2003 [2]. La comparación con cepas RT027 históricas previas a la epidemia ha evidenciado que los linajes epidémicos han adquirido una mutación en el gen gyrA, que ha conducido a una mayor resistencia a los antibióticos del grupo de las fluoroquinolonas. Aun cuando el desarrollo de esta resistencia ha desempeñado ciertamente un rol en la propagación de las cepas RT027, también se ha observado en ribotipos de C. difficile no epidémicos e identificados en cepas que datan de mediados de la década del 80. Por consiguiente, es probable que otros factores hayan contribuido a la emergencia de cepas epidémicas RT027. La prevalencia de un segundo ribotipo de C. difficile, RT078, se multiplicó en los hospitales y las clínicas entre 1995 y 2007 y se asoció con una mayor severidad [3]. No obstante, los mecanismos involucrados en el aumento de la virulencia siguen siendo desconocidos. Dado que los linajes RT027 y RT078 están filogenéticamente alejados uno de otro, es posible que los cambios que condujeron en forma simultánea a un aumento de la prevalencia y de la gravedad de la infección puedan provenir de mecanismos independientes.
Se ha demostrado que las cepas del ribotipo RT027 tienen una ventaja competitiva comparada con las otras cepas in vitro y en modelos murinos de infección con C. difficile. Para investigar los mecanismos involucrados, los autores han examinado el uso de diferentes fuentes de carbono por las diversas cepas y han evidenciado una mayor capacidad para utilizar el disacárido trehalosa en el caso de las cepas del ribotipo RT027. Comparando los genomas de numerosas cepas de C. difficile, los autores han identificado una potencial enzima fosfotrehalasa (TreA) que metaboliza la trehalosa-6-fosfato en glucosa y glucosa-6-fosfato. Luego, los autores observaron que las cepas del ribotipo RT027 activaban ese gen con una concentración 500 veces menor de trehalosa que las otras cepas de C. difficile. Análisis más finos permitieron identificar un polimorfismo en el represor transcripcional (TreR) de TreA en todas las cepas del ribotipo RT027 y en otras cepas cercanas al origen epidémico en Europa y Australia. Para evaluar si la capacidad de metabolizar la trehalosa tenía un impacto en la virulencia, los autores la administraron a ratones trasplantados con una microbiota humana e infectados por una cepa del ribotipo RT027 (R20291), o bien infectados por la misma cepa, pero delectada para el gen TreA (R20291Δ TreA) y, por ende, incapaz de metabolizar la trehalosa. La mortalidad era mucho menor con esta última cepa R20291Δ TreA (Figura 1).
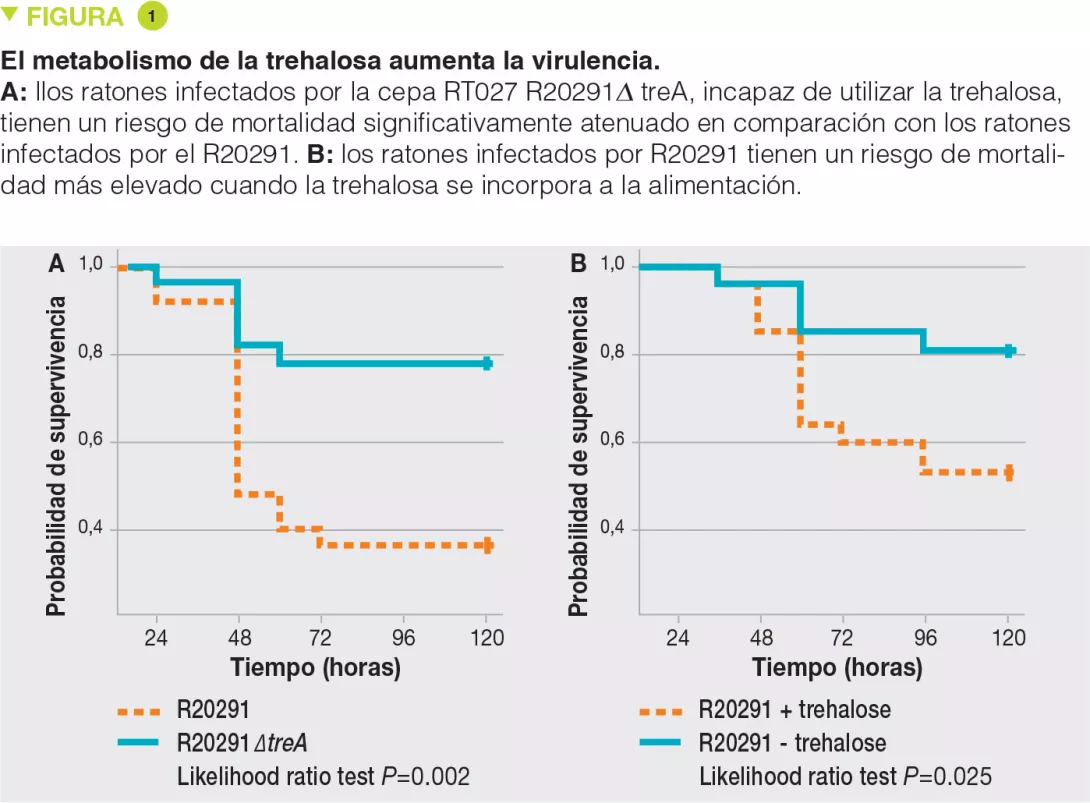
Los focos de infección con C. difficile por cepas epidémicas hipervirulentas (ribotipos RT027 y RT078) aparecieron a principios de los años 2000.
La trehalosa es un disacárido muy resistente que se utiliza en la industria alimentaria desde el 2000.
Las cepas RT027 y RT078 han adquirido una ventaja competitiva que les permite utilizar la trehalosa, incluso en bajas concentraciones, lo cual aumenta su virulencia.
En una segunda experiencia, los autores infectaron ratones con una microbiota humana con la cepa del ribotipo RT027 (R20291) en presencia o en ausencia de trehalosa en el agua para beber (suministrada en una dosis equivalente a la recibida en una comida humana). La mortalidad era muy superior en presencia de trehalosa. Las dos experiencias acumuladas confirman la hipótesis según la cual la trehalosa en los alimentos contribuye a la severidad de las cepas del ribotipo RT027. El análisis genético de las cepas del ribotipo RT078 ha mostrado la inserción de 4 genes que codifican una 2.a copia de la fosfotrehalasa (TreA2) y de su represesor (TreR2) y otros 2 genes vinculados. Un enfoque por mutación y sobreexpresión ha permitido confirmar que esta inserción era responsable de la capacidad de las cepas del ribotipo RT078 de desarrollarse en presencia de trehalosa.
La trehalosa es un azúcar extremadamente estable, resistente tanto a las altas temperaturas como a la hidrólisis. Considerada ideal para un uso en la industria agroalimentaria, su empleo no se propagó hasta el 2000, fecha en que se descubrió un nuevo procedimiento de producción a bajo costo [3]. Su uso ha sido autorizado en la alimentación por la Administración de Alimentos y Medicamentos (FDA) estadounidense en el año 2000 y por las instituciones europeas en el año 2001. La amplia adopción de la trehalosa coincide con la aparición de los focos de infección a causa de las cepas RT027 y RT078. El conjunto de estos resultados sugieren un rol causal de la trehalosa incorporada a los alimentos en la aparición de estas cepas epidémicas hipervirulentas de C. difficile.
La amplia adopción de la trehalosa en la industria agroalimentaria coincide con la aparición de los focos de infección a causa de las cepas RT027 y RT078 de C. difficile. Estas cepas han adquirido la capacidad de utilizar la trehalosa en baja concentración, lo que les da una ventaja selectiva con respecto a otras cepas en un ecosistema en el que se haya introducido la trehalosa. Esta capacidad para metabolizar la trehalosa aumenta su virulencia. El conjunto de estos resultados sugiere un rol causal de la trehalosa incorporada a los alimentos en la aparición de estas cepas epidémicas hipervirulentas de C. difficile.
Síntesis
Por el Pr. John F. Cryan
Departamento de anatomía y Neurociencias, University College Cork, en Cork, Irlanda

Durante los últimos diez años, la investigación acerca del rol de la microbiota intestinal en la modulación del estado de salud y de las enfermedades cerebrales ha tenido una gran expansión. Si bien la mayoría de los trabajos se han referido a los trastornos asociados al estrés, tales como la ansiedad, la depresión y el síndrome del intestino irritable, cada vez más estudios, en su mayoría preclínicos, también incorporan a la microbiota como moderadora en las enfermedades neurodegenerativas como, por ejemplo, las enfermedades de Alzheimer y Parkinson. En paralelo, las investigaciones han demostrado que el microbioma desempeña un rol esencial en los principales procesos cerebrales implicados en el desarrollo neurológico, la neuroinflamación y el envejecimiento. En la actualidad, las investigaciones se orientan claramente hacia una mejor comprensión de los mecanismos exactos que permiten que el intestino se comunique con el cerebro y de ocasionar un aumento de la susceptibilidad a los trastornos neurológicos.
En medicina, la neurología y la microbiología han evolucionado ampliamente siguiendo trayectorias paralelas distintas, que se han cruzado únicamente en situaciones patológicas, como por ejemplo en infecciones directas del sistema nervioso central. Sin embargo, durante la última década, el descubrimiento de que la microbiota intestinal (los trillones de bacterias presentes en el intestino) cumple un rol clave en el mantenimiento de la homeostasis y en la programación de los principales sistemas corporales, incluyendo al cerebro, ha representado una revolución en biomedicina.
Cada vez más investigaciones se concentran en la comprensión de las vías de comunicación bidireccional entre las bacterias intestinales y el sistema nervioso central, el eje microbiota-intestino-cerebro; no obstante, este ámbito de investigación está apenas en desarrollo [1]. Las modificaciones del microbioma, de sus metabolitos y de su interacción con el eje intestino- cerebro están asociadas a un amplio abanico de enfermedades, que incluyen trastornos neurológicos. El estudio del microbioma requiere una estrecha colaboración entre clínicos, investigadores fundamentales y bioinformáticos, y funciona mejor cuando se levantan las barreras que hay entre disciplinas tradicionales como son la neurología, la gastroenterología y la microbiología.
En la investigación preclínica, una cierta cantidad de modelos experimentales han demostrado ser esenciales para evaluar el efecto del microbioma en el cerebro y el comportamiento, y estos modelos incluyen el uso de prebi ticos y probióticos, la administración de antibióticos, el trasplante fecal y el uso de animales desprovistos de gérmenes y gnotobióticos [1]. En la investigación clínica, la mayoría de los datos, en particular en el ámbito de la neurología, se basan en estudios transversales del microbioma de pacientes, en comparación con individuos sanos de la misma edad.
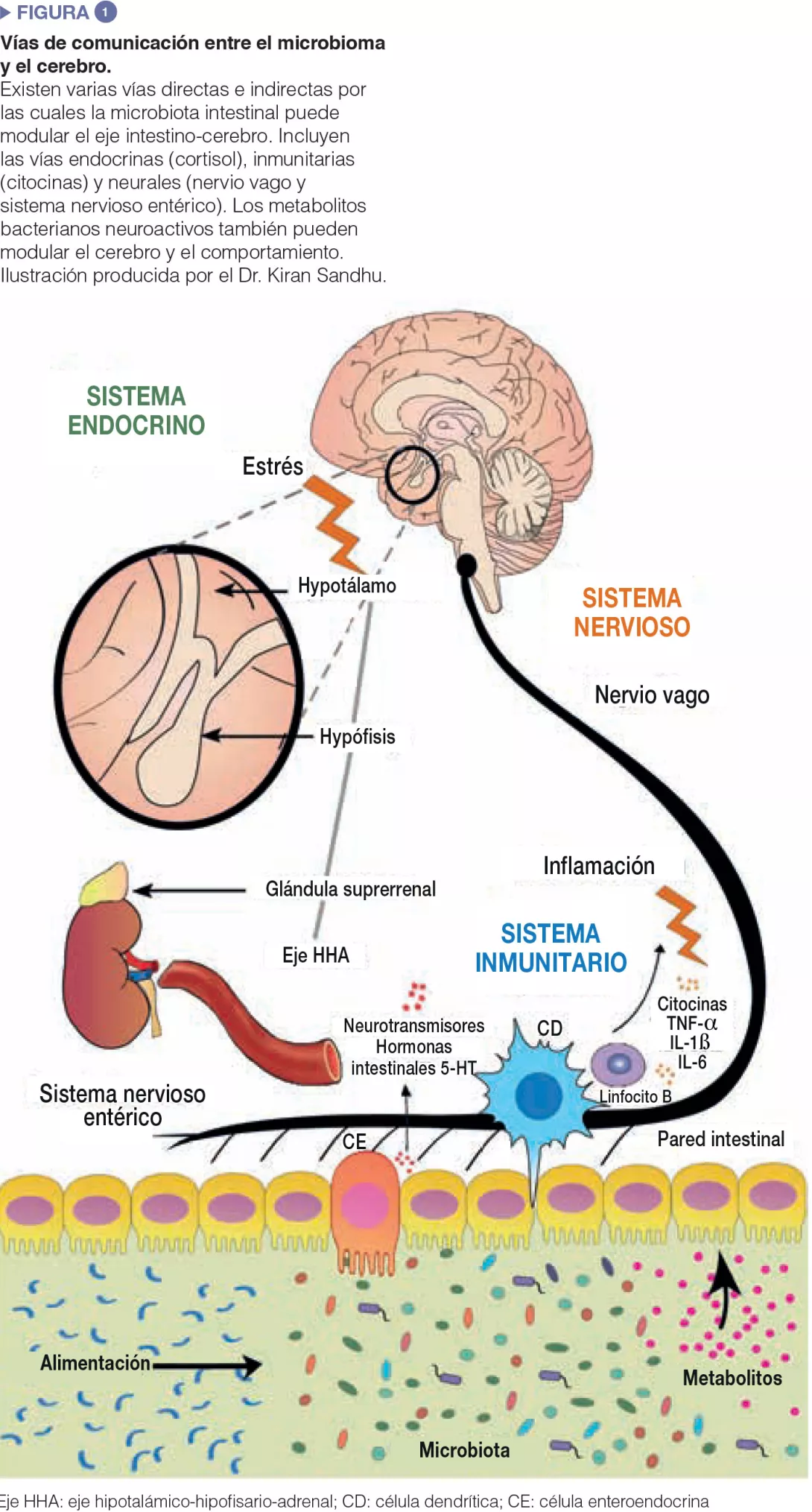
Se han invertido importantes esfuerzos experimentales para intentar comprender en detalle las vías de comunicación entre el intestino y el cerebro. Las bacterias intestinales influyen en los procesos centrales a través de diversos mecanismos (Figura 1). En primer lugar, la capacidad de la microbiota para sintetizar neurotransmisores (el ácido γ-aminobutírico [GABA], la noradrenalina y la dopamina) es una vía de comunicación importante. En segundo lugar, los microbios tienen una importancia trascendental en la activación del sistema inmunitario que puede desempeñar un rol fundamental en el envejecimiento, los trastornos neurológicos y los procesos neurodegenerativos. Finalmente, los microbios producen metabolitos, en especial, ácidos grasos de cadena corta (AGCC), que son esenciales para el intestino, el sistema inmunitario y, potencialmente, para el estado de salud del cerebro. Además, la microbiota intestinal y el cerebro están vinculados por el nervio vago y por la modulación de los principales aminoácidos alimentarios, tales como el triptófano.
Dada la estrecha asociación entre la microbiota intestinal y el cerebro, no es llamativo que las bacterias intestinales tengan un rol esencial en las enfermedades neurológicas y psiquiátricas. Los datos más concluyentes que confirman un rol del microbioma en la función cerebral provienen de ratones desprovistos de gérmenes. Los estudios dirigidos por un cierto número de grupos de investigación en Canadá, Suecia e Irlanda han demostrado que, en los animales desprovistos de gérmenes, el cerebro no se desarrolla normalmente ante la ausencia de microbioma intestinal [2]. Además, también se ha demostrado que procesos cerebrales fundamentales, tales como la mielinización, la neurogénesis en el adulto y la activación de las células de microglía, dependen fuertemente de la composición de la microbiota.
La relación entre el microbioma y el envejecimiento del cerebro también suscita mucha atención, lo cual presenta un interés particular en el ámbito de la neurología, dado que numerosos trastornos neurológicos y neurodegenerativos se presentan a una edad avanzada. Una vez más, la idea de vincular el microbioma al envejecimiento saludable no es una novedad; la sostuvo hace más de 100 años un inmunólogo que recibió un premio Nobel: Elie Metchnikoff. Este último observó que los habitantes de una región de Bulgaria tenían una vida excepcionalmente larga, hecho que atribuyó a la presencia de bacterias que producían ácido láctico en su alimentación. Recientemente hemos analizado otra vez el estudio inicial desarrollado por Metchnikoff [3] y hemos visto que los trastornos del comportamiento en animales ancianos coincidían con modificaciones del microbioma. Además, el estudio ELDERMET ha mostrado que la composición de las bacterias intestinales en las personas de edad avanzada estaba correlacionada con su estado de salud general, su fragilidad y su sistema inmunitario [4]. Un microbioma rico es signo de una mejor salud. Estos investigadores fueron más allá para estudiar lo que llevaba a tener un microbioma de estas características y demostraron que se trataba de una alimentación variada. Cuando la gente come alimentos insípidos procesados (lo que suele suceder en residencias para personas mayores), la diversidad de sus microbiomas se reduce, mientras que los que tienen una alimentación rica en frutas y verduras tienen mejores resultados [4].
Una disminución de la diversidad microbiana se asocia con un aumento concomitante de la activación de la microglía que se correlaciona con diferencias de masa cerebral en el ratón. Esto contribuye a una respuesta inflamatoria asociada a la edad denominada “inflammaging”, que a su vez fue asociada a enfermedades neurodegenerativas tales como la enfermedad de Alzheimer (EA) y la enfermedad de Parkinson (EP). Por otra parte, se ha demostrado que el microbioma regula la activación de la microglía; pero también que cerebros de ratones desprovistos de gérmenes presentaban una microglía defectuosa, que se restableció parcialmente tras el restablecimiento de la comunidad microbiana a niveles de control [5].
On est en train de se rendre compte que la MP pourrait en fait provenir de l’intestin [6]. En effet, l’α-synucléine, l’agrégat de protéines caractéristique de la MP dans le cerveau, a également été identifiée dans les fibres nerveuses de la sous-muqueuse et de la muqueuse et dans les ganglions de patients parkinsoniens. Des données précliniques suggèrent même que l’α-synucléine présente dans l’intestin peut être transportée au cerveau par le nerf vague. En outre, des symptômes intestinaux fonctionnels tels que la constipation sont souvent des symptômes prodromiques se produisant des années avant l’apparition des symptômes moteurs.
Estamos en proceso de darnos cuenta de que en realidad la EP podría provenir del intestino [6]. En efecto, la α-sinucleína, el agregado de proteínas característico de la EP en el cerebro, también ha sido identificado en las fibras nerviosas de la submucosa y de la mucosa y en los ganglios de los pacientes con Parkinson. Datos preclínicos incluso sugieren que la α-sinucleína presente en el intestino puede ser transportada al cerebro por el nervio vago. Además, síntomas intestinales funcionales tales como la constipación a menudo son síntomas prodrómicos que se producen años antes de la aparición de los síntomas motores.
Desde que Scheperjans et al. demostraron por primera vez que existían alteraciones específicas en la composición del microbioma en la EP [7], muchos otros estudios se llevaron a cabo [8]. Sin embargo, a la fecha, no hay consenso acerca de la existencia de una firma microbiana específica. Cuando se colonizaron ratones con microbiota de pacientes afectados por EP vía trasplante de microbiota fecal, desarrollaron deficiencias motoras y una neuroinflamación, dos síntomas característicos de la EP [9]. Además, los síntomas mejoraron cuando los ratones fueron tratados con antibióticos. Estos estudios implicaron ácidos grasos de cadena corta para activar los procesos neuroinflamatorios en la EP [9].
El nervio vago está particularmente bien ubicado para conducir señales provenientes del intestino hacia el cerebro, ya sean de origen bacteriano, o vía traslocación, similar a la del prion, de la α-sinucleína. En efecto, estudios epidemiológicos basados en registros de pacientes daneses y suecos, han demostrado que una vagotomía troncular protege de la EP. A pesar de unas grandes expectativas en este ámbito, se debe ser prudente al analizar los datos disponibles, dado que provienen en gran medida de grupos pequeños y no tienen perspectiva longitudinal. Aun se necesitan muchos otros estudios mecanísticos para comprender cómo las modificaciones de la microbiota pueden moderar los síntomas motores y no motores de la EP y de sus comorbilidades [10].
El concepto según el cual los microbios pueden desempeñar un rol en la fisiopatología de la EA no es novedoso y la idea de que la amiloide, cuya agregación es una de las principales características de la EA, podría actuar como un péptido antimicrobiano en el cerebro es un concepto fascinante [11]. Sin embargo, según el postulado de Koch, es difícil de probar éticamente si existe una causa infecciosa de neuroinflamación y de neurodegeneración. Al igual que en la EP, la relación entre las proteínas intestinales y el estado de salud del cerebro es objeto de atención particular. Se ha descubierto que proteínas de tipo amiloide, producidas por bacterias, podrían aumentar las enfermedades asociadas a la α-sinucleína [12]. Otros trabajos son necesarios para validar estas estrategias en el hombre.
Recientemente, estudios transversales han identificado que los taxones bacterianos de Escherichia/Shigella, que están asociados a la mediación de la inflamación, habían aumentado en las muestras de heces de pacientes con EA en comparación con los individuos de control. Además, las modificaciones de la microbiota estaban correlacionadas con los niveles de citocinas proinflamatorias en sangre [13]. Estos resultados sugieren una relación causal entre la disbiosis de la microbiota intestinal y la inflamación sistémica, que puede iniciar o exacerbar el proceso neurodegenerativo cerebral en la EA. No obstante, estos estudios todavía son relativamente modestos y se necesitan muchas otras investigaciones en poblaciones de gran tamaño para evaluar la relación causal entre el microbioma intestinal y la EA.
En paralelo, se ha demostrado que un cierto número de modelos de EA en ratones transgénicos presentaba un microbioma alterado [14]. Estudios pioneros realizados en ratones desprovistos de gérmenes han evidenciado una ausencia pronunciada de acumulación de placas amiloides y de neuroinflamación [14]. Igualmente, el tratamiento crónico de los ratones transgénicos APP/PS1 con un cóctel de antibióticos reducía la acumulación de microglía y de astrocitos que rodean las placas amiloides en el hipocampo y provocaba una disminución de las placas amiloides insolubles [15]. Todos estos estudios muestran claramente que el microbioma regula los componentes moleculares clave de EA.
Está claro que el microbioma es de crucial importancia para el desarrollo y el mantenimiento apropiados de la función cerebral. Por otra parte, como se indica más arriba, numerosos datos derivados de estudios preclínicos y clínicos implican al microbioma en un espectro de enfermedades neurológicas y neurodegenerativas. Teniendo en cuenta los efectos pronunciados de la microbiota en la regulación de la función cerebral, es plausible que su composición afecte la progresión, la susceptibilidad y el tratamiento de casi todos los trastornos neurológicos. No obstante, nuestros conocimientos acerca del rol del microbioma en otras enfermedades neurodegenerativas tales como la esclerosis lateral amiotrófica o la enfermedad de Huntington presentan lagunas importantes, y se debe ser prudente para no sobreinterpretar estos estudios. El ámbito de investigación debe alejarse de los estudios correlativos para adoptar enfoques causales mecanísticos. Además, se necesitan más estudios de intervención que utilicen ratones probióticos y prebióticos; los trasplantes de microbiota fecal incluso podrían ser importantes en este ámbito. Es posible que enfoques similares puedan dirigirse a trastornos diferentes; por ejemplo, la modulación de la señalización de los linfocitos T en el cerebro puede ser útil para atenuar el estado neuroinflamatorio en los pacientes luego de un accidente cerebrovascular, así como en los pacientes con EA y durante el envejecimiento.
En lo que respecta a la neurología clínica, muchos pacientes son polimedicados y la relación entre el microbioma y la acción de los medicamentos se comprende cada vez mejor. En consecuencia, todos los estudios deberían apuntar a marcar la diferencia entre el impacto de los medicamentos y el de la enfermedad sobre el microbioma. Además, será importante realizar estudios temporales en individuos presintomáticos para determinar el rol potencial del microbioma como biomarcador de la enfermedad.
Es posible que la alimentación sea uno de los factores más importantes con influencia en el microbioma. Como numerosos trastornos neurológicos afectan el apetito, la deglución y la alimentación en general, es esencial tener datos nutricionales de buena calidad para todos los estudios que se desarrollen en el hombre a futuro. Además, esto permitirá comprender mejor la relación entre la alimentación, el microbioma y el cerebro, que es esencial desde el inicio de la vida y a medida que envejecemos.
