Tratamiento de la enfermedad de crohn activa con un régimen alimenticio ordinario que reproduce una nutrición enteral exclusiva
Artículo comentado - Niño
Por el Pr. Emmanuel Mas
Gastroenterología y nutricíon, Hospital de Niños, Toulouse, Francia

Comentario sobre el artículo original de Svolos et al. (Gastroenterology 2019 [1])
La nutrición enteral exclusiva (NEE) es el único tratamiento dietético establecido para la enfermedad de Crohn (EC), pero su aceptabilidad es limitada. La EC requiere nuevos tratamientos dietéticos.
Se evaluaron los efectos de un régimen alimenticio individualizado (CD-TREAT), cuya composición era similar a la de la NEE, analizando la composición de la microbiota intestinal, la inflamación y la respuesta clínica en una rata, en adultos con buena salud y en niños con recaída de EC.
In fine, se demostró que el régimen CD-TREAT reproducía las modificaciones de la NEE a nivel de la microbiota digestiva, disminuía la inflamación intestinal, era bien tolerado y potencialmente eficaz en pacientes afectados por una EC activa.
¿Qué sabemos sobre este tema?
La nutrición enteral exclusiva (NEE) es un tratamiento eficaz de la enfermedad de Crohn con afectación ileal. Permite obtener buenos resultados (cicatrización mucosa en el 80 % de los casos), mejores que los de una corticoterapia. Sin embargo, la principal dificultad radica en la aceptación de recibir, durante al menos 8 semanas, nutrición enteral exclusiva. Esta alimentación puetrarse por sonda nasogástrica o, como en el caso del Modulen IBD®,de adminis por vía oral. El mecanismo de acción de la NEE no está establecido claramente, pero varios estudios sugieren tiene un efecto sobre la modulación de la microbiota intestinal.
¿Cuáles son los principales resultados que aporta este estudio?
El objetivo de este estudio era saber si un régimen alimenticio ordinario (CD-TREAT), es decir, con alimentos habituales tomados por vía oral, pero adaptado para que su composición en nutrientes sea cercana a la de Modulen IBD®, podría ser eficaz para tratar la enfermedad de Crohn. Para ello, se disminuía la proporción de glúcidos y se aumentó la de proteínas; una mezcla multivitamínica permitía obtener aportaciones en micronutrientes similares a los de la NEE.
Se realizó un estudio con grupos cruzados (cross-over) en 25 adultos voluntarios sanos. Durante una semana recibieron ya fuera el régimen CD-TREAT, o bien una NEE y, después de un periodo de reposo, la otra dieta recíprocamente. El régimen CD-TREAT era más fácil de llevar a cabo y producía un mayor efecto de saciedad. La riqueza y la diversidad alfa de la microbiota no se modificaron por estos regímenes. Sin embargo, la abundancia relativa de 58 (49,3 %) y 38 (32,3 %) géneros bacterianos se vio significativamente modificada por la NEE y el CD-TREAT respectivamente, de entre los cuales 28 con la misma tenden cia.. Hay que señalar que se produjeron modificaciones de diferentes metabolitos (algunos ácidos grasos de cadena corta –el acetato, el propionato y el butirato disminuyeron significativamente después de la NEE o del régimen CD-TREAT) así como un aumento del pH de las heces de aproximadamente 1 unidad.
Los experimentos animales se realizaron en 5 grupos de ratas, HLA B27 (inflamatorio) y B7 (no inflamatorio): B27-NEE, B27-CD-TREAT, B27-CONTROL, B7-NEE y B7-CONTROL. NEE y CD-TREAT permitieron reducir la inflamación del íleon (Figura 1A), con disminución de IL-6 en el grupo B27-CD-TREAT respecto del B27- CONTROL (p = 0,036). Tras 4 semanas de intervención, la diversidad bacteriana fue más importante en el ciego (Figura 1B) y en las heces en las ratas B27-CD-TREAT y B27-NEE que en las ratas B27-CONTROL. Estos dos regímenes produjeron variaciones de los niveles de ciertos ácidos grasos de cadena corta en las heces.
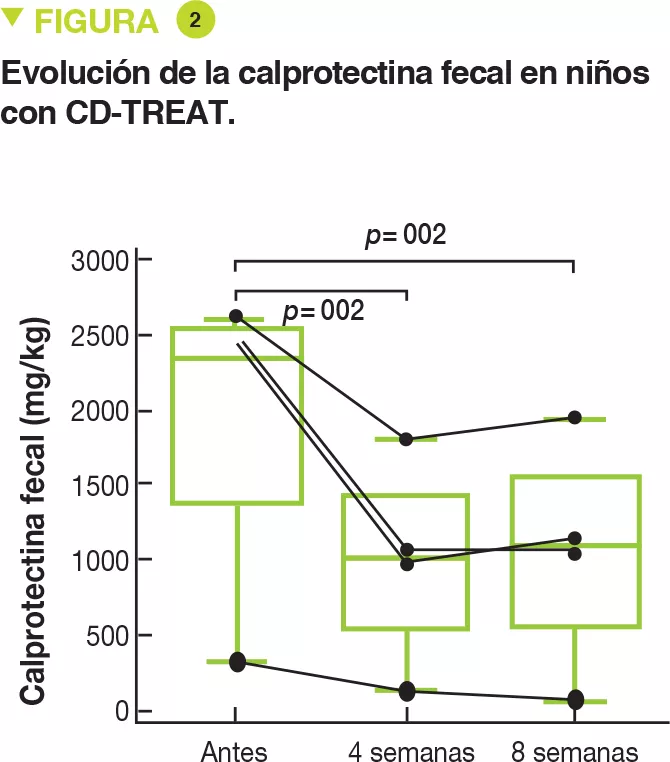
Por último, 5 niños con enfermedad de Crohn de ligera a moderada (wPCDAI entre 22,5 y 42,5) recibieron el régimen CD-TREAT durante 8 semanas. Un niño lo abandonó tras 9 días a causa de una exacerbación. Después de 4 semanas, 3 niños (60 %) tuvieron una respuesta clínica (disminución > 17,5 del wPCDAI) y 2 niños (40 %) se encontraban en remisión clínica (wPCDAI < 12,5). Tras 8 semanas, el 80 % de los niños (4/5) respondió clínicamente y el 60 % (3/5) se encontraba en remisión clínica. Por último, el nivel de calprotectina fecal, que era de 1 960 mg/kg de media antes del régimen, disminuyó un 53 y un 55 % respectivamente tras 4 y 8 semanas (Figura 2). El nivel de calprotectina solo se normalizó en un niño.
PUNTOS CLAVE
-
Un régimen adaptado por vía oral podría ser tan eficaz en la enfermedad de Crohn como una nutrición enteral exclusiva
-
Su efecto sobre la microbiota intestinal se asemeja el de una nutrición enteral exclusiva
-
Su uso ofrece una alternativa a la nutrición enteral exclusiva, mal aceptada por los pacientes
¿Cuáles son las consecuencias en la práctica?
Este estudio muestra por un lado que este régimen alimenticio se puede llevar a cabo más fácilmente por vía oral y que podría tener efectos similares a los de la NEE de Modulen IBD® en la microbiota intestinal. Por otro lado, este régimen CD-TREAT permite mejorar los síntomas clínicos y disminuir la inflamación intestinal.
Conclusión
Este estudio es una prueba de concepto de un nuevo manejo dietético, con una mejor tolerancia, que podría ser eficaz en el tratamiento de la enfermedad de Crohn. Es necesario confirmar estos resultados en un estudio aleatorizado controlado de tamaño suficiente.